Acetato básico de berílio
| Acetato básico de berílio Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | Hexa-μ-acetato(O,O')-μ4-oxo teraberyllium(II)[1] |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | C12H18Be4O13 |
| Aparência | colorless |
| Ponto de fusão |
285 °C |
| Ponto de ebulição |
330 °C |
| Solubilidade em água | chloroform |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Acetato básico de berílio é o composto químico com a fórmula Be4O(O2CCH3)6. Embora este composto não tenha grandes aplicações e tenha sido pouco estudado, ele possui uma estrutura e estabilidade térmica dignas de destaque. "Acetatos básicos" consistem de um conjunto de átomos de metais, um átomo central óxido, e um exterior de grupos acetato. Outra família de acetatos básicos são os trimetálicos com a fórmula M3O(O2CCH3)6(H2O)3 (M = Cr, Fe, Ru). Membros mistos em metais desta família também existem.
Estrutura[editar | editar código-fonte]
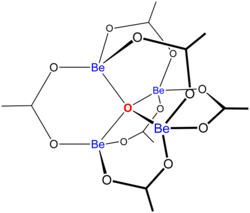

A estrutura do Be4O(O2CCH3)6 é relevante para sua considerável estabilidade. É um diamantóide, consistindo de anéis Be2O3C de seis membros interligados. A estrutura deste composto tem sido examinada por dois famosos laboratótios de cristalografia.[2][3]
Preparação[editar | editar código-fonte]
Para preparar Be4O(O2CCH3)6, carbonato básico de berílio é tratado com ácido acético quente. O produto é insolúvel em água mas solúvel em clorofórmio, indicativo de uma substância não polar. Funde-se a 284 °C e sublima-se no vácuo sem decomposiçao.[4]
Aplicações[editar | editar código-fonte]
A solubilidade do acetato básico de berílio em clorofórmio permite separações a partir de extratos, com finalidades concentrativas, sintéticas e analíticas, associadas ao elemento berílio. Cristais simples de acetato básico de berílio, com dimensões adequadas, podem ser facilmente preparados dissolvendo-se o sal em ácido acético quente e resfriando a solução. A adição de etanol acelera o processo. A cela cúbica, a quantidade de linhas bem indexáveis e a estabilidade do composto permitem preparar uma boa amostra para o alinhamento de instrumentos de Difração de Raios X, como os difratômetros automáticos para o estudo de monocristais.
Referências
- ↑ Lee, J. D. (2008). Concise Inorganic Chemistry 5th ed. [S.l.]: Wiley India. p. 232. ISBN 978-81-265-1554-7
- ↑ BRAGG, W. H (1923). Crystal Structure of Basic Beryllium Acetate (em inglês). 111. [S.l.]: Nature. 532 páginas
- ↑ PAULING, Linus; SHERMAN, J (1934). The Structure of the Carboxyl Group: II. The Crystal Structure of Basic Beryllium Acetate. (em inglês). 20. [S.l.]: National Academy of Sciences. pp. 340–5
- ↑ MOELLER, T.; COHEN, A. J.; MARVELL, E (1950). Basic Beryllium Acetate and Proprionate. Inorganic Syntheses McGraw-Hill (em inglês). 3. Nova Iorque: [s.n.] pp. 9–11
