Amida de sódio
Amida de sódio, comumente chamada sodamida, é o composto químico com a fórmula química NaNH2. Este sólido, o qual é perigosamente reativo com a água, é branco ou incolor quando puro, mas amostras comerciais são tipicamente cinzas devido a presença de pequenas quantidades de ferro metálico originário do processo de produção. Tais impurezas não afetam normalmente a utilidade do reagente. NaNH2 tem sido largamente empregado como base forte em síntese orgânica.
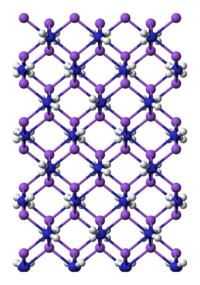
Preparação e estrutura[editar | editar código-fonte]
Amida de sódio pode ser preparada pela reação de sódio com gás amônia,[2] mas é usualmente preparado pela reação em amônia líquida usando nitrato de ferro (III) como catalisador. A reação é mais rápida ao ponto de ebulição da amônia, -33 °C.[3]
NaNH2 é um material salino e como tal, cristaliza num infinito polímero.[4] A geometria é tetraédrica.[5] Em amônia, NaNH2 forma soluções condutoras, consistente com a presença de ânions Na(NH3)6+ e NH2-.
Usos[editar | editar código-fonte]
Amida de sódio é usada na produção industrial de indigo, hidrazina, e cianeto de sódio.[6] É o reagente de troca para a secagem de amônia (líquida ou gasosa) e é também largamente usada como uma forte base em química orgânica, frequentemente em solução em amônia líquida. Um das principais vantagens para o uso da sodamida é que ela é uma excelente base e raramente serve como um nucleofílico. Ela é entretanto pouco solúvel e seu uso tem sido superado pelos reagentes relacionados tais como hidreto de sódio, Bis(trimetilsilil)amida de sódio (NaHMDS), e di-isopropilamida de lítio (LDA).
Preparação de alcinos[editar | editar código-fonte]
Amida de sódio induz a perda de duas moléculas de brometo de hidrogênio de um dibromoalcano vicinal para dar uma ligação tripla carbono-carbono, como na preparação de fenilacetileno abaixo.[7]
Cloreto de hidrogênio e/ou etanol podem também ser eliminados desta maneira,[8] como na preparação de 1-etoxi-but-1-ino.[9]
Reações de ciclização[editar | editar código-fonte]
Onde não há β-hidrogênio a ser eliminado, compostos cíclicos podem ser formados, como na preparação de metilenociclopropano abaixo.[10]
Ciclopropenos,[11] aziridinas[12] e ciclobutanos[13] podem ser formados de maneira similar.
Deprotonação de carbono e nitrogênio ácidos[editar | editar código-fonte]
Carbonos ácidos os quais podem ser deprotonados por amida de sódio em amônia líquida incluem alquinos terminais,[14] metil cetonas,[15] ciclohexanona,[16] ácido fenilacético e seus derivados[17] e difenilmetano.[18] Acetilacetona perde dois prótons para formar um diânion.[19]
Amida de sódio irá deprotonar indol[20] e piperidina.[21]
Outras reações[editar | editar código-fonte]
- Rearranjo com ortodeprotonação[22]
- Síntese de oxirano (por reação de carbeno?)[23]
- Síntese do indol[24]
- Reação de Chichibabin
Segurança[editar | editar código-fonte]
Amida de sódio reage violentamente com água produzindo amônia e hidróxido de sódio, e irá queimar ao ar resultando em óxidos de sódio e nitrogênio:
Na presença de limitadas quantidades de ar e umidade, tal como em embalagens pouco herméticas, misturas explosivas de produtos de oxidação podem se formar. Isto é acompanhado de amarelamento ou acastanhamento do sólido. Assim, amida de sódio deve sempre ser embalada em recipientes rigorosamente fechados, se possível sob atmosfera de nitrogênio.
Amostras de amida de sódio as quais estejam amarelas ou castanhas devem ser destruídas imediatamente: um método é a cuidadosa adição de etanol a uma suspensão de amida de sódio em um solvente hidrocarboneto.
Amida de sódio é corrosiva à pele, olhos e membranas mucosas. Cuidados devem ser tomados evitando a dispersão de poeira desta substância quando de sua manipulação.
Ver também[editar | editar código-fonte]
Referências
- ↑ Buncel, E.; Menon, B. (1977). «Carbanion mechanisms: VII. Metallation of hydrocarbon acids by potassium amide and potassium methylamide in tetrahydrofuran and the relative hydride acidities». Journal of Organometallic Chemistry. 141 (1): 1–7. doi:10.1016/S0022-328X(00)90661-2
- ↑ Bergstrom, F. W. (1955). "Sodium amide". Org. Synth. Coll. Vol. 3:778.
- ↑ Greenlee, K. W.; Henne, A. L. (1946). "Sodium Amide". Inorganic Syntheses 2:128–35.
- ↑ Zalkin, A.; Templeton, D. H. "The Crystal Structure Of Sodium Amide" Journal of Physical Chemistry 1956, Volume 60, pp 821 - 823. DOI: 10.1021/j150540a042
- ↑ Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- ↑ Predefinição:Merck12th
- ↑ Campbell, Kenneth N.; Campbell, Barbara K. (1950). "Phenylacetylene". Org. Synth. 30:72; Coll. Vol. 4:763.
- ↑ Jones, E. R. H.; Eglinton, Geoffrey; Whiting, M. C.; Shaw, B. L. (1954). "Ethoxyacetylene". Org. Synth. 34:46; Coll. Vol. 4:404.
Bou, Anna; Pericàs, Miquel A.; Riera, Antoni; Serratosa, Fèlix (1987). "Dialkoxyacetylenes: di-tert-butoxyethyne, a valuable synthetic intermediate". Org. Synth. 65:68; Coll. Vol. 8:161.
Magriotis, Plato A.; Brown, John T. (1995). "Phenylthioacetylene". Org. Synth. 72:252; Coll. Vol. 9:656.
Ashworth, P. J.; Mansfield, G. H.; Whiting, M. C. (1955). "2-Butyn-1-ol". Org. Synth. 35:20; Coll. Vol. 4:128. - ↑ Newman, Melvin S.; Stalick, W. M. (1977). "1-Ethoxy-1-butyne". Org. Synth. 57:65; 6:564.
- ↑ Salaun, J. R.; Champion, J.; Conia, J. M. (1977). "Cyclobutanone from methylenecyclopropane via oxaspiropentane". Org. Synth. 57:36; Coll. Vol. 6:320.
- ↑ Nakamura, Masuharu; Wang, Xio Qun; Isaka, Masahiko; Yamago, Shigeru; Nakamura, Eiichi (2003). "Synthesis and (3+2)-cycloaddition of a 2,2-dialkoxy-1-methylenecyclopropane: 6,6-dimethyl-1-methylene-4,8-dioxaspiro(2.5)octane and cis-5-(5,5-dimethyl-1,3-dioxan-2-ylidene)hexahydro-1(2H)-pentalen-2-one". Org. Synth. 80:144.
- ↑ Bottini, Albert T.; Olsen, Robert E. (1964). "N-Ethylallenimine". Org. Synth. 44:53; Coll. Vol. 5:541.
- ↑ Skorcz, J. A.; Kaminski, F. E. (1968). "1-Cyanobenzocyclobutene". Org. Synth. 48:55; Coll. Vol. 5:263.
- ↑ Saunders, J. H. (1949). "1-Ethynylcyclohexanol". Org. Synth. 29:47; Coll. Vol. 3:416.
Peterson, P. E.; Dunham, M. (1977). "(Z)-4-Chloro-4-hexenyl trifluoroacetate". Org. Synth. 57:26; Coll. Vol. 6:273.
Kauer, J. C.; Brown, M. (1962). "Tetrolic acid". Org. Synth. 42:97; Coll. Vol. 5:1043. - ↑ Coffman, Donald D. (1940). "Dimethylethynylcarbinol". Org. Synth. 20:40; Coll. Vol. 3:320.
Hauser, C. R.; Adams, J. T.; Levine, R. (1948). "Diisovalerylmethane". Org. Synth. 28:44; Coll. Vol. 3:291. - ↑ Vanderwerf, Calvin A.; Lemmerman, Leo V. (1948). "2-Allylcyclohexanone". Org. Synth. 28:8; Coll. Vol. 3:44.
- ↑ Hauser, Charles R.; Dunnavant, W. R. (1960). "α,β-Diphenylpropionic acid". Org. Synth. 40:38; Coll. Vol. 5:526.
Kaiser, Edwin M.; Kenyon, William G.; Hauser, Charles R. (1967). "Ethyl 2,4-diphenylbutanoate". Org. Synth. 47:72; Coll. Vol. 5:559.
Wawzonek, Stanley; Smolin, Edwin M. (1951). "α,β-Diphenylcinnamonitrile". Org. Synth. 31:52; Coll. Vol. 4:387. - ↑ Murphy, William S.; Hamrick, Phillip J.; Hauser, Charles R. (1968). "1,1-Diphenylpentane". Org. Synth. 48:80; Coll. Vol. 5:523.
- ↑ Hampton, K. Gerald; Harris, Thomas M.; Hauser, Charles R. (1971). "Phenylation of diphenyliodonium chloride: 1-phenyl-2,4-pentanedione". Org. Synth. 51:128; Coll. Vol. 6:928.
Hampton, K. Gerald; Harris, Thomas M.; Hauser, Charles R. (1967). - ↑ Potts, K. T.; Saxton, J. E. (1960). "1-Methylindole". Org. Synth. 40:68; Coll. Vol. 5:769.
- ↑ Bunnett, J. F.; Brotherton, T. K.; Williamson, S. M. (1960). "N-β-Naphthylpiperidine". Org. Synth. 40:74; Coll. Vol. 5:816.
- ↑ Brazen, W. R.; Hauser, C. R. (1954). "2-Methylbenzyldimethylamine". Org. Synth. 34:61; Coll. Vol. 4:585.
- ↑ Allen, C. F. H.; VanAllen, J. (1944). "Phenylmethylglycidic ester". Org. Synth. 24:82; Coll. Vol. 3:727.
- ↑ Allen, C. F. H.; VanAllen, James (1942). "2-Methylindole". Org. Synth. 22:94; Coll. Vol. 3:597.