Bcl-2
| editar |
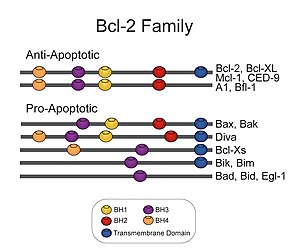
Bcl-2 refere-se a uma família de genes dos mamíferos e às proteínas a que estes genes dão origem. Estas regulam a permeabilidade da membrana externa da mitocôndria e podem ser, quer pró-apoptóticos (Bax, Bad, Bak e Bok, entre outros) quer antiapoptóticos (Bcl-2 propriamente dito, Bcl-xL, e Bcl-w, entre outros). Há um total de 25 genes na família Bcl2-2 conhecidos até ao presente. A nome Bcl-2 deriva, do inglês, "B-cell lymphoma 2", "linfoma de células B 2", dado ser o segundo membro de um conjunto de proteínas inicialmente descritas como uma translocação genética recíproca no cromossoma 14 e 18 em linfomas foliculares.
As proteínas Bcl-2 antiapoptóticas, incluindo a própria Bcl-2 (o membro fundador da família Bcl-2) e Bcl-XL compartilham quatro diferentes domínios de homologia com Bcl-2 (BH, homology domains e BHI-4). Proteínas Bcl-2 proapoptóticas consistem em duas subfamílias - as proteínas BH123 e as proteínas BH3-apenas. As principais proteínas BH123 são Bax e Bak, as quais são estruturalmente similares a Bcl-2, mas sem o domínio BH4. As proteínas BH3-apenas compartilham homologia de sequência com Bcl-2 somente no domínio BH3.
Essa proteína parece funcionar em um sistema de feedback com caspases: pode inibir a atividade da caspase, prevenindo a liberação do citocromo c da mitocôndria como também ligar-se ao fator ativador da apoptose (APAF-1).
Atributos proteicos da Bcl-2[editar | editar código-fonte]
Apresenta 239 aminoácidos e massa molecular de 26266 Da. Em sua estrutura quaternária forma homodímeros e heterodímeros com BAX, BAD, BAK e Bcl-XL. Os membros da família Bcl-2 são definidos pela presença de um a quatro blocos curtos de sequência proteica conservada denominados domínios BH (homologia Bcl-2). Os protetores antiapoptóticos Bcl-2 têm tipicamente quatro dos domínios. Os assassinos antiapoptóticos Bcl-2 têm tipicamente três destes domínios, enquanto os reguladores Bcl-2 têm apenas o domínio BH3. O domínio BH3 é uma pequena hélice que se encaixa em um sulco na superfície dos antiapoptóticos Bcl-2, formando complexos que regulam sua atividade.
Acredita-se que os protetores Bcl-2 regulam o comportamento dos assassinos Bcl-2 por uma interação similar. Por exemplo, a proteína Bcl-2 forma um complexo com um assassino pró-apoptótico Bcl-2 chamado Bax, interferindo assim na capacidade do Bax de matar células. A ligação de proteínas BH3-apenas aos protetores Bcl-2 pode inativar suas funções antiapoptóticas. Egl-1 é uma proteína BH3- apenas e é assim que ela desencadeia a apoptose. Uma nova geração de fármacos miméticos de BH3 induz a apoptose de células cancerígenas, mimetizando este segundo mecanismo.
A exemplo de algumas modificações pós-traducionais para o gene BCL-2, tem-se a fosforilação/desfosforilação em Ser-70, que regula a atividade antiapoptótica. A fosforilaçãoestimulada por fator de crescimento em Ser-70 por PKC é necessária para a atividade antiapoptose e ocorre durante a fase G2/M do ciclo celular. Na ausência de fatores de crescimento, a Bcl-2 parece ser fosforilada por outras proteínas quinases, como ERKs e quinases ativadas por estresse. Fosforilada por MAPK8 / JNK1 em Thr-69, Ser-70 e Ser-87, estimula a autofagia induzida por inanição. Defosforilada pela proteína fosfatase 2A (PP2A).
Pode ser clivada proteoliticamente por caspases durante a apoptose. A proteína clivada, sem o domínio BH4, tem atividade pró-apoptótica, que provoca a liberação do citocromo c no citosol, promovendo ainda mais a atividade de caspases.
Via intrínseca da apoptose[editar | editar código-fonte]
Com estímulo apoptótico para via intrínseca, proteínas BH123 formam oligômeros na parede externa da mitocôndria (Bak de maneira constitutiva e Bax e de forma induzida pelo estímulo). A ação delas depende da ativação das proteínas BH3-apenas. A Bax e a Bak também estão presentes associadas ao Retículo Endoplasmático e na membrana do núcleo, e agem liberação de Ca2+ em situação de estresse do RE, o que ativa a via intrínseca da apoptose.
As proteínas Bcl-2 antiapoptóticas estão presentes na membrana nuclear, RE e membrana externa da mitocôndria e atuam se ligando a uma próapoptótica que será inibida. Isso impede a liberação inapropriada de proteínas da mitocôndria e de Ca 2+. Um exemplo disso é quando essas proteínas antiapoptóticas se ligam a Bak na membrana externa da mitocôndria impedindo sua oligomerização e a consequente saída do citocromo c. Existem ao menos cinco proteínas Bcl-2 antiapoptóticas em mamíferos, e cada célula de mamífero requer ao menos uma para sobreviver. Entretanto, um número dessas proteínas deve ser inibido para que a via intrínseca induza apoptose; proteínas BH3-apenas fazem a mediação da inibição.
As BH3-apenas são a maior classe da Bcl-2 no mecanismo de apoptose. Elas atuam neutralizando aquelas proteínas antiapoptóticas ao se ligarem a elas. Por um mecanismo pouco entendido, a ligação e a inibição permitem o agregamento de Bax e Bak na superfície da mitocôndria, a qual dispara a liberação de proteínas mitocondriais intermembranas que induzem a apoptose. Algumas BH3-apenas podem ligar-se diretamente a BAK e BAX, disparando a apoptose, pela agregação dessas proteínas que pertencem à classe BH123 à membrana mitocondrial.
Proteínas BH3-apenas proporcionam a ligação crucial entre estímulos apoptóticos e a via intrínseca da apoptose, com diferentes estímulos ativando diferentes proteínas BH3-apenas. Quando algumas células são privadas de sinais de sobrevivência extracelulares, por exemplo, a via intrínseca é ativada por sinalização intracelular que depende da MAP-cinase JNK que ativa a transcrição do gene que codifica a proteína BH3-apenas Bim. De maneira semelhante, em resposta ao dano no DNA que não pode ser reparado, a proteína supressora tumoral p53 se acumula e ativa a transcrição de genes que codificam as proteínas BH3-apenas Puma e Noxa; essas proteínas BH3-apenas então disparam a via intrínseca, consequentemente eliminando a célula potencialmente danosa que poderia em algum momento se tornar cancerosa.
A Bcl-2 Bid faz a conexão entre as vias intrínseca e extrínseca, o que pode ser essencial em algumas células, através de mecanismo de clivagem de Bid pela caspase iniciadora gerando tBid. A tBid se transloca para a mitocôndria, onde inibe proteínas Bcl-2 antiapoptóticas e causa a agregação de proteínas BH123 próapoptóticas que liberam citocromo c e outras proteínas intermembranas, amplificando assim o sinal de morte. Bid, Bim e Puma são os ativadores mais potentes da apoptose na subfamília BH3-apenas de proteínas Bd2, já que podem inibir todas proteínas Bcl-2 antiapoptóticas.
Isoformas[editar | editar código-fonte]
As duas isoformas de Bcl-2, a isoforma 1, também conhecida como 1G5M, e a isoforma 2, também conhecida como 1G5O / 1GJH, exibem uma dobra semelhante. No entanto, os resultados na capacidade dessas isoformas de se ligarem às proteínas BAD e BAK, bem como na topologia estrutural e potencial eletrostático do sulco de ligação, sugerem diferenças na atividade antiapoptótica para as duas isoformas.
Função fisiológica normal[editar | editar código-fonte]
A Bcl-2 está localizada na membrana externa da mitocôndria, onde desempenha um papel importante na promoção da sobrevivência celular e na inibição das ações de proteínas pró-apoptóticas. As proteínas pró-apoptóticas da família BCL-2, incluindo Bax e Bak, atuam normalmente na membrana mitocondrial para promover a permeabilização e liberação do citocromo C e ROS, sinais importantes na cascata da apoptose. Essas proteínas pró-apoptóticas são, por sua vez, ativadas por proteínas somente BH3 e são inibidas pela função de BCL-2 e seu BCL-Xl relativo.
Existem outros papéis não canônicos do BCL-2 que estão sendo explorados. Sabe-se que o BCL-2 regula a dinâmica mitocondrial e está envolvido na regulação da fusão e fissão mitocondrial. Além disso, nas células beta pancreáticas, BCL-2 e BCL-Xl são conhecidos por estarem envolvidos no controle da atividade metabólica e secreção de insulina, com inibição de BCL-2 / Xl mostrando aumento da atividade metabólica, mas também produção adicional de ROS; isso sugere que tem um efeito metabólico protetor em condições de alta demanda
Papel na doença[editar | editar código-fonte]
Danos ao gene Bcl-2 foram identificados como uma causa de vários tipos de câncer, incluindo melanoma, mama, próstata, leucemia linfocítica crônica e câncer de pulmão, e uma possível causa de esquizofrenia e autoimunidade. É também uma causa de resistência aos tratamentos de câncer. Há estudos que também evidenciam participação de seus mecanismos na patogênese da esquizofrenia.
Câncer
Certas células normais produzem níveis relativamente altos de Bcl-2. Acredita-se que isso preserva células cuja morte seria devastadora para o organismo. O excesso de proteção, porém, tem um preço: quando se tornam cancerosas, elas costumam gerar tumores mais agressivos, já que resistem mais à morte programada.
O câncer pode ser visto como um distúrbio no equilíbrio homeostático entre o crescimento celular e a morte celular. A superexpressão de genes antiapoptóticos e a subexpressão de genes pró-apoptóticos podem resultar na falta de morte celular característica do câncer. Um exemplo pode ser visto nos linfomas. A superexpressão da proteína Bcl-2 antiapoptótica apenas nos linfócitos não causa câncer. Mas a superexpressão simultânea de Bcl-2 e do proto-oncogene myc pode produzir malignidades agressivas de células B, incluindo linfoma.
No linfoma folicular, uma translocação cromossômica comumente ocorre entre o décimo quarto e o décimo oitavo cromossomos - t (14; 18) - que coloca o gene Bcl-2 do cromossomo 18 próximo ao lócus da cadeia pesada da imunoglobulina no cromossomo 14. Esse gene de fusão é desregulado, levando à transcrição de níveis excessivamente altos de Bcl-2. Isso diminui a propensão dessas células para a apoptose
Isso parece ocorrer também com os melanócitos. Tais células, produtoras do pigmento melanina, que escurece a pele e ajuda a evitar a absorção de doses letais de luz solar, precisam ser protegidas porque sua morte precoce ameaçaria outras células da pele. Mas por causa dessa resistência à apoptose, os melanócitos, se há algum dano nos genes, geram tumores (melanomas) mais agressivos e que se espalham rapidamente.Proteínas da Família Bcl-2 em Câncer
Similarmente, no cancro da próstata, a expressão de Bcl-2 aumenta com a progressão do tumor de fenótipo dependente de androgênio em relação a fenótipo independente de androgênio. Nestes tumores, a regulação positiva de Bcl-2 ocorre presumivelmente numa fase posterior durante a tumorigênese. Vários estudos também sugerem a associação do homólogo Bcl-2 Bcl-xL ao câncer.
A supressão da apoptose pelas proteínas da família Bcl-2 confere também resistência a agentes quimioterapêuticos. Estudos in vitro em numerosas linhagens de células de câncer demonstram que a superexpressão de Bcl-2 ou Bcl-xL leva à resistência a múltiplos fármacos contra a maioria dos agentes testados. Vários estudos clínicos em câncer de próstata e leucemia linfocítica crônica mostram boa correlação dos níveis de expressão de Bcl-2 no tumor com resistência a drogas durante a terapia.
Doenças autoimunes
A apoptose desempenha um papel ativo na regulação do sistema imunológico. Quando funcional, pode causar imunossupressão aos auto-antígenos através da tolerância central e periférica. No caso de apoptose defeituosa, pode contribuir para aspectos etiológicos das doenças autoimunes. O diabetes tipo 1 da doença auto-imune pode ser causado por apoptose defeituosa, que leva à tolerância periférica a células T aberrantes e defeituosas. Devido ao fato de que as células dendríticas são as mais importantes células apresentadoras de antígenos do sistema imune, sua atividade deve ser rigidamente regulada por mecanismos como a apoptose. Pesquisadores descobriram que camundongos contendo células dendríticas incapazes de induzir apoptose efetiva, sofrem mais com doenças auto-imunes do que aquelas que têm células dendríticas normais. Outros estudos mostraram que o tempo de vida da célula dendrítica pode ser parcialmente controlado por um cronômetro dependente de Bcl-2 antiapoptótico.
Esquizofrenia
A esquizofrenia é um distúrbio psiquiátrico no qual uma relação anormal de fatores pró e antiapoptóticos pode contribuir para a patogênese. Algumas evidências sugerem que isso pode resultar da expressão anormal de Bcl-2 e aumento da expressão de caspase-3.
Estudos com Bcl-2[editar | editar código-fonte]
As proteínas Bcl-2 regulam primariamente a liberação de fatores promotores de morte das mitocôndrias quando as células recebem sinais que ativam a via intrínseca.
Foi identificado um gene, ced-9, que, no nematódeo C. Elegans, protege as células contra a apoptose e outro gene, o egl-1, que inativa a proteína ced-9 e desencadeia a apoptose. Nos mutantes em ced-9, muitas células que normalmente sobrevivem até a idade adulta morrem durante o desenvolvimento. Uma mutação de Ced-9 mata o verme. O Bcl-2 humano é funcional e estruturalmente homólogo ao Ced-9 de C. elegans e pode substituí-lo em vermes vivos. Esta capacidade de um gene humano para proteger os nematoides revela que a maquinaria fundamental da morte celular apoptótica foi conservada ao longo de grandes distâncias evolutivas.
A importância do oncogene Bcl-2 foi sublinhada quando se verificou ser um homólogo estrutural do inibidor de morte celular Ced-9 de C. elegans. De fato, o Bcl-2 poderia substituir parcialmente o ced-9 no nematódeo vivo. Mais trabalhos agora identificaram uma família de genes relacionados a Bcl-2 em vertebrados.
Experiências genéticas em ratos revelaram várias funções diferentes para os membros da família Bcl-2. Camundongos nascidos sem Bcl-2 têm deficiências do sistema imunológico que são melhor compreendidas se um dos papéis desta proteína in vivo é tornar os linfócitos resistentes a sinais pró-apoptóticos durante a maturação do sistema imune. Os ratinhos que não possuem outro membro da família pró-vida, Bcl-xL, morrem durante a embriogênese, aparentemente como resultado da morte generalizada de neurónios nos sistemas nervoso central e periférico e células hematopoiéticas no fígado. Em contraste, a perda dos pró-apoptóticos Bax mais Bak torna as células altamente resistentes à apoptose por uma ampla variedade de estímulos da via intrínseca.
Bcl-2 mostrou interações com RAD9A,[2] BAK1,[3][4] Reticulon 4,[5] Bcl-2-associated X protein,[2][3][6][7] Caspase 8,[8][9] BECN1,[10] SOD1,[11] Bcl-2-interacting killer,[12][13] BH3 interacting domain death agonist,[12][14] RRAS,[15] C-Raf,[16] BCL2L11,[12][17][18] BNIPL,[19][20] HRK,[12][21] PSEN1,[22] BMF,[23] BNIP2,[19][24] BNIP3,[24][25] Nerve Growth factor IB,[3] BCL2-like 1,[3][26] Myc,[27] BCAP31,[28] SMN1,[29] CAPN2,[30] PPP2CA,[31] Noxa,[12][32] Cdk1,[33][34] TP53BP2,[35] Bcl-2-associated death promoter[12][36] e IRS1.[37]
Referências
- ↑ Chao DT, Korsmeyer SJ. BCL-2 family: regulators of cell death. Annu Rev Immunol. 1998;16:395-419. Review.
- ↑ a b Komatsu, K; Miyashita T, Hang H, Hopkins K M, Zheng W, Cuddeback S, Yamada M, Lieberman H B, Wang H G (Jan. 2000). «Human homologue of S. pombe Rad9 interacts with BCL-2/BCL-xL and promotes apoptosis». ENGLAND. Nat. Cell Biol. 2 (1): 1–6. ISSN 1465-7392. PMID 10620799. doi:10.1038/71316
- ↑ a b c d Lin, Bingzhen; Kolluri Siva Kumar, Lin Feng, Liu Wen, Han Young-Hoon, Cao Xihua, Dawson Marcia I, Reed John C, Zhang Xiao-kun (Fev. 2004). «Conversion of Bcl-2 from protector to killer by interaction with nuclear orphan receptor Nur77/TR3». United States. Cell. 116 (4): 527–40. ISSN 0092-8674. PMID 14980220. doi:10.1016/S0092-8674(04)00162-X
- ↑ Enyedy, I J; Ling Y, Nacro K, Tomita Y, Wu X, Cao Y, Guo R, Li B, Zhu X, Huang Y, Long Y Q, Roller P P, Yang D, Wang S (Dez. 2001). «Discovery of small-molecule inhibitors of Bcl-2 through structure-based computer screening». United States. J. Med. Chem. 44 (25): 4313–24. ISSN 0022-2623. PMID 11728179. doi:10.1021/jm010016f
- ↑ Tagami, S; Eguchi Y, Kinoshita M, Takeda M, Tsujimoto Y (Nov. 2000). «A novel protein, RTN-XS, interacts with both Bcl-XL and Bcl-2 on endoplasmic reticulum and reduces their anti-apoptotic activity». England. Oncogene. 19 (50): 5736–46. ISSN 0950-9232. PMID 11126360. doi:10.1038/sj.onc.1203948
- ↑ Hoetelmans, R W M (Jun. 2004). «Nuclear partners of Bcl-2: Bax and PML». United States. DNA Cell Biol. 23 (6): 351–4. ISSN 1044-5498. PMID 15231068. doi:10.1089/104454904323145236
- ↑ Oltvai, Z N; Milliman C L, Korsmeyer S J (Ago. 1993). «Bcl-2 heterodimerizes in vivo with a conserved homolog, Bax, that accelerates programmed cell death». UNITED STATES. Cell. 74 (4): 609–19. ISSN 0092-8674. PMID 8358790. doi:10.1016/0092-8674(93)90509-O
- ↑ Poulaki, V; Mitsiades N, Romero M E, Tsokos M (Jun. 2001). «Fas-mediated apoptosis in neuroblastoma requires mitochondrial activation and is inhibited by FLICE inhibitor protein and Bcl-2». United States. Cancer Res. 61 (12): 4864–72. ISSN 0008-5472. PMID 11406564
- ↑ Guo, Yin; Srinivasula Srinivasa M, Druilhe Anne, Fernandes-Alnemri Teresa, Alnemri Emad S (Abr. 2002). «Caspase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria». United States. J. Biol. Chem. 277 (16): 13430–7. ISSN 0021-9258. PMID 11832478. doi:10.1074/jbc.M108029200
- ↑ Liang, X H; Kleeman L K, Jiang H H, Gordon G, Goldman J E, Berry G, Herman B, Levine B (Nov. 1998). «Protection against fatal Sindbis virus encephalitis by beclin, a novel Bcl-2-interacting protein». UNITED STATES. J. Virol. 72 (11): 8586–96. ISSN 0022-538X. PMC 110269
 . PMID 9765397
. PMID 9765397
- ↑ Pasinelli, Piera; Belford Mary Elizabeth, Lennon Niall, Bacskai Brian J, Hyman Bradley T, Trotti Davide, Brown Robert H (Jul. 2004). «Amyotrophic lateral sclerosis-associated SOD1 mutant proteins bind and aggregate with Bcl-2 in spinal cord mitochondria». United States. Neuron. 43 (1): 19–30. ISSN 0896-6273. PMID 15233914. doi:10.1016/j.neuron.2004.06.021
- ↑ a b c d e f Chen, Lin; Willis Simon N, Wei Andrew, Smith Brian J, Fletcher Jamie I, Hinds Mark G, Colman Peter M, Day Catherine L, Adams Jerry M, Huang David C S (Fev. 2005). «Differential targeting of prosurvival Bcl-2 proteins by their BH3-only ligands allows complementary apoptotic function». United States. Mol. Cell. 17 (3): 393–403. ISSN 1097-2765. PMID 15694340. doi:10.1016/j.molcel.2004.12.030
- ↑ Gillissen, Bernhard; Essmann Frank, Graupner Vilma, Stärck Lilian, Radetzki Silke, Dörken Bernd, Schulze-Osthoff Klaus, Daniel Peter T (Jul. 2003). «Induction of cell death by the BH3-only Bcl-2 homolog Nbk/Bik is mediated by an entirely Bax-dependent mitochondrial pathway». England. EMBO J. 22 (14): 3580–90. ISSN 0261-4189. PMC 165613
 . PMID 12853473. doi:10.1093/emboj/cdg343
. PMID 12853473. doi:10.1093/emboj/cdg343
- ↑ Real, Pedro Jose; Cao Yeyu, Wang Renxiao, Nikolovska-Coleska Zaneta, Sanz-Ortiz Jaime, Wang Shaomeng, Fernandez-Luna Jose Luis (Nov. 2004). «Breast cancer cells can evade apoptosis-mediated selective killing by a novel small molecule inhibitor of Bcl-2». United States. Cancer Res. 64 (21): 7947–53. ISSN 0008-5472. PMID 15520201. doi:10.1158/0008-5472.CAN-04-0945
- ↑ Fernandez-Sarabia, M J; Bischoff J R (Nov. 1993). «Bcl-2 associates with the ras-related protein R-ras p23». ENGLAND. Nature. 366 (6452): 274–5. ISSN 0028-0836. PMID 8232588. doi:10.1038/366274a0
- ↑ Wang, H G; Rapp U R, Reed J C (Nov. 1996). «Bcl-2 targets the protein kinase Raf-1 to mitochondria». UNITED STATES. Cell. 87 (4): 629–38. ISSN 0092-8674. PMID 8929532. doi:10.1016/S0092-8674(00)81383-5
- ↑ O'Connor, L; Strasser A, O'Reilly L A, Hausmann G, Adams J M, Cory S, Huang D C (Jan. 1998). «Bim: a novel member of the Bcl-2 family that promotes apoptosis». ENGLAND. EMBO J. 17 (2): 384–95. ISSN 0261-4189. PMC 1170389
 . PMID 9430630. doi:10.1093/emboj/17.2.384
. PMID 9430630. doi:10.1093/emboj/17.2.384
- ↑ Hsu, S Y; Lin P, Hsueh A J (Setembro de 1998). «BOD (Bcl-2-related ovarian death gene) is an ovarian BH3 domain-containing proapoptotic Bcl-2 protein capable of dimerization with diverse antiapoptotic Bcl-2 members». UNITED STATES. Mol. Endocrinol. 12 (9): 1432–40. ISSN 0888-8809. PMID 9731710. doi:10.1210/me.12.9.1432
- ↑ a b Qin, Wenxin; Hu Jian, Guo Minglei, Xu Jian, Li Jinjun, Yao Genfu, Zhou Xiaomei, Jiang Huiqiu, Zhang Pingping, Shen Li, Wan Dafang, Gu Jianren (Ago. 2003). «BNIPL-2, a novel homologue of BNIP-2, interacts with Bcl-2 and Cdc42GAP in apoptosis». United States. Biochem. Biophys. Res. Commun. 308 (2): 379–85. ISSN 0006-291X. PMID 12901880. doi:10.1016/S0006-291X(03)01387-1
- ↑ Yasuda, M; Han J W, Dionne C A, Boyd J M, Chinnadurai G (Fev. 1999). «BNIP3alpha: a human homolog of mitochondrial proapoptotic protein BNIP3». UNITED STATES. Cancer Res. 59 (3): 533–7. ISSN 0008-5472. PMID 9973195
- ↑ Inohara, N; Ding L, Chen S, Núñez G (Abr. 1997). «harakiri, a novel regulator of cell death, encodes a protein that activates apoptosis and interacts selectively with survival-promoting proteins Bcl-2 and Bcl-X(L)». ENGLAND. EMBO J. 16 (7): 1686–94. ISSN 0261-4189. PMC 1169772
 . PMID 9130713. doi:10.1093/emboj/16.7.1686
. PMID 9130713. doi:10.1093/emboj/16.7.1686
- ↑ Alberici, A; Moratto D, Benussi L, Gasparini L, Ghidoni R, Gatta L B, Finazzi D, Frisoni G B, Trabucchi M, Growdon J H, Nitsch R M, Binetti G (Out. 1999). «Presenilin 1 protein directly interacts with Bcl-2». UNITED STATES. J. Biol. Chem. 274 (43): 30764–9. ISSN 0021-9258. PMID 10521466. doi:10.1074/jbc.274.43.30764
- ↑ H Puthalakath; Villunger A; O'Reilly L A; Beaumont J G; Coultas L; Cheney R E; Huang D C; Strasser A (Set. 2001). «Bmf: a proapoptotic BH3-only protein regulated by interaction with the myosin V actin motor complex, activated by anoikis». United States. Science. 293 (5536): 1829–32. ISSN 0036-8075. PMID 11546872. doi:10.1126/science.1062257
- ↑ a b Boyd, J M; Malstrom S, Subramanian T, Venkatesh L K, Schaeper U, Elangovan B, D'Sa-Eipper C, Chinnadurai G (Out. 1994). «Adenovirus E1B 19 kDa and Bcl-2 proteins interact with a common set of cellular proteins». UNITED STATES. Cell. 79 (2): 341–51. ISSN 0092-8674. PMID 7954800. doi:10.1016/0092-8674(94)90202-X
- ↑ Ray, R; Chen G, Vande Velde C, Cizeau J, Park J H, Reed J C, Gietz R D, Greenberg A H (Jan. 2000). «BNIP3 heterodimerizes with Bcl-2/Bcl-X(L) and induces cell death independent of a Bcl-2 homology 3 (BH3) domain at both mitochondrial and nonmitochondrial sites». UNITED STATES. J. Biol. Chem. 275 (2): 1439–48. ISSN 0021-9258. PMID 10625696. doi:10.1074/jbc.275.2.1439
- ↑ Zhang, Haichao; Nimmer Paul, Rosenberg Saul H, Ng Shi-Chung, Joseph Mary (Ago. 2002). «Development of a high-throughput fluorescence polarization assay for Bcl-x(L)». United States. Anal. Biochem. 307 (1): 70–5. ISSN 0003-2697. PMID 12137781. doi:10.1016/S0003-2697(02)00028-3
- ↑ Jin, Zhaohui; Gao Fengqin, Flagg Tammy, Deng Xingming (Set. 2004). «Tobacco-specific nitrosamine 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone promotes functional cooperation of Bcl2 and c-Myc through phosphorylation in regulating cell survival and proliferation». United States. J. Biol. Chem. 279 (38): 40209–19. ISSN 0021-9258. PMID 15210690. doi:10.1074/jbc.M404056200
- ↑ Ng, F W; Nguyen M, Kwan T, Branton P E, Nicholson D W, Cromlish J A, Shore G C (Out. 1997). «p28 Bap31, a Bcl-2/Bcl-XL- and procaspase-8-associated protein in the endoplasmic reticulum». UNITED STATES. J. Cell Biol. 139 (2): 327–38. ISSN 0021-9525. PMC 2139787
 . PMID 9334338. doi:10.1083/jcb.139.2.327
. PMID 9334338. doi:10.1083/jcb.139.2.327
- ↑ Iwahashi, H; Eguchi Y, Yasuhara N, Hanafusa T, Matsuzawa Y, Tsujimoto Y (Nov. 1997). «Synergistic anti-apoptotic activity between Bcl-2 and SMN implicated in spinal muscular atrophy». ENGLAND. Nature. 390 (6658): 413–7. ISSN 0028-0836. PMID 9389483. doi:10.1038/37144
- ↑ Gil-Parrado, Shirley; Fernández-Montalván Amaury, Assfalg-Machleidt Irmgard, Popp Oliver, Bestvater Felix, Holloschi Andreas, Knoch Tobias A, Auerswald Ennes A, Welsh Katherine, Reed John C, Fritz Hans, Fuentes-Prior Pablo, Spiess Eberhard, Salvesen Guy S, Machleidt Werner (Jul. 2002). «Ionomycin-activated calpain triggers apoptosis. A probable role for Bcl-2 family members». United States. J. Biol. Chem. 277 (30): 27217–26. ISSN 0021-9258. PMID 12000759. doi:10.1074/jbc.M202945200
- ↑ Deng, X; Ito T, Carr B, Mumby M, May W S (Dez. 1998). «Reversible phosphorylation of Bcl2 following interleukin 3 or bryostatin 1 is mediated by direct interaction with protein phosphatase 2A». UNITED STATES. J. Biol. Chem. 273 (51): 34157–63. ISSN 0021-9258. PMID 9852076. doi:10.1074/jbc.273.51.34157
- ↑ Oda, E; Ohki R, Murasawa H, Nemoto J, Shibue T, Yamashita T, Tokino T, Taniguchi T, Tanaka N (maio de 2000). «Noxa, a BH3-only member of the Bcl-2 family and candidate mediator of p53-induced apoptosis». UNITED STATES. Science. 288 (5468): 1053–8. ISSN 0036-8075. PMID 10807576. doi:10.1126/science.288.5468.1053
- ↑ Pathan, N; Aime-Sempe C, Kitada S, Basu A, Haldar S, Reed J C (2001). «Microtubule-targeting drugs induce bcl-2 phosphorylation and association with Pin1». United States. Neoplasia. 3 (6): 550–9. ISSN 1522-8002. PMC 1506558
 . PMID 11774038. doi:10.1038/sj/neo/7900213
. PMID 11774038. doi:10.1038/sj/neo/7900213
- ↑ Pathan, N; Aime-Sempe C, Kitada S, Haldar S, Reed J C (2001). «Microtubule-targeting drugs induce Bcl-2 phosphorylation and association with Pin1». United States. Neoplasia. 3 (1): 70–9. ISSN 1522-8002. PMC 1505024
 . PMID 11326318. doi:10.1038/sj/neo/7900131
. PMID 11326318. doi:10.1038/sj/neo/7900131
- ↑ Naumovski, L; Cleary M L (Jul. 1996). «The p53-binding protein 53BP2 also interacts with Bc12 and impedes cell cycle progression at G2/M». UNITED STATES. Mol. Cell. Biol. 16 (7): 3884–92. ISSN 0270-7306. PMC 231385
 . PMID 8668206
. PMID 8668206
- ↑ Yang, E; Zha J, Jockel J, Boise L H, Thompson C B, Korsmeyer S J (Jan. 1995). «Bad, a heterodimeric partner for Bcl-XL and Bcl-2, displaces Bax and promotes cell death». UNITED STATES. Cell. 80 (2): 285–91. ISSN 0092-8674. PMID 7834748. doi:10.1016/0092-8674(95)90411-5
- ↑ Ueno, H; Kondo E, Yamamoto-Honda R, Tobe K, Nakamoto T, Sasaki K, Mitani K, Furusaka A, Tanaka T, Tsujimoto Y, Kadowaki T, Hirai H (Fev. 2000). «Association of insulin receptor substrate proteins with Bcl-2 and their effects on its phosphorylation and antiapoptotic function». UNITED STATES. Mol. Biol. Cell. 11 (2): 735–46. ISSN 1059-1524. PMC 14806
 . PMID 10679027
. PMID 10679027
ALBERT, B. et al. Biologia molecular da célula [recurso eletrônico]. Páginas 1121 a 1124. 5° ed. Porto Alegre: Artrned, 2010
Bcl-2. Science Direct. Disponível em: <https://www.sciencedirect.com/topics/ neuroscience/bcl-2>. Acesso em: 26 nov. 2018
Bcl-2 gene (protein coding). GeneCards. Disponível em: <https://www.genecards.org/cgi-bin/carddisp.pl?gene=BCL-2>. Acesso em: 26 nov. 2018




