Carbocátion

O termo carbocátion foi sugerido por George A. Olah para designar qualquer espécie catiônica do carbono.[1] Os carbocátions têm deficiência de elétrons, com apenas seis elétrons na camada de valência e, por causa disto, são ácidos de Lewis. Eles reagem rapidamente com as bases de Lewis (são altamente reativos e instáveis), sendo denominados eletrófilos. Os dois principais tipos de carbocátions são os íons carbênio e os íons carbônio. Os carbênios são espécies positivas trivalentes, que possuem uma estrutura planar com hibridização sp2 no carbono catiônico e um sexteto eletrônico. Eles são normalmente formados como intermediários reacionais em reações de solvólise de halogenetos de alquila (SN1), desidratação de álcoois e protonação de ligações π dentre outras, podendo ser considerados como os principais intermediários em química orgânica.[2] Os íons carbônio são espécies positivas pentavalentes, classificadas como carbocátions não-clássicos, apresentando o octeto eletrônico completo no átomo de carbono e possuindo ao menos uma ligação de três centros e dois elétrons, onde três átomos compartilham um par de elétrons (Figura 1). George A. Olah, em estudos envolvendo parafinas verificou que em meios superácidos os alcanos agem como bases, compartilhando o par de elétrons de suas ligações com o próton ácido. Assim, metano pode ser protonado em uma mistura equimolar de HSO3F e SbF5, conhecida com o nome de ácido mágico, para formar o CH5+ (carbônio), que pode reagir com outras moléculas de metano no meio para gerar espécies maiores.[2] Assim, são exemplos de íons carbênio os cátions terc-butila e benzila. Dentre os íons carbônio podemos destacar o cátion 2-norbornila.
Histórico

O cátion trifenilmetil foi o primeiro carbocátion estável reportado. Em 1899, Stieglitz abordou a possibilidade de compostos de hidrocarbonetos iônicos.[4] Em 1901 Norris, Kehrman e Wentzel [5][6] descobriram que o álcool incolor trifenilmetil gerava soluções amarelo-escuro em ácido sulfúrico concentrado, Figura 2, e de forma semelhante o cloreto de trifenilmetil formava complexos de cor alaranjada na presença de alumínio e estanho. Já em 1902 Adolf von Baeyer sugeriu uma correlação entre o aparecimento da cor e a formação do sal.[7]
A partir de 1920, diversos estudos sugeriam a participação de cátions de alquila simples, carbocátions, como intermediários em várias reações iônicas. Porém nessa altura ainda havia grande dificuldade em estudar tais compostos por causa de sua natureza instável e muito reativa. Em 1922 Meerwein criou o conceito moderno de carbocátion intermediário ao verificar que certos cloretos de ácidos de Lewis [(SbCl5, SnCl4, FeCl3, AlCl3 e SbCl3) e HCl seco] que promovem a ionização do cloreto de trifenilmetil por formação de complexos de carbocátions, também atuam nos rearranjo do cloreto de canfeno ao cloreto de isobornila (Rearranjo de Wagner). Na década de 1930, Frank Whitmore apresentava os carbocátions como estruturas instáveis e transientes e que não podiam ser observados diretamente.[8]
Desta forma, o conceito de carbocátion foi se desenvolvendo lentamente através de estudos de cinética, estereoquímica e produtos de uma grande variedade de reações. O avanço da espectrometria de massas contribuiu para a comprovação da existência de carbocátions gasosos.

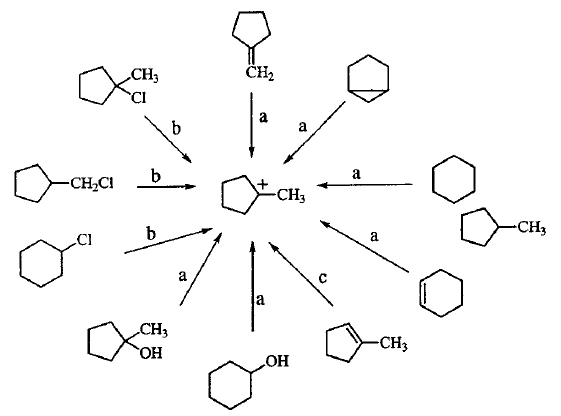
No final da década de 1950, George A. Olah observou pela primeira vez cátions alquila. Em 1962 Olah, então na Dow Química, relatou uma experiência em que o cátion terc-butila era formado, a partir da reação de fluoreto de terc-butila com pentafluoreto de antimônio, e permanecia em solução por longos períodos de tempo, permitindo um estudo detalhado da sua estrutura através de técnicas espectroscópicas como a ressonância magnética nuclear (RMN), Figura 3, e infravermelho. Na década de 1960 a utilização dos chamados superácidos passou a representar uma alternativa promissora para a obtenção de estabilidade de cátions alquila e carbocátions, possibilitando sua utilização em superfícies sólidas e zeólitas. Entre 1968-1970, DeMember e Commeyras, utilizando as técnicas de Infravermelho e Raman, conseguiram comprovar a estrutura planar do carbocátion.[11]
Em 1965, George A. Olah continuou suas pesquisas sobre carbocátions.Essas reações aconteciam em meios superácidos, utilizando principalmente o FSO3H-SbF5SO2, conhecido como "ácido mágico". Nesses meios, os carbocátions podiam ser estudados por técnicas espectroscópicas, como o espectrômetro de Ressonância Magnética Nuclear (RMN).[12] A partir desses estudos ele foi capaz de mostrar que praticamente todos os carbocátions poderiam ser preparados a partir de determinados condições de estabilidade: uso de vários ácidos fortes e solventes de baixa nucleofilicidade (SO2, SO2ClF, SO2F2), Figura 4.[13] Em 1994 Olah recebeu o prêmio Nobel pelo seu trabalho.
Estrutura e estabilidade

A estabilidade de carbocátions é a chave em diversos mecanismos de reação, particularmente perto de estados de transição, onde ligação de ruptura/processos de conformação modificam a densidade eletrônica de uma espécie. Assim, a sua estabilização ocorre com freqüência em sistemas que podem ser distorcidas de sua geometria de equilíbrio. A sua estabilidade depende particularmente da deslocalização da carga no conjunto das espécies químicas, e isto pode ser alcançado através de conjugação e hiperconjugação. Mesmo quando é de pequena magnitude, a hiperconjugação pode determinar a reatividade, sendo de primordial importância.[14][15]
A conformação desempenha um papel importante, e às vezes ela pode ser usado para mudar a deslocalização afastada (ligação desconjugada), e avaliar seus efeitos por diferença com a conformação conjugada. A conjugação envolve uma interação entre os orbitais π e supostamente implica em uma grande energia de estabilização (ou ressonância energética) e o efeito se estende por várias ligações. No caso do carbocátion, a deslocalização da carga corresponde à interação entre o orbital π vazio do centro da carbocátion, e, pelo menos, um orbital π cheio expandido em átomos vizinhos (Figura 5a).[16] Analisando um cátion alílico como um sistema modelo para avaliar essa estabilização, verifica-se na Figura 5b o efeito da hiperconjugação envolvendo orbitais CH cheios, que são, em princípio, inferior em energia. Desta forma, o efeito é em princípio maior para a conjugação do que para hiperconjugação.

Desta forma, a estabilidade dos carbocátions está relacionada com a dispersão da carga positiva. Em solução, os carbocátions podem ficar livres (mais provável em solventes polares, no qual estará solvatado), ou pode existir como par iônico (solventes apolares). Assim, os carbocátions formados em solução sofrem solvatação reduzindo a energia e permitindo sua formação por um tempo de meia vida suficiente para realizar interações com outras moléculas.
Carbocátions alquila simples: o cátion terc-butil é o mais estável de todos os cátions alquila, Figura 6. Ao reagir metano, etano e propano com meio reacional contendo superácido, também gera-se o cátion terc-butila como produto principal. Os fluoretos de propila geram o cátion isopropila. Os quatro fluoretos de butila geram o cátion terc-butila e o butano em meio superácido gera apenas o cátion terc-butila, Figura 7. Mesmo em meios reacionais superácidos, os carbocátions primários não apresentam estabilidade suficiente para serem detectados. Cátions do tipo alílico: Cátions alila e benzila são mais estáveis (efeito da ressonância) que a maioria dos outros carbocátions, uma vez que as moléculas que os formam são bastante reativas. Cátions alílicos estáveis podem ser obtidos pela reação entre halogenetos de alquila, alcoóis, ou alquenos (por extração de hidreto) e SbF5 em SO2 ou SO2ClF.

Cátions ciclopropilmetil: São mais estáveis que os cátions benzila. Podem ser preparados pela solução do álcool correspondente em ácido sulfúrico. A maior estabilização está relacionada à preferência da conformação bissectada do cátion ciclopropilmetil em comparação a conformação perpendicular. Desta forma, ocorre um alinhamento dos orbitais da ligação C-C do ciclopropil para efetiva sobreposição dos orbitais.

Outros tipos de estruturas: A presença de um heteroátomo com par de elétrons não compartilhado (O, N, halogênios) adjacente ao centro catiônico, aumenta a estabilidade do carbocátion. Alcóxi e dialquilamino são exemplos deste efeito. Uma indicação da participação dos substituintes de oxigênio é a existência de uma barreira de rotação da ligação C-O de 14Kcal mol-1. Este efeito também é observado na presença de elementos bastante eletronegativos como o flúor (F2CH+ > FCH2+ > F3C+ > CH3+). No entanto a presença de grupos atratores de elétrons desestabilizam carbocátions adjacentes. Carbocátions com hibridização sp são menos estáveis que os carbocátions sp2, devido o aumento do caráter s (mais eletronegativo) do orbital [afinidade por hidreto: CH3CH2+ (274 Kcal mol-1) > CH2=CH+ (287 Kcal mol-1) >CH3+ (314 Kcal mol-1)]. O cátion fenila é muito instável (afinidade por hidreto 298 Kcal mol-1), e a geometria do anel impede a rehibridização e estabilização por ressonância. Carbocátions com hibridização sp2 tendem a apresentar geometria trigonal plana, no entanto fatores estruturais que dificultam essa geometria tendem a desestabilizá-lo.
Existem dois efeitos eletrônicos que estabilizam os carbocátions, a hiperconjugação e o efeito de ressonância. A estabilidade referente à hiperconjugação é o resultado da sobreposição de um orbital p com um orbital molecular ligante vizinho, como as ligações C-H ou C-C.

Os carbocátions alílicos e benzílicos são estabilizados pelo efeito de ressonância. Quanto mais substituído o carbono onde se localiza a carga positiva, mais estável o cátion (maior dispersão dos elétrons). É importante ressaltar que cátion vinila não é estável, pois a carga positiva está em um orbital sp, mais eletronegativo
Aumento da estabilidade:
Cátion alílico terciário > cátion alílico secundário > cátion alílico
Cátion benzílico terciário > cátion benzílico secundário > cátion benzílico
Tabela 1. Energia de estabilização para carbocátions deslocalizados (kcal mol-1)
| Carbocátion | Energia de estabilização (kcal mol-1) |
|---|---|
| C6H5CH2+ | 76,4 |
| (C6H5)2CH+ | 102,7 |
| (C6H5)3C+ | 124,8 |
A estabilização de carbocátions também pode ocorrer pela presença de elétrons não ligantes (O, N, halogênios), como já abordado anteriormente
Propriedades e reações envolvendo carbocátions
Um carbocátion quando se forma ao longo de um mecanismo de reação, pode seguir três caminhos diferentes, dependendo de sua estrutura: sofrer rearranjo buscando maior estabilidade; perder um próton na presença de base forte e gerar um alqueno; e por último pode ser conectado em um nucleófilo.
Rearranjo: Pode acontecer com migração de hidreto ou através de migração de metila.
Eliminação de próton: O carbocátion na presença de uma base forte elimina um próton e forma olefina (alceno). No processo de eliminação de próton é comum se aplicar à regra de Saytzeff (formará em maior proporção o alqueno que possuir o maior número de substituintes alquila conectado no carbono sp2).

Interação com nucleófilo: O carbocátion ao se formar pode interagir com espécies negativas (nucleófilo) do meio reacional.

Existem dois modos gerais para a formação dos carbocátions:
- Ionização direta
- A adição de uma espécie positiva em um sistema insaturado.
Além disso, temos as reações que envolvem a participação de intermediários de carbocátions:
- Alquilação e acilação de Friedel-Crafts
- Reações de fragmentação;
- Reações de formação da ligação C-C: i) adição de alquenos em carbocátions; ii) reação de acilação de halotos ácidos com alquenos; iii) reação de Prins (adição de alquenos em aldeídos).
- Reações de transposição ou rearranjo: normalmente gerada pela migração de um grupo alquila, arila ou H. Essas reações exigem a co-planaridade entre o orbital p do cátion e o orbital σ do grupo que migra. A capacidade migratória segue a ordem: grupo arila > grupo alquila ramificado > grupo alquila. Outro tipo de reação de transposição envolvendo carbocátions são: transposição pinacolínica, reação de Tiffeneau-Demjanof e rearranjo de Favorskii.

Carbocátions não-clássicos
Os carbocátions não-clássicos (íons carbônio) são espécies catiônicas em que o octeto eletrônico do átomo de carbono é mantido, como já abordado. Os íons carbônio estão envolvidos em reações de protonação de alcanos em meios superácidos. Esses íons são espécies positivamente carregadas que não podem ser representadas por uma única estrutura de Lewis. Contém uma ou mais pontes de carbono ou hidrogênio, unindo dois centros deficientes de elétrons. Segundo Olah, a ligação de três centros é formada pela aproximação e sobreposição de um orbital vazio e uma ligação sigma, forçando a partilha do par de elétrons pelos três núcleos.

Um aspecto importante de se conhecer é a estabilidade relativa dos íons pentacoordenados. Pelos estudos de protonação de alcanos em meios superácidos e análise dos produtos de reação, Olah propôs[17] a seguinte ordem de reatividade para as ligações sigma: 3º C-H > C-C > 2º C-H > 1º CH > CH4. Ele enfatizou que esta ordem é puramente qualitativa e bastante dependente de efeitos estéricos do hidrocarboneto e do sistema superácido.[18] A ligação de 3 centros e 2 elétrons nos íons carbônio pentacoordenados é bastante fraca, podendo quebrar-se com relativa facilidade.
Em todos os estudos teóricos sobre íons carbônio, as estruturas de mais baixa energia têm simetria Cs, justificando a estabilidade dos íons carbônio e sua decomposição aos íons carbênio. Os íons C-carbônio são mais estáveis que os respectivos H-carbônio. Esta ordem de estabilidade pode ser explicada através da distribuição de carga nos átomos e grupos da ligação de 3 centros e 2 elétrons. Os íons carbônio têm papel importante na funcionalização eletrofílica de alcanos, como a nitração, halogenação e oxi-funcionalização. Dois exemplos importantes de íons carbônio são os cátions norbonila e biciclobutônico. O cátion norbonila foi estudado por Wagner[19] e Winstein[20] e Olah, que durante seus estudos verificou que a formação do cátion 2-norbonila σ-deslocalizado a partir de precursores 2-norbonil representa o equivalente a uma σ-alquilação intramolecular, onde a ligação covalente C1-C6 fornece os elétrons para os 3 centros e 2 elétrons ligados em ponte.

Vários estudos foram realizados ao longo das décadas sobre diferentes carbocátions não-clássicos, envolvendo reações solvolíticas e a estabilidade de íons em meios superácidos. Estes estudos mostraram que a hipercoordenação do carbono é um fenômeno geral de sistemas hidrocarbônicos com deficiência de elétrons. Os principais íons estudados e seus pesquisadores são apresentados abaixo:

Referências
- ↑ Olah, G. A.; J. Am. Chem. Soc. 1972, 94, 808
- ↑ a b Mota, C.J.A.; Química Nova, 2000, 3, 23.
- ↑ Olah, G. A.; J. Org. Chem. 2001, 66, 5943
- ↑ Stieglitz, J. Am. Chem. J. 1899, 21, 110.
- ↑ Norris, J. F. Am. Chem. J. 1901, 25, 117.
- ↑ Kehrmann, F.; Wentzel, F. Chem. Ber. 1901, 34, 3815.
- ↑ Baeyer, A.; Villiger, V. Chem. Ber. 1901, 35, 1189; 3013.
- ↑ Whitmore, F. C. J. Am. Chem. Soc. 1932, 54, 3274, 3276; Ann. Rep. Prog. Chem. (Chem. Soc. London) 1933, 177; Chem. Eng. News 1948, 26, 668.
- ↑ Olah, G. A.; J. Org. Chem. 2001, 66, 5943
- ↑ Olah, G. A.; J. Org. Chem. 2001, 66, 5943
- ↑ Olah, G. A.; DeMember, J. R.; Commeyras, A.; Bribes, J. L. J. Am. Chem. Soc. 1971, 93, 459.
- ↑ A review of the extensive studies of carbocations in superacid media is available in G.A>Olah, G.K.Surrya Prakash, and J.Sommer,Super Acids,Jonh Wiley & Sons,New York, 1985
- ↑ Olah, G. A. Angew. Chem., Intl. Ind. 1973, 12, 173; Angew. Chem. 1973, 85, 183. Olah, G. A. Carbocations and Electrophilic Reactions; Verlag Chemie:Weinheim, Wiley: New York, 1974.
- ↑ Fernandez, I.; Wu, J. I.; Schleyer, P.V.R. Org. Lett 2013, 15, 2990
- ↑ Müller, T.; Margraf, D.; Syha, Y. J. Am. Chem. Soc. 2005, 127, 1085
- ↑ Alabugin, I. V.; Gilmore, K. M.; Peterson, P.W. WIREs Comput. Mol. Sci. 2011, 1, 109
- ↑ Olah, G. A.; Halpern, Y.; Shen, J.; Mo, Y. K.; J. Am. Chem. Soc. 1973, 95, 4960.
- ↑ Em superácidos, acredita-se que as espécies protonante sejam do tipo H2F+ e H2SO3F+ solvatados. (a) Thompson, R. C.; Barr, J.; Gillespie, R. J.; Milne, J. B.; Rothenbury, B. A.; Inorg. Chem. 1965, 4, 1641. (b) Gillepspie, R. J.; Moss, K. C.; J. Chem. Soc. A 1966, 1170. (c) Commeyras, A.; Olah, G. A.; J. Am. Chem. Soc. 1969, 91, 2929.
- ↑ Wagner, G.; Brickner, W.; Ber. 1899, 32, 2307.
- ↑ Meerwein, H.; van Emster, K.; Chem. Ber. 1922, 55, 2500.


