Cloreto de acila
Este artigo não cita fontes confiáveis. (Julho de 2021) |
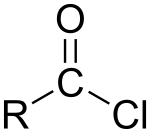
Em química orgânica, um cloreto de acila (ou cloreto ácido) é um composto orgânico o qual é um reativo derivado de um ácido carboxílico. Como parte de sua estrutura molecular, um cloreto de acila tem o grupo funcional reativo -CO-Cl. Um cloreto de acila tem a fórmula geral RCOCl aonde R é um grupo radical orgânico.

cloreto de acetila
Cloretos de acilas são um dentre os haletos de acila e intermediam muitos das reações químicas mencionadas em haleto de acila. Um exemplo específico de uma cloreto de acila é o cloreto de acetila (IUPAC name: ethanoyl chloride) CH3COCl.
Reações químicas[editar | editar código-fonte]
Cloretos de acila são muito reativos. A presença de cloro sobre o carbono da carbonila produz um eletrófilo muito bom, desde que tanto o oxigênio e cloro são fortemente relevantes removedores de elétrons, dando o carbono uma grande carga parcial positiva. Isto significa que um fraco nucleófilo pode atacar o carbono. Desde que um íon cloro é um bom grupo lábil, ele irá prontamente substituí-lo com o nucleófilo. Cloretos de acila podem ser usados para preparar qualquer derivado de ácido carboxílico: um anidrido de ácido, um éster ou uma amida por reagir um cloreto de ácido com: um sal de um ácido carboxílico, um álcool ou um reagente de Gilman (composto ditiorganocobre de lítio), respectivamente. Na maioria destas reações, HCl (cloreto de hidrogênio ou ácido clorídrico) é também formado do cloro no cloreto de acila combinando com um hidrogênio do reactante.
De maneira geral:
- R-COCl + HO-H → R-COOH + HCl
Cloreto de acila devem também reagir em condições anidras para prevenir a hidrólise do cloreto de acila pela umidade do ar.
Com carbonos nucleófilicos tais como os reagentes de de Grignard, cloretos de acila geralmente reagem primeiramente com a cetona e então com um seguinte equivalente a um álcool terciário. Uma notável exceção é a reação de haletos de acila com certos reagentes organocádmio os quais param no estágio cetona.
Cloreto de ácido de ácidos aromáticos são geralmente menos reatvos que ácidos de alquila e então algumas codições mais rigorosas são requeridas para a reação.
Cuidados[editar | editar código-fonte]
Porque os cloretos de acila são produtos tão reativos, eles são geralmente tóxicos e precauções especiais devem ser tomadas enquanto se os manuseia. Eles são substãncias lacrimogênicas porque podem reagir com água na superfície dos olhos produzindo ácido clorídrico e ácidos orgânicos irritando-os. Problemas similares podem resultar se inala-se vapores de cloretos de acila.
Sínteses[editar | editar código-fonte]
Cloretos de acila são frequentemente preparados por reação de um ácido carboxílico com cloreto de tionila.
- R-COOH + SOCl2 → R-COCl + SO2 + HCl
O dióxido de enxofre (SO2) e o cloreto de hidrogênio (HCl) generalmente são ambos gases os quais podem vazar o recipiente de reação, conduzindo a reação para o exterior. Eles são ambos gases tóxicos.
Cloretos de acila podem também ser preparados usando certos reagentes cloretos de fósforo, tais como o tricloreto de fósforo ou pentacloreto de fósforo:
- R-COOH + PCl5 → R-COCl + POCl3 + HCl
