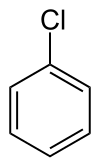
Clorobenzeno
Clorobenzeno ou cloreto de fenila é um composto orgânico aromático com fórmula química C6H5Cl. É um líquido incolor e inflamável, obtido pela primeira vez em 1851 através da reação entre fenol e pentacloreto de fósforo.
Possui um índice refrativo (n20) = 1,525 .
Usos[editar | editar código-fonte]
O clorobenzeno é utilizado na fabricação de diversos pesticidas, principalmente o DDT através de sua reação com cloral (tricloroacetaldeído).
Também foi utilizado na produção de fenol.[1]
- C6H5Cl + NaOH → C6H5OH + NaCl
Atualmente, as maiores utilidades do clorobenzeno são como intermediário na produção de nitroclorobenzenos e óxidos difenílicos, que são importantes na produção de commodities como herbicidas, corantes e borracha. Tem aplicação também como solvente não-protonado na química orgânica, sendo utilizado como solvente de tintas e para desengraxar materiais automotivos.
Clorobenzeno é também usado como um solvente de alto ponto de ebulição em muitas aplicações industriais assim como em laboratório.[2] Clorobenzeno é nitrado em uma larga escala para dar a mistura de 2- e 4-nitroclorobenzenos, os quais podem ser separados por cristalização fracionada seguida por destilação. 2-Nitroclorobenzeno (CAS#88-73-3) é convertido ao relacionado 2-nitrofenol, 2-nitroanisol, bis(2-nitrofenil)dissulfeto, e 2-nitroanilina por deslocamento nucleofílico do cloro com hidróxido de sódio, metóxido de sódio, dissulfeto de sódio e amônia. A conversão do 4-nitroclorobenzeno (CAS#100-00-5) é similar.[3]
Síntese[editar | editar código-fonte]
Clorobenzeno foi primeiramente descrito em 1851. Atualmente é produzido por cloração de benzeno na presença de uma quantidade catalítica de um ácido de Lewis tal como o cloreto férrico e cloreto de alumínio anidro:
- C6H6 (benzeno) + Cl2 (gás cloro) → C6H5Cl (clorobenzeno) + HCl (ácido clorídrico)
O catalisador aumenta a eletrofilicidade do cloro. Porque o cloro é eletronegativo, C6H5Cl exibe uma menor suscetibilidade ao ataque por outros eletrófilos. Por esta razão, o processo de cloração produz somente pequenas quantidades de dicloro- e triclorobenzenos.
Referências
- ↑ Manfred Weber, Markus Weber, Michael Kleine-Boymann, “Phenol” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. doi:299.pub2 10.1002/14356007.a19 299.pub2
- ↑ Manfred Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi:233.pub2 10.1002/14356007.a06 233.pub2
- ↑ Gerald Booth (2007). "Nitro Compounds, Aromatic". In: Ullmann's Encyclopedia of Industrial Chemistry. John Wiley & Sons: New York. doi:10.1002/14356007.a17_411