Correlação linear de energia livre
As correlações lineares de energia livre demonstram a interdependência entre a constante de velocidade ou equilíbrio com algum parâmetro estrutural, e são aplicadas com êxito, para um grande número de reações químicas. Exemplos destas correlações são: a equação catalítica de Brønsted, equação de Hammett, equação de Yukawa-Tsuno, entre outras.
Estabelecer relações de energia livre ajuda na compreensão do mecanismo de reação para uma reação química e permite a previsão das taxas de reação e constantes de equilíbrio.
Tem sido sugerido que este nome fosse substituído por correlações lineares de energia livre de Gibbs, mas, atualmente, há poucos sinais de aceitação desta mudança.[1]
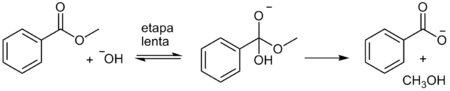
Se as taxas de uma série de reações mostram uma satisfatória correlação, ambos, sinal e magnitude de ρ provem informações acerca do estado de transição e intermediários de reação. Como exemplo, temos o valor de ρ para a hidrólise de uma série de benzoatos de metila igual a +2,38. Isto indica que a reação é mais sensível para o efeito do substituinte do que para ionização de ácidos benzóicos substituídos.[2]
Já a solvólise de cloretos de diarilmetila em etanol correlacionada com os valores de σ+ mostra um valor de ρ igual a –4,2. Isto é consistente com um mecanismo envolvendo a formação de um carbocátion na etapa controladora da velocidade de reação. Este valor de ρ indica que a reação é muito sensível ao efeito do substituinte e implica que existe uma relativa redistribuição de carga no estado de transição.

A magnitude do efeito substituinte é diferente em solução quando comparada à fase gasosa. Em geral, efeito do substituinte é muito mais forte em fase gasosa pois não existe efeito de nivelamento do solvente. Um exemplo disso é a ionização do ácido benzóico, o efeito do substituinte em termos de ΔH é cerca de 11 vezes maior em fase gasosa do que em meio aquoso.[3] Em outros casos isto pode indicar que a separação de cargas implicadas pelas estruturas de ressonância torna-se facilitada pela solvatação.

Um levantamento feito no SciFinder buscando o tópico "linear free energy relationship" mostrou que o número de publicações nestas duas últimas décadas é bastente expressivo.
Referências[editar | editar código-fonte]
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8.doi:10.1351/goldbook
- ↑ S. Nishida, J. Org. Chem., 32, 2692 (1967).
- ↑ R. W. Taft and R. D. Topsom, Prog. Phys. Org. Chem., 16, 1 (1987).
