Acetato de sódio
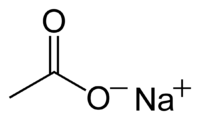
Acetato de sódio, também chamado etanoato de sódio, é um composto cristalino incolor, de fórmula ( NaO2CCH3 ), possuindo massa molar de 82,03378928. Apresenta-se normalmente na forma de sal anidro ou trihidratado. Ambas as formas são solúveis em água e em etoxietano e ligeiramente solúveis em etanol.
Aplicações[editar | editar código-fonte]
Indústria[editar | editar código-fonte]
Acetato de sódio é usado na indústria têxtil para neutralizar correntes de rejeitos contendo ácido sulfúrico, e como um fotorresistente quando usa-se corantes à anilina. Também é um agente de decapagem em curtimento ao cromo, e auxilia a retardar vulcanização de cloropreno em produção de borracha sintética.
Soluções tampão[editar | editar código-fonte]
Como o acetato de sódio é um sal de uma base forte e de um ácido fraco, como uma base conjugada de um ácido fraco, uma solução de acetato de sódio e ácido acético podem atuar como um tampão para manter um pH relativamente constante, sendo usado na formulação de tampões para controle de pH em muitas aplicações de laboratório.[2] Isto é especialmente útil em aplicações bioquímicas onde as reações são dependentes do pH.
A equação de Henderson-Hasselbalch pode ser utilizada para se calcular a concentração de ácido acético e acetato de sódio necessárias para o preparo da solução tampão para diferentes pH[3].
Uma tabela de pH em função das formulações de soluções tampão acetato de sódio e ácido acético:
[4]
| pH | Ácido acético 99%mL | 100mL Acetato de sódio anidro g/100mL |
|---|---|---|
| 3,6 | 1,11 | 0,123 |
| 3,8 | 1,06 | 0,197 |
| 4,0 | 0,98 | 0,295 |
| 4,2 | 0,88 | 0,435 |
| 4,4 | 0,76 | 0,607 |
| 4,6 | 0,61 | 0,804 |
| 4,8 | 0,48 | 0,984 |
| 5,0 | 0,35 | 1,156 |
| 5,2 | 0,25 | 1,296 |
| 5,4 | 0,17 | 1,402 |
| 5,6 | 0,11 | 1,484 |
Alimentos[editar | editar código-fonte]
Pode ser adicionado como um amortecedor no controle do pH dos alimentos durante as várias etapas de seu processamento, bem como para o item de consumo final, onde é adicionado como um conservante, regulador de acidez e reforçador de sabor.[5] Pode ser usado na forma de diacetato de sódio — um complexo 1:1 de acetato de sódio e ácido acético,[6] com o número E E262.
Um frequente uso desta forma é em batatas chips sal e vinagre nos EUA. Muitas marcas estadunidenses, incluindo o fabricante nacional Frito-Lay, dizem batatas chips flavorizadas com "sal e vinagre" quando usam esta substância química, com lactose e menores porcentagens de outras substâncias, em vez de verdadeiros sal e vinagre na preparação.[7]
Outros usos[editar | editar código-fonte]
É também em eletrogalvanização. É usado também na tinturaria, sabões, farmacêutica, na fórmula de diuréticos e expectorantes, e em fotografia.
Na produção de plásticos, acetato de sódio é usado como um retardador de elastômeros. A indústria do petróleo o aplica como um agente tamponador na produção de petróleo, lama de perfuração e fluidos de conclusão de poços.
O acetato de sódio é adicionado na avicultura à água potável para as galinhas para ajudar a evitar doenças associadas com o superaquecimento e desidratação.
Além disso, por ser um processo altamente exotérmico, a cristalização do acetato de sódio encontrou aplicação em compressas quentes, na forma de uma bolsa plástica selada, contendo uma solução supersaturada de acetato de sódio em água e um pequeno disco metálico.
Flexionando-se o disco metálico, dá-se início à cristalização do acetato de sódio, com consequente evolução de calor. Para que o sólido cristalizado se dissolva de novo, basta aquecer a bolsa contendo o acetato de sódio cristalizado em água fervente por aproximadamente 10 minutos.
Preparação[editar | editar código-fonte]

Para uso laboratorial, acetato de sódio é um produto químico barato, e geralmente é comprado em vez de ser sintetizado. É algumas vezes produzido em um experimento de laboratório pela reação de ácido acético com carbonato, bicarbonato ou hidróxido de sódio. Estas reações produzem acetato de sódio aquoso e água. Dióxido de carbono é produzido na reação com carbonato ou bicarbonato de sódio, e deixa o vaso de reação como um gás (a menos que o vaso de reação seja pressurizado). Esta é a conhecida reação "vulcão" das feiras de ciência entre o bicarbonato de sódio e o vinagre.
- CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
A reação com o carbonato de sódio, mais vigorosa, é a seguinte:
- 2 CH3COOH + Na2CO3 → 2 CH3COONa + H2O + CO2
Industrialmente, o acetato de sódio é preparado pelo ácido acético glacial e o hidróxido de sódio.
- CH3COOH + NaOH → CH3COONa + H2O
Reações químicas[editar | editar código-fonte]
Acetato de sódio pode ser usado para formar um éster, como o acetato de etila, com um haleto de alquila tal como o bromoetano:
- NaO2CCH3 + BrCH2CH3 → C2H5O2CCH3 + NaBr
Sais de césio catalisam esta reação.
Questões de segurança[editar | editar código-fonte]
Risco de incêndio[editar | editar código-fonte]
Altamente comburente
Risco de explosão[editar | editar código-fonte]
Baixo. É possível a explosão das partículas finamente dispersas no ar em concentrações suficientes, e na presença de uma fonte de ignição.
Risco de desastre[editar | editar código-fonte]
Baixo. Durante um incêndio gases tóxicos e irritantes podem ser gerados por decomposição térmica ou combustão.
Combate a incêndio[editar | editar código-fonte]
Usar pó químico seco, água pulverizada, gás carbônico ou espuma.
Incompatibilidade[editar | editar código-fonte]
Agentes oxidantes fortes. Misturas explosivas podem ser formadas com flúor ou nitrito de potássio.
Produtos perigosos da decomposição[editar | editar código-fonte]
Monóxido e dióxido de carbono, fumos tóxicos de óxido de sódio.
Reações perigosas[editar | editar código-fonte]
Ocorrem com ácidos fortes. Risco baixo.
Efeitos quando ocorre inalação[editar | editar código-fonte]
Pode causar irritação ao trato respiratório. Os sintomas podem incluir tosse, irritação na garganta, dificuldade respiratória e dor no peito.
Efeitos quando ocorre contato com a pele[editar | editar código-fonte]
Pode causar irritação, vermelhidão e dor.
Efeitos quando ocorre contato com os olhos[editar | editar código-fonte]
Pode causar irritação, vermelhidão e dor.
Efeitos quando ocorre ingestão[editar | editar código-fonte]
Grandes doses podem produzir dores abdominais, náuseas e vômitos.
Procedimentos de primeiros socorros[editar | editar código-fonte]
- inalação: Remover para local arejado e repousar. Se cessar a respiração, aplicar método de reanimação cardiopulmonar.
- contato com os olhos: Lavar imediatamente com muita água por, pelo menos, 15 minutos.
- contato com a pele: Lavar imediatamente com muita água e sabão até que toda a substância seja removida da pele.
- ingestão: Se a vítima estiver consciente, beber de 2 a 4 copos de água ou leite. Chamar auxílio médico.
Procedimento nos casos de derrames - vazamentos[editar | editar código-fonte]
Conter o derrame. Ventilar o local. Recolher as camadas superiores para a embalagem de origem, se não tiver havido contaminação.
Acondicionamento[editar | editar código-fonte]
Frascos de plástico.
Manuseio e armazenamento[editar | editar código-fonte]
Manter em lugar fresco, seco, bem ventilado e separado de ácidos fortes. Dispor em recipientes especiais, fechados e devidamente etiquetados. Evitar contato com olhos, pele e roupas. Lavar-se bem após o manuseio.
Referências
- ↑ a b c d e Registo de CAS RN 127-09-3 na Base de Dados de Substâncias GESTIS do IFA, accessado em 20 de Janeiro de 2008
- ↑ Thompson, J.E. A Practical Guide to Contemporary Pharmacy Practice. 2nd ed. Philadelphia: Lippincott Williams & Wilkins, 2004.
- ↑ Voet, Donald; Voet, Judith G. (1 de janeiro de 2013). Bioquímica - 4ed. [S.l.]: Artmed Editora. ISBN 9788582710050
- ↑ Anderson de Oliveira Ferreira; pH & tampões[ligação inativa]
- ↑ Diário Oficial - Nº161 - Seção 1, quarta-feira, 21 de agosto de 2002; AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA; Diretoria Colegiada RESOLUÇÃO-RDC Nº 234, DE 19 DE AGOSTO DE 2002 Arquivado em 13 de junho de 2010, no Wayback Machine.
- ↑ Sodium Diacetate Arquivado em 12 de outubro de 2010, no Wayback Machine. - www.jungbunzlauer.com (em inglês)
- ↑ «Cópia arquivada». Consultado em 1 de janeiro de 2011. Arquivado do original em 23 de novembro de 2010



![{\displaystyle pH=pKa+\log[CH_{3}COO^{-}]\div [CH_{3}COOH]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/52bb2d2200cbfe171a4024f7c26a49e94b658c5f)