Floroglucinol
| Phloroglucinol Alerta sobre risco à saúde | |
|---|---|

|

|
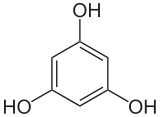
| |
| Nome IUPAC | Benzene-1,3,5-triol |
| Outros nomes | floroglucina, 1,3,5-triidroxibenzeno, 1,3,5-benzenotriol, ou ciclohexano-1,3,5-triona |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| ChEBI | |
| Número RTECS | UX1050000 |
| Código ATC | A03 |
| SMILES |
|
| InChI | 1/C6H6O3/c7-4-1-5(8)3-6(9)2-4/h1-3,7-9H
|
| Propriedades | |
| Fórmula molecular | C6H6O3 |
| Massa molar | 126.11 g/mol |
| Aparência | sólido branco |
| Ponto de fusão |
215–218 °C [1] |
| Solubilidade em água | solúvel (10 g·l-1 a 20 °C)[1] |
| Solubilidade | solúvel em éter dietílico, etanol e piridina [2] |
| Acidez (pKa) | 8,45[3] |
| Riscos associados | |
| Classificação UE | Nocivo (Xn) |
| Frases R | R36/37/38 |
| Frases S | S26, Predefinição:R37/39 |
| LD50 | 4550 mg·kg-1 (camundongo, oral)[1] |
| Compostos relacionados | |
| Outros aniões/ânions | 5-Nitroresorcina (um -OH substituído por -NO2) |
| Fenóis relacionados | Resorcina (1,3-Diidroxibenzeno) Pirogalol (1,2,3-Triidroxibenzeno) Hidroxiquinol (1,2,4-Triidroxibenzeno) 1,2,3,5-Tetraidroxibenzeno Ácido floroglucínico (ácido 2,4,6-triidroxibenzoico) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Floroglucinol é um benzenotriol, também chamado comumente por floroglucina. É um composto orgânico usado na síntese de medicamentos e explosivos. Esta molécula existe em duas formas, ou tautômeros, 1,3,5-triidroxibenzeno, o qual tem comportamento tal qual um fenol, e 1,3,5-cicloexanotriona (daí o nome floroglucina), o qual comporta-se como uma cetona. Estes dois tautômeros estão em equilíbrio. Floroglucinol é um intermediário útil devido a ser polifuncional.
Em água, floroglucinol cristaliza-se como o diidrato, o qual tem um ponto de fusão de 116–117 °C, mas a forma anidra funde-se a temperatura muito mais alta, a 218–220 °C. Isto o faz não ebulir, mas sublimar-se.
Obtenção, síntese e reações[editar | editar código-fonte]
Floroglucinol foi originalmente isolado da casca de árvores frutíferas. É sintetizado via um bom número de processos, dos quais o mais representativo é a seguinte rota a partir do trinitrobenzeno:[4]
A síntese é notável porque derivados de anilina ordinária são não reativos em relação a hidróxido. Devido ao triaminobenzeno também existir com seu tautômero imina, ele é suscetível de sofrer hidrólise.
O composto comporta-se como uma cetona em sua reação com hidroxilamina, formando a tris(oxima). Mas comporta-se como um benzenotriol (Ka1 = 3.56 × 10−9, Ka2 1.32×10−9), de maneira que os três grupos hidroxila podem ser metilados para resultando em 1,3,5-trimetoxibenzeno.[4]
Ocorrência natural[editar | editar código-fonte]
Floroglucinóis ocorrem naturalmente em certas espécies de plantas. Por exemplo, eles (e algumas vezes seus derivados acila) estão presentes nas frondes das samambaias de grande porte costeiras, Dryopteris arguta.[5] Algas pardas também produzem derivados de floroglucinol[6][7] conhecidos como florotaninos.[8]
Metabolismo[editar | editar código-fonte]
A hidrolase da floretina usa floretina e água para produzir floretato e floroglucinol.
Aplicações[editar | editar código-fonte]
Floroglucinol é usado principalmente como um agente de acoplamento em impressão. Ela liga-se a corantes diazo para dar um preto rápido.
É útil para a síntese industrial de medicamentos[9] e explosivos.[10] É também usado para o tratamento de pedras na vesícula, dores espasmódicas e outras desordens gastrointestinais relacionadas.[11][12][13] Possui uma ação espasmolítica não específica sobre os vasos, brônquios, intestino, ureteres e vesícula biliar, e é utilizado para tratar distúrbios destes órgãos.
Floroglucinólise é uma técnica analítica para estudar taninos condensados por meio de despolimerização. A reação faz uso de floroglucinol como um nucleófilo.
Referências
- ↑ a b c Datenblatt Floroglucinol bei Acros, abgerufen am {{{Datum}}}.
- ↑ Thieme Chemistry, ed. (2009). RÖMPP Online - Version 3.5. Stuttgart: Georg Thieme Verlag KG
- ↑ CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Helmut Fiege, Heinz-Werner Voges, Toshikazu Hamamoto, Sumio Umemura, Tadao Iwata, Hisaya Miki, Yasuhiro Fujita, Hans-Josef Buysch, Dorothea Garbe, Wilfried Paulus "Phenol Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Wienheim, 2005. DOI: 10.1002/14356007.a19_313. Published online: 15 June 2002.
- ↑ C. Michael Hogan. 2008. Coastal Woodfern (Dryopteris arguta), GlobalTwitcher, ed. N. Stromberg Arquivado em 11 de julho de 2011, no Wayback Machine.
- ↑ «A New Phloroglucinol Derivative from the Brown Alga Eisenia bicyclis: Potential for the Effective Treatment of Diabetic Complications. Yoshihito Okada, Akiko Ishimaru, Ryuichiro Suzuki and Toru Okuyama, J. Nat. Prod., 2004, 67 (1), pp 103–105, DOI: 10.1021/np030323j»
- ↑ «Phloroglucinol Derivatives from Three Australian Marine Algae of the Genus Zonaria. Adrian J. Blackman, Glen I. Rogers and John K. Volkman, J. Nat. Prod., 1988, 51 (1), pp 158–160, DOI: 10.1021/np50055a027»
- ↑ «Local and chemical distribution of phlorotannins in brown algae. Toshiyuki Shibata, Shigeo Kawaguchi, Yoichiro Hama, Masanori Inagaki, Kuniko Yamaguchi and Takashi Nakamura, Journal of Applied Phycology, Volume 16, Number 4, 291-296, DOI: 10.1023/B:JAPH.0000047781.24993.0a»
- ↑ «Intermediate Pharmaceutical Ingredients - Flopropione» (PDF). Univar Canada. Consultado em 24 de abril de 2009
- ↑ «Synthesis of trinitrophloroglucinol». The United States Patent and Trademark Office. 1984. Consultado em 24 de abril de 2009
- ↑ «PHLOROGLUCINOL». Biam. 1999. Consultado em 24 de abril de 2009 (in French)
- ↑ «Phloroglucinol Summary Report» (PDF). EMEA. Consultado em 24 de abril de 2009. Arquivado do original (PDF) em 10 de julho de 2007
- ↑ Chassany O; et al. (2007). «Acute exacerbation of pain in irritable bowel syndrome: efficacy of phloroglucinol/trimethylphloroglucinol. A randomized, double-blind, placebo-controlled study.». Alimentary pharmacology & therapeutics. 1 (25): 1115–23 PubMed


