Fosfatidiletanolamina
| Fosfatidiletanolamina Alerta sobre risco à saúde | |
|---|---|
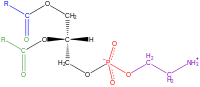
| |
| Identificadores | |
| Número CAS | |
| MeSH | |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A fostatidiletanolamina é um glicofosfolipídeo, que é um derivado do composto precursor ácido fosfatídico, de acordo com o álcool polar no seu grupo-cabeça.
Por exemplo, a fosfatidilcolina e fosfatidiletanolamina tem colina e etanolamina nos seus grupos-cabeça polares. Em todos esses compostos, o grupo-cabeça esta ligado ao glicerol por um fosfodiéster, no qual o grupo fosfato tem uma carga negativa em pH neutro. O álcool polar pode estar negativamente carregado (como no fosfatidillinositol 4,5 bifosfato), neutro (fosfatidilserina) ou positivamente carregado (fosfaticilcolina, fostatidiletanolamina). Essas cargas tem uma contribuição significante nas propriedades de superfície das membranas.
A S-Adenosil metionina pode subsequentemente metilar a amina de fosfatidiletanolaminas para produzir fosfatidilcolinas. Pode encontrar-se principalmente na região interna (citoplasmática) da bicamada lipídica.[1]
Funções[editar | editar código-fonte]
Em células[editar | editar código-fonte]
As fosfatidiletanolaminas são encontradas em todas as células vivas, compondo 25% de todos os fosfolípidos. Na fisiologia humana, eles são encontrados particularmente em tecidos nervosos, como a substância branca do cérebro, nervos, tecido neural e na medula espinhal, onde compõem 45% de todos os fosfolípidos.[2]
As fosfatidiletanolaminas desempenham um papel na fusão da membrana e na desmontagem do anel contrátil durante a citocinese na divisão celular.[3] Além disso, pensa-se que a fosfatidiletanolamina regula a curvatura da membrana. A fosfatidiletanolamina é um importante precursor, substrato ou doador em várias vias biológicas.[2]
Como um grupo de cabeça polar, a fosfatidiletanolamina cria uma membrana lipídica mais viscosa em comparação com a fosfatidilcolina. Por exemplo, a temperatura de fusão da di-oleoil-fosfatidiletanolamina é de -16 °C enquanto a temperatura de fusão da di-oleoil-fosfatidilcolina é de -20 °C. Se os lípidos tivessem duas cadeias de palmitoil, a fosfatidiletanolamina fundiria a 63 °C, enquanto a fosfatidilcolina derreteria já a 41 °C.[4] As temperaturas de fusão inferior correspondem, em uma visão simplista, a membranas mais fluidas.
Em humanos[editar | editar código-fonte]
Em seres humanos, o metabolismo da fosfatidiletanolamina é considerado importante no coração, pois quando o fluxo de sangue para o coração é restrito, a distribuição assimétrica da fosfatidiletanolamina entre os folhetos da membrana é interrompida e, como resultado, a membrana é interrompida. Além disso, a fosfatidiletanolamina desempenha um papel na secreção de lipoproteínas no fígado. Isso ocorre porque as vesículas para a secreção de lipoproteínas de baixa densidade que surgem do Golgi possuem uma concentração de fosfatidiletanolamina significativamente maior quando comparada a outras vesículas contendo lipoproteínas de baixa densidade.[5]
A fosfatidiletanolamina também mostrou poder propagar priões infecciosos sem a ajuda de proteínas ou ácidos nucleicos, o que é uma característica única dela[6]. É também pensado que a fosfatidiletanolamina desempenha um papel na coagulação do sangue, pois funciona com fosfatidilserina no aumento da taxa de formação de trombina promovendo a ligação ao fator V e ao fator X, duas proteínas que catalisam a formação da trombina a partir da protrombina.[7]
Em bactérias[editar | editar código-fonte]
Onde a fosfatidilcolina é o principal fosfolípido em animais, a fosfatidiletanolamina é a principal em bactérias. Um dos principais papéis da fosfatidiletanolamina nas membranas bacterianas é espalhar a carga negativa causada por fosfolípidos de membrana aniônica. Na bactéria Escherichia coli, a fosfatidiletanolamina desempenha um papel no apoio à permeases da lactose, ao transporte ativo de lactose na célula e também pode desempenhar um papel em outros sistemas de transporte. A fosfatidiletanolamina desempenha um papel na montagem da permease da lactose e outras proteínas de membrana. Ele atua como um "acompanhante" para ajudar as proteínas da membrana a dobrar corretamente suas estruturas terciárias para que possam funcionar corretamente. Quando a fosfatidiletanolamina não está presente, as proteínas de transporte têm estruturas terciárias incorretas e não funcionam corretamente.[8]
A fosfatidiletanolamina também permite que os transportadores multidrogas bacterianos funcionem adequadamente, e permite a formação de intermediários que são necessários para que os transportadores abram e fechem corretamente.[9]
Estrutura[editar | editar código-fonte]
Por ser uma lecitina, (uma mistura de glicolípidios, triglicerídios e fosfolipídios), a fostatidiletanolamina consiste em uma combinação de glicerol esterificado com dois ácidos graxos e ácido fosfórico.
Considerando que o grupo fosfato é combinado com colina em fosfatidilcolina, e combinado com a etanolamina em fosfatidiletanolamina. Os dois ácidos gordurosos podem ser iguais ou diferentes, e geralmente estão nas 1,2 posições (embora possam estar nas 1,3 posições).
Sínteses[editar | editar código-fonte]
A via de descarboxilação de fosfatidilserina e as vias de difenossulfato-etanolamina de citidina são utilizadas para sintetizar a fosfatidiletanolamina.
A fosfatidilserina descarboxilase é a enzima que é usada para descarboxilação de fosfatidilserina no primeiro caminho.
A via de descarboxilação de fosfatidilserina é a principal fonte de síntese para fosfatidiletanolamina nas membranas das mitocôndrias. A fosfatidiletanolamina produzida na membrana mitocondrial também é transportada por toda a célula para outras membranas para uso.
Em um processo que reflete a síntese de fosfatidilcolina, a fosfatidiletanolamina também é feita através da via de difenossulfato-etanolamina citidina, utilizando-se a etanolamina como substrato. Através de várias etapas que ocorrem tanto no citosol quanto no retículo endoplasmático, o caminho de síntese produz o produto final da fosfatidiletanolamina.[10] A fosfatidiletanolamina também é encontrada abundantemente em lecitina de soja ou ovo e é produzida comercialmente usando separação cromatográfica.
Regulação[editar | editar código-fonte]
A síntese de fosfatidiletanolamina através da via de descarboxilação de fosfatidilserina ocorre rapidamente na membrana mitocondrial interna. No entanto, a fosfatidilserina é feita no retículo endoplasmático. Por isso, ocorre o transporte de fosfatidilserina do retículo endoplasmático para a membrana mitocondrial e, em seguida, para a membrana mitocondrial interna, que limita a taxa de síntese através desta via. O mecanismo para este transporte é atualmente desconhecido, mas pode desempenhar um papel na regulação da taxa de síntese nesta via.
Presença em alimentos, problemas de saúde[editar | editar código-fonte]
As fosfatidiletanolaminas em alimentos se fragmentam para formar ‘produtos Amadori’ ligados à fosfatidiletanolamina como parte da reação de Maillard.[11]
Esses produtos aceleram a peroxidação lipídica das membranas, causando estresse oxidativo para as células que entram em contato com elas.[12] O estresse oxidativo é conhecido por causar deterioração de alimentos e várias doenças. Foram encontrados níveis significativos de produtos de Amadori-fosfatidiletanolamina em uma grande variedade de alimentos, como chocolate, leite de soja, fórmula infantil e outros alimentos processados. Os níveis de produtos Amadori-fosfatidiletanolamina são maiores em alimentos com altas concentrações de lipídios e açúcares que apresentam altas temperaturas no processamento.[11] Estudos adicionais descobriram que Amadori-fosfatidiletanolamina pode desempenhar um papel na doença vascular,[13] atuam como o mecanismo pelo qual o diabetes pode aumentar a incidência de câncer [14] e também pode desempenhar um papel importante em outras doenças. A amadori-fosfatidiletanolamina tem uma maior concentração plasmática em pacientes com diabetes do que pessoas saudáveis, indicando que pode desempenhar um papel no desenvolvimento da doença ou ser um produto da doença.[15]
- ↑ Wellner, Niels; Diep, Thi Ai; Janfelt, Christian; Hansen, Harald Severin (março 2013). «N-acylation of phosphatidylethanolamine and its biological functions in mammals». Biochimica Et Biophysica Acta. 1831 (3): 652–662. ISSN 0006-3002. PMID 23000428. doi:10.1016/j.bbalip.2012.08.019
- ↑ a b Vance, Jean E.; Tasseva, Guergana (março 2013). «Formation and function of phosphatidylserine and phosphatidylethanolamine in mammalian cells». Biochimica Et Biophysica Acta. 1831 (3): 543–554. ISSN 0006-3002. PMID 22960354. doi:10.1016/j.bbalip.2012.08.016
- ↑ Emoto, K.; Kobayashi, T.; Yamaji, A.; Aizawa, H.; Yahara, I.; Inoue, K.; Umeda, M. (12 de novembro de 1996). «Redistribution of phosphatidylethanolamine at the cleavage furrow of dividing cells during cytokinesis». Proceedings of the National Academy of Sciences of the United States of America. 93 (23): 12867–12872. ISSN 0027-8424. PMID 8917511
- ↑ Veja referências em Wan et al. Biochemistry 47 2008
- ↑ Vance, Jean E. (julho 2008). «Phosphatidylserine and phosphatidylethanolamine in mammalian cells: two metabolically related aminophospholipids». Journal of Lipid Research. 49 (7): 1377–1387. ISSN 0022-2275. PMID 18204094. doi:10.1194/jlr.R700020-JLR200
- ↑ Deleault, Nathan R.; Piro, Justin R.; Walsh, Daniel J.; Wang, Fei; Ma, Jiyan; Geoghegan, James C.; Supattapone, Surachai (29 de maio de 2012). «Isolation of phosphatidylethanolamine as a solitary cofactor for prion formation in the absence of nucleic acids». Proceedings of the National Academy of Sciences of the United States of America. 109 (22): 8546–8551. ISSN 1091-6490. PMID 22586108. doi:10.1073/pnas.1204498109
- ↑ Majumder, Rinku; Liang, Xiaoe; Quinn-Allen, Mary Ann; Kane, William H.; Lentz, Barry R. (14 de outubro de 2011). «Modulation of prothrombinase assembly and activity by phosphatidylethanolamine». The Journal of Biological Chemistry. 286 (41): 35535–35542. ISSN 1083-351X. PMID 21859710. doi:10.1074/jbc.M111.260141
- ↑ Christie, W.W. (April 16, 2012). "Phosphatidylethanolamine and Related Lipids". The AOCS Lipid Library. Retrieved September 3, 2012. «Título ainda não informado (favor adicionar)»
- ↑ Gbaguidi, B.; Hakizimana, P.; Vandenbussche, G.; Ruysschaert, J.-M. (junho 2007). «Conformational changes in a bacterial multidrug transporter are phosphatidylethanolamine-dependent». Cellular and molecular life sciences: CMLS. 64 (12): 1571–1582. ISSN 1420-682X. PMID 17530171. doi:10.1007/s00018-007-7031-0
- ↑ Kelly, Karen (July 28, 2011). "Phospholipid Biosynthesis". The AOCS Lipid Library. Retrieved September 3, 2012. «Título ainda não informado (favor adicionar)»
- ↑ a b Oak, Jeong-Ho; Nakagawa, Kiyotaka; Miyazawa, Teruo (março 2002). «UV analysis of Amadori-glycated phosphatidylethanolamine in foods and biological samples». Journal of Lipid Research. 43 (3): 523–529. ISSN 0022-2275. PMID 11893788
- ↑ Oak, J.; Nakagawa, K.; Miyazawa, T. (8 de setembro de 2000). «Synthetically prepared Aamadori-glycated phosphatidylethanolaminecan trigger lipid peroxidation via free radical reactions». FEBS letters. 481 (1): 26–30. ISSN 0014-5793. PMID 10984609
- ↑ Oak, Jeong-Ho; Nakagawa, Kiyotaka; Oikawa, Shinichi; Miyazawa, Teruo (4 de dezembro de 2003). «Amadori-glycated phosphatidylethanolamine induces angiogenic differentiations in cultured human umbilical vein endothelial cells». FEBS letters. 555 (2): 419–423. ISSN 0014-5793. PMID 14644453
- ↑ Eitsuka, Takahiro; Nakagawa, Kiyotaka; Ono, Yuichi; Tatewaki, Naoto; Nishida, Hiroshi; Kurata, Tadao; Shoji, Naoki; Miyazawa, Teruo (30 de julho de 2012). «Amadori-glycated phosphatidylethanolamine up-regulates telomerase activity in PANC-1 human pancreatic carcinoma cells». FEBS letters. 586 (16): 2542–2547. ISSN 1873-3468. PMID 22750441. doi:10.1016/j.febslet.2012.06.027
- ↑ Ariizumi, Ken; Koike, Tomoyuki; Ohara, Shuichi; Inomata, Yoshifumi; Abe, Yasuhiko; Iijima, Katsunori; Imatani, Akira; Oka, Yoshitomo; Shimosegawa, Tooru (28 de maio de 2008). «Incidence of reflux esophagitis and Helicobacter pylori infection in diabetic patients». World Journal of Gastroenterology : WJG. 14 (20): 3212–3217. ISSN 1007-9327. PMID 18506928. doi:10.3748/wjg.14.3212
