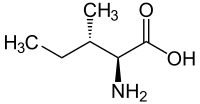
Isoleucina
| L-Isoleucine Alerta sobre risco à saúde | |
|---|---|
|

|
| Nome IUPAC | (2S,3S)-2-amino-3-methylpentanoic acid |
| Identificadores | |
| Número CAS | ,(L-isoleucina) 319-78-8 (D-isoleucina) 1509-34-8 (L-allo-isoleucina) 1509-35-9 (D-allo-isoleucina) |
| PubChem | |
| DrugBank | NUTR00031 |
| Código ATC | V06 |
| Propriedades | |
| Fórmula química | C6H13NO2 |
| Massa molar | 131.16 g mol-1 |
| Ponto de fusão |
284 °C (L-isoleucina, decompõe-se) |
| Solubilidade em água | solúvel: 40 g·l (20 °C, L-isoleucina) |
| Acidez (pKa) | pKCOOH: 2,32 (25 °C, L-isoleucina) pKNH: 9,76 (25 °C, L-isoleucina) |
| Compostos relacionados | |
| Alfa-aminoácidos relacionados | Valina (ácido 2-amino-3-metil butanoico) Norvalina (ácido 2-amino-pentanoico) Norleucina (isômero linear) Leucina (isômero, ácido 2-amino-4-metil-pentanoico) Terc-leucina (isômero, ácido 2-amino-3,3-dimetil-butanoico) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Isoleucina, também chamada de L-isoleucina ou ácido (2S,3S)-2-Amino-3-metilpentanóico, é um aminoácido essencial de fórmula C6H13NO2 e peso molecular 131,175 g/mol, que possui cadeia lateral alifática e apolar [1] [2]. É um isômero da leucina, importante na síntese da hemoglobina e na regulação dos níveis sanguíneos de glicose [3]. A ocorrência média da isoleucina em proteínas é de 6% [4].
Estrutura[editar | editar código-fonte]
A isoleucina possui sua cadeia de carbonos ramificada e faz parte do grupo de aminoácidos BCAA (do inglês: Branched-Chain AminoAcids) junto ao seu isômero leucina e à valina [3]. O pK do seu grupo carboxila é de 2,32 e do grupo amina, 9,76.Uma vez que a cadeia lateral da isoleucina não possui carga, seu ponto isoelétrico (o pH no qual a molécula não apresenta carga líquida) é a média aritmética de seus dois pKs: 6,04 [4] [5].


Funções[editar | editar código-fonte]
Os aminoácidos de cadeia ramificada (BCAA) são associados a efeitos positivos no peso corporal, síntese de proteínas musculares, diminuição da degradação muscular e homeostase da glicose [6] . Além disso, a suplementação com BCAAs parece melhorar o quadro de doenças hepáticas em modelos murinos de dano hepático [7] e em pacientes com cirrose [8]. Já foi sugerido inclusive que a leucina, isômero da isoleucina, tem efeitos diretos na regulação hipotalâmica da saciedade, induzindo aumento da expressão de neuropeptídeos anorexigênicos e diminuição da expressão de orexigênicos [9]. Os BCAAs também sinalizam perifericamente regulando a secreção de hormônios diretamente ligados à modulação da saciedade e do balanço energético, como a leptina, GLP-1 e grelina. Contudo, a suplementação com BCAAs deve ser feita de forma controlada e cautelosa, uma vez que níveis elevados de BCAAs estão presentes em condições como diabetes tipo 2 associada à obesidade e ainda não está claro se induzem esta condição ou se são apenas biomarcadores presentes como consequência das alterações metabólicas [6].
Degradação[editar | editar código-fonte]
O primeiro passo na degradação de aminoácidos é a remoção do grupo amino pela transaminação, uma reação comum à maioria dos aminoácidos. A transaminação é caracterizada pela transferência do grupo amino – através da ação das aminotransferases ou transaminases – para o α-cetoglutarato, formando glutamato e o α-cetoácido correspondente. Estas enzimas também podem utilizar o oxaloacetato como aceptor do grupo amino, convertendo-o a aspartato, porém com afinidade menor em relação ao α-cetoglutarato [10].
A transaminase de aminoácidos ramificados catalisa a transaminação dos BCAAs (valina, leucina e isoleucina). No caso da isoleucina, o α-cetoácido resultante dessa reação é o α-ceto-β-metilvalerato, que depois de outras cinco reações é convertido a succinil-CoA ou acetil-CoA, intermediários do ciclo de Krebs (ou ciclo do ácido cítrico), utilizados para a produção de ATP. O grupo amino removido do aminoácido é transferido então para o α-cetoglutarato, formando glutamato. O glutamato pode seguir duas vias e degradação, comuns à maioria dos aminoácidos: uma nova transaminação ou uma desaminação. A transaminação do glutamato é feita com o oxaloacetato, retornando a α-cetoglutarato e gerando aspartato (pela transferência do grupo amino para o oxaloacetato através da enzima aspartato transaminase ou transaminase glutâmico-oxaloacética). O glutamato também pode ser desaminado pela enzima mitocondrial glutamato desidrogenase, encontrada principalmente no fígado gerando NH3 (amônia), convertida a NH4+ (íon amônico) no pH fisiológico. Esta enzima é específica para o glutamato, e não se tem conhecimento de nenhuma enzima com ações similares para outros aminoácidos. Portanto, para que o grupo amino dos aminoácidos seja eliminado em forma de amônia é imprescindível que passem pelo glutamato. O aspartato e o íon amônico gerados pela degradação do glutamato entram então no ciclo da ureia. Essa conversão de NH4+ em ureia é fundamental para manter as concentrações deste íon baixas no organismo, uma vez que é extremamente tóxico [10].

Doenças metabólicas[editar | editar código-fonte]
A degradação da isoleucina é afetada nas seguintes doenças metabólicas:
Referências[editar | editar código-fonte]
- ↑ Registo de L-Isoleucin na Base de Dados de Substâncias GESTIS do IFA
- ↑ Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, Hirzel Verlag, Stuttgart, 1991, ISBN 3-7776-0485-2, S. 823
- ↑ a b PubChem. Open Chemistry Database. Link: https://pubchem.ncbi.nlm.nih.gov/compound/l-isoleucine#section=Top
- ↑ a b Voet, D., Voet, J.G. Bioquímica. 4º Edição. Porto Alegre: Artmed, 2013. 1482p.
- ↑ Lehninger Principles of Biochemistry (4th Ed.) Nelson, D., and Cox, M.; W.H. Freeman and Company, New York, 2005, ISBN 0-7167-4339-6
- ↑ a b Lynck C, Adams S. Branched-chain amino acids in metabolic signalling and insulin resistance. Nat Rev Endocrinol. 2014 December; 10(12): 723–736. doi:10.1038/nrendo.2014.171.
- ↑ Ichikawa K, et al. Branched-chain amino acid-enriched nutrients stimulate antioxidant DNA repair in a rat model of liver injury induced by carbon tetrachloride. Mol Biol Rep. 2012; 39:10803–10810.
- ↑ Hayaishi S, et al. Oral branched-chain amino acid granules reduce the incidence of hepatocellular carcinoma and improve event-free survival in patients with liver cirrhosis. Dig Dis. 2011; 29:326–332.
- ↑ Lopez N, Sanchez J, Pico C, Palou A, Serra F. Dietary L-leucine supplementation of lactating rats results in a tendency to increase lean/fat ratio associated to lower orexigenic neuropeptide expression in hypothalamus. Peptides. 2010; 31:1361–1367.
- ↑ a b Marzzoco, A., Torres, B. B. Bioquímica básica. 3.ed. - Rio de Janeiro : Guanabara Koogan 2007. ISBN 978-85-277-1284-2
