Leucemia linfoblástica aguda
| Leucemia linfoblástica aguda | |
|---|---|
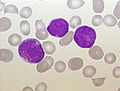
| Amostra de medula óssea de uma pessoa com células precursoras B. As células maiores roxas são linfoblastos. | |
| Sinónimos | Leucemia linfoide aguda, leucemia linfocítica aguda |
| Especialidade | Hematologia, oncologia |
| Sintomas | Cansaço, palidez, febre, facilidade em ferir-se e contrair nódoas negras, dor óssea, aumento de volume dos gânglios linfáticos[1] |
| Complicações | Infeção, síndrome da lise tumoral[2][3] |
| Início habitual | 2–5 anos de idade[4] |
| Tipos | LLA de percursores B, LLA de percursores T[2] |
| Causas | Geralmente desconhecidas[5] |
| Fatores de risco | Gémeos verdadeiros com LLA, síndrome de Down, anemia de Fanconi, ataxia telangiectasia, síndrome de Klinefelter, elevado peso à nascença, exposição significativa à radiação[6][5][1] |
| Método de diagnóstico | Análises ao sangue e análise da medula óssea[3] |
| Condições semelhantes | Mononucleose infecciosa, leucemia mieloide aguda, linfoma linfoblástico, anemia aplástica[3] |
| Tratamento | Quimioterapia, transplante de medula óssea, radioterapia, terapia dirigida[1] |
| Prognóstico | Crianças: taxa de sobrevivência a cinco anos de 90%[2] Adultos: taxa de sobrevivência a cinco anos de 35%[7] |
| Frequência | 1 em 1750 crianças[4][8] |
| Mortes | 111 000 (2015)[9] |
| Classificação e recursos externos | |
| CID-10 | C91.0 |
| CID-9 | 204.0 |
| CID-ICD-O | M9835/3 |
| CID-11 | 1241029957 |
| OMIM | 247640, 613065 |
| DiseasesDB | 195 |
| MedlinePlus | 000541 |
| eMedicine | med/3146 ped/2587 |
| MeSH | D054198 |
Leucemia linfoblástica aguda (LLA) é um cancro da linha linfoide das células sanguíneas caracterizado pelo desenvolvimento de elevado número de linfócitos imaturos (linfoblastos).[1] Os sintomas mais comuns são cansaço, palidez, febre, facilidade em ferir-se e contrair nódoas negras, aumento de volume dos gânglios linfáticos e dor óssea.[1] Tal como todas as leucemias agudas, a LLA evolui de forma agressiva e é mortal no prazo de semanas ou meses se não for tratada.[10]
Na maior parte dos casos a causa é desconhecida.[2] Entre os fatores de risco genéticos estão a síndrome de Down, síndrome de Li-Fraumeni ou neurofibromatose tipo I.[1] Entre os fatores de risco ambientais estão exposição significativa à radiação ou antecedentes de quimioterapia.[1] As evidências de que a exposição a campos eletromagnéticos ou pesticidas seja um fator de risco não são claras.[4][6] Alguns cientistas defendem a hipótese de que a LLA possa ser desencadeada por uma resposta imunitária anormal a uma infeção comum.[4] O mecanismo subjacente envolve diversas mutações genéticas que causam uma acelerada divisão celular.[2] A quantidade excessiva de linfócitos imaturos na medula óssea interfere com a produção de novos glóbulos vermelhos, glóbulos brancos e plaquetas.[1] O diagnóstico geralmente tem por base análises ao sangue e uma análise da medula óssea.[3]
O tratamento inicial de LLA consiste em quimioterapia com o objetivo de remitir a doença.[2] Ao tratamento inicial seguem-se novas sessões de quimioterapia, geralmente ao longo de vários anos.[2] Nos casos em que a doença se tenha disseminado para o cérebro pode ser necessária quimioterapia intratecal ou radioterapia.[2] Nos casos de doença recorrente após o tratamento padrão, pode ser necessário um transplante de medula óssea.[2] Estão atualmente a ser estudadas novas formas de tratamento, como a imunoterapia.[2]
Em 2015, a LLA afetava cerca de 876 000 pessoas em todo o mundo e foi a causa de 111 000 mortes.[11][9] A doença é mais comum em crianças, sobretudo entre os dois e cinco anos de idade.[12][4] Nos Estados Unidos, é a causa mais comum de cancro e morte por cancro entre crianças.[2] A LLA foi o primeiro cancro disseminado a conseguir ser curado.[13] A taxa de sobrevivência entre crianças aumentou de menos de 10% na década de 1960 para mais de 90% em 2015.[2] No entanto, a taxa de sobrevivência é menor em bebés (50%)[14] e em adultos (35%).[7]
Sinais e sintomas[editar | editar código-fonte]
Sintomas iniciais não são específicos. Os sinais e sintomas da LLA são resultantes de uma produção anormal das células sanguíneas (leucócitos). Tais células tornam-se muito numerosas, porém imaturas e malignas. Os sinais são variados. Podem aparecer os seguintes sintomas:
- Fadiga e fraqueza generalizada decorrentes de anemia
- Febre e/ou outros sintomas de infecções
- Perda de peso e/ou perda de apetite
- Sangramentos
- Dores ósseas e nas juntas
- Aumento dos linfonodos (linfonodomegalias)
- Aumento do baço e/ou fígado (esplenomegalia e/ou hepatomegalia)
Classificação[editar | editar código-fonte]
- Estabelecida na década de 1970,[15] a classificação FAB (French American British) baseia-se exclusivamente na análise morfológica e citoquímica das células malignas. Compreende os subtipos:
- L1: presença predominante de linfoblastos pequenos com núcleo regular e cromatina homogênea. Representa de 25-30% dos casos.
- L2: presença predominante de linfoblastos de tamanho médio à grande com núcleo irregular e cromatina heterogênea. Representa aproximadamente 70% dos casos, sendo a mais comum dos três tipos.
- L3: presença de linfoblastos de tamanho médio a grande com característico citoplasma hiperbasofílico e presença de múltiplos vacúolos. Representa aproximadamente 1-3% dos casos.
- A classificação EGIL (European Group for the Immunological Characterization of Leukemias) baseia-se nos imunofenótipos celulares e permite a diferenciação em subtipos imunológicos.[16] Através desta é possível classificar a linhagem celular (B ou T) e caracterizar o estágio maturativo da mesma.
- A classificação OMS (Organização Mundial de Saúde), baseando-se em dados de imunofenótipo, cariótipo e biologia molecular, permite a classificação de acordo com a linhagem B ou T.[17] A OMS classifica a LLA como leucemia de células B precursoras, leucemia de células T precursoras ou neoplasia de células B maduras, subtipo Linfoma/Leucemia de Burkitt.
Etiologia[editar | editar código-fonte]
As causas precisas do desenvolvimento desta patologia são desconhecidas. Apenas uma pequena porcentagem dos casos (<5%) está associada com a presença de alguma síndrome genética (Síndrome de Down, Síndrome de Bloom, ataxia-teleangectasia, Síndrome de Nijmegen), com exposição à radiação ionizante ou drogas quimioterápicas.[18]
Diagnóstico[editar | editar código-fonte]
- Exame físico
- Exames laboratoriais:
- Hemograma: a maioria dos pacientes com LLA apresentam linfoblastos no sangue periférico. A anemia e a trombocitopenia podem ser de graus variados. Hiperleucocitose é vista em 10-16% dos casos (leucócitos >100.000/microlitro). Linfoblastos são vistos em 90% dos casos.
- Punção da Medula óssea (Mielograma) : Via de regra é realizada análise da medula óssea, mesmo na presença de linfoblastos no sangue periférico.
- Imunofenotipagem: para diferenciar se o linfoblasto tem origem células B ou célula T.
- Cariótipo: para detecção de alterações cromossômicas.
Tratamento[editar | editar código-fonte]
É realizado com poliquimioterapia (múltiplas drogas quimioterápicas) e radioterapia, com objetivo de eliminar as células malignas.
O uso de drogas anticâncer são combinadas ao longo de anos de tratamento. Agentes utilizados para ALL incluem: [19]
- Vincristina (Oncovin)
- Esteroides (prednisona, dexametasona)
- L-asparaginace (Elspar) ou PEG-L-asapraginase (Oncaspar)
- Teniposido (Vumon)
- Citarabina (Cytosar)
- Daunorrubicina (Cerubidine) ou doxorrubicina (adriamicina)
- Etoposide (VP-16)
- 6-mercaptopurina (6-MP, Purinethol)
- Metotrexato
- Ciclofosfamida (Cytoxan)
À exceção dos pacientes que apresentam LLA de células B maduras, os quais são tratados com ciclos curtos e intensivos, o tratamento normalmente consiste de uma fase de indução da remissão, fase de consolidação (ou intensificação) e fase de manutenção.
Em alguns casos pode ser necessário o transplante de medula óssea.
Tratamento com Imunoterapia[editar | editar código-fonte]
A primeira terapia com CAR-T usa Tisagenlecleucel e também foi a primeira terapia gênica a receber a aprovação do FDA americano (Food and Drug Administration) em 2017, indicada para pacientes pediátricos e adultos jovens com leucemia linfoblástica aguda recidivante ou refratária (r / r), "seguida de aprovação em maio de 2018 para uma segunda indicação em pacientes adultos com linfoma difuso de grandes células B r / r. Seguida de aprovações na União Europeia, Suíça e Canadá" [20].
Galeria[editar | editar código-fonte]
-
Sangue periférico de uma criança com leucemia linfoide aguda, coloração Pappenheim, magnificação x100
-
Amostra da medula óssea (grande magnificação) de um paciente com leucemia linfoide aguda
-
Amostra da medula óssea de um paciente com leucemia linfoide aguda
Referências
- ↑ a b c d e f g h «Childhood Acute Lymphoblastic Leukemia Treatment». National Cancer Institute (em inglês). 8 de dezembro de 2017. Consultado em 20 de dezembro de 2017
- ↑ a b c d e f g h i j k l Hunger, Stephen P.; Mullighan, Charles G. (14 de outubro de 2015). «Acute Lymphoblastic Leukemia in Children». New England Journal of Medicine (em inglês). 373 (16): 1541–1552. PMID 26465987. doi:10.1056/nejmra1400972
- ↑ a b c d Ferri, Fred F. (2017). Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1 (em inglês). [S.l.]: Elsevier Health Sciences. p. 743. ISBN 9780323529570
- ↑ a b c d e Inaba H, Greaves M, Mullighan CG (junho de 2013). «Acute lymphoblastic leukaemia.». Lancet. 381 (9881): 1943–55. PMC 3816716
 . PMID 23523389. doi:10.1016/S0140-6736(12)62187-4
. PMID 23523389. doi:10.1016/S0140-6736(12)62187-4
- ↑ a b Baljevic, Muhamed; Jabbour, Elias; O'Brien, Susan; Kantarjian, Hagop M (2016). «Acute Lymphoblastic Leukemia». In: Kantarjian, HM; Wolff, RA. The MD Anderson Manual of Medical Oncology 3 ed. New York: McGraw-Hill Education. Consultado em 22 de novembro de 2017
- ↑ a b Childhood acute lymphoblastic leukemia. Vora, Ajay (editor). Cham, Switzerland: Springer International Publishing. 2017. pp. 1–44, 61–86. ISBN 9783319397078. OCLC 984342596
- ↑ a b Paul, Shilpa; Kantarjian, Hagop; Jabbour, Elias J. «Adult Acute Lymphoblastic Leukemia». Mayo Clinic Proceedings. 91 (11): 1645–1666. doi:10.1016/j.mayocp.2016.09.010
- ↑ Boer, JM; den Boer, ML (11 de julho de 2017). «BCR-ABL1-like acute lymphoblastic leukaemia: From bench to bedside.». European Journal of Cancer. 82: 203–218. PMID 28709134. doi:10.1016/j.ejca.2017.06.012
- ↑ a b GBD 2015 Mortality and Causes of Death, Collaborators. (8 de outubro de 2016). «Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1459–1544. PMID 27733281
- ↑ Marino, Bradley S.; Fine, Katie S. (2013). Blueprints Pediatrics (em inglês). [S.l.]: Lippincott Williams & Wilkins. p. 205. ISBN 9781451116045
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 de outubro de 2016). «Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015.». Lancet. 388 (10053): 1545–1602. PMID 27733282
- ↑ «Acute Lymphocytic Leukemia - Cancer Stat Facts». SEER (em inglês). Consultado em 20 de dezembro de 2017
- ↑ Tubergen, DG; Bleyer, A; Ritchey, AK (2011). «Acute Lymphoblastic Leukemia». In: Kliegman, RM; Stanton, BMD; St Geme, J; Schor, NF; Behrman, RE (eds). Nelson Textbook of Pediatrics 19th ed. Philadelphia, PA: Elsevier/Saunders. pp. 1732–1737. ISBN 1437707556. OCLC 706780860
- ↑ Brown, Patrick (6 de dezembro de 2013). «Treatment of infant leukemias: challenge and promise». ASH Education Program Book (em inglês). 2013 (1): 596–600. ISSN 1520-4391. PMID 24319237. doi:10.1182/asheducation-2013.1.596
- ↑ Bennett JM, Catovsky D, Daniel M, et al. 1976, Proposals for the classification of the acute leukaemias Br J Haematol 33:451
- ↑ Bene MC, Castoldi G, Knapp W, et al. 1995 Proposals for the immunological classification of acute leukemias Leukemia 9:1783-1786
- ↑ Jaffe ES, Harris NL, Stein H, Vardiman JW. 2001 Pathology & Genetics Tumours of haematopoietic and lymphoid tissues. World Health Organization Classification of Tumours
- ↑ Pui CH, Robison LL, Look AT. 2008, Acute lymphoblastic leukaemia Lancet 371:1030-1043
- ↑ Leucemia Linfoide Aguda - Causas, Sintomas e Tratamento in Índice de Saúde, 24 de Junho de 2013
- ↑ Ittershagen, Stacie; Ericson, Solveig; Eldjerou, Lamis; Shojaee, Ali; Bleickardt, Eric; Patel, Manisha; Taran, Tetiana; Anak, Oezlem; Hall, Charlene (1 de fevereiro de 2019). «Industry's Giant Leap Into Cellular Therapy: Catalyzing Chimeric Antigen Receptor T Cell (CAR-T) Immunotherapy». Current Hematologic Malignancy Reports (em inglês). 14 (1): 47–55. ISSN 1558-822X. doi:10.1007/s11899-019-0498-6