Período (química)
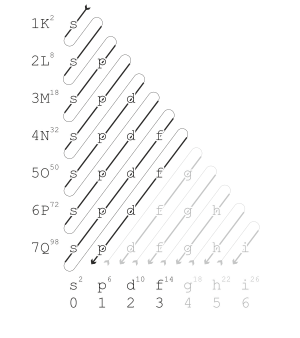
Período ou série é cada uma das 7 linhas da tabela periódica, e indica o número de níveis ocupados pelos elétrons. Por exemplo: o Gálio está localizado no 4° período, ou seja, ele possui 4 níveis eletrônicos. Na tabela periódica, o gálio contém seguinte distribuição eletrônica: 2 - 8 - 18 - 3. Ou seja, no primeiro nível, há 2 elétrons, no segundo 8, e assim por diante. Com exceção do primeiro período, todos os demais começam com um metal alcalino e terminam com um gás nobre.
Os níveis de energia, são nomeados pelas letras de K até Q, sendo K o 1º, e Q o 7° (último).
Cada nível pode suportar um número máximo de elétrons:[1]
K = 2; L = 8; M = 18; N = 32; O = 32; P = 18; Q = 8
O primeiro período da tabela periódica contém 2 elementos químicos, o segundo e o terceiro contém 8, o quarto e o quinto contém 18, e o sexto e o sétimo contém 32.
Os elementos do primeiro período correspondem a 98% da massa de todo o Universo, com o hidrogênio correspondendo a 75% e o hélio a 23%.[2]
Propriedades dos elementos segundo o seu período[editar | editar código-fonte]
Aumenta da direita para a esquerda, pois conforme o número atômico diminui, também diminui a atração do núcleo pelos elétrons do último nível, aumentando o raio.
Aumenta da esquerda para a direita, pois quanto menor o raio do átomo, maior será a atração do núcleo pelos elétrons do nível de energia mais externo, e portanto maior a sua tendência de atrair elétrons. Não é considerada a família dos gases nobres na sequência de eletronegatividade.
Aumenta da direita para a esquerda, pois quanto maior o raio atômico, menor será a atração do núcleo pelos elétrons do nível mais externo, e mais facilmente o átomo perderá elétrons, tendo portanto maior eletropositividade.
Aumenta da esquerda para a direita, pois quanto menor o raio, maior é a força que o núcleo faz sobre os elétrons, e logo maior é a energia necessária na captura de um elétron. Não é considerado os gases nobres nesta propriedade.
Aumenta da esquerda para a direita, pois quanto menor o raio, maior é a energia para retirar um elétron do seu último nível, uma vez que a atração entre o núcleo e o elétron é maior por estarem mais próximos. Ao contrário da afinidade eletrônica, a energia de ionização mede a energia necessária para retirar um elétron de um átomo neutro.[3]
No mesmo período, PE e PF dos elementos aumentam das extremidades para o centro da tabela.[4]
A densidade também aumenta das extremidades para o centro.[5]
Referências
- ↑ de Lana, Carlos Roberto (15 de fevereiro de 2006). «Distribuição Eletrônica: Linus Pauling e as camadas eletrônicas do átomo». UOL. Consultado em 30 de julho de 2017
- ↑ Fogaça, Jennifer Rocha Vargas. «Elemento mais abundante no Universo». UOL. Consultado em 30 de julho de 2017
- ↑ «Propriedades Periódicas». tabelaperiodicacompleta.com. Consultado em 30 de julho de 2017
- ↑ da Silva, André Luis Silva. «Pontos de Fusão e Ebulição». Info Escola. Consultado em 30 de julho de 2017
- ↑ Fogaça, Jennifer Rocha Vargas. «Densidade – propriedade periódica dos elementos». UOL. Consultado em 30 de julho de 2017
