Reação de substituição
A reação de substituição envolve a troca de átomos ou grupos de átomos ligados à cadeia carbônica. No contexto da química orgânica, as reações de substituição são de grande importância para a síntese de moléculas orgânicas.[1]
Na reação geral acima, o grupo Y é o grupo de entrada e X é o grupo de saída. As reações de substituição são classificadas de acordo com a natureza do grupo de entrada:
- se Y reage através de um par de elétrons, Y é um nucleófilo e a reação é uma substituição nucleofílica;
- se Y reage através de um elétron desemparelhado, Y é um radical e a reação é uma substituição radicalar;
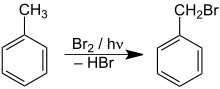
A bromação do tolueno é um exemplo de substituição radicalar - se Y reage é uma espécie química deficiente de elétrons, Y é um eletrófilo e a reação é uma substituição eletrofílica;
O conhecimento pormenorizado dos vários tipos de substituição possíveis permite prever o resultado de uma reação química, assim como escolher a temperatura e o solvente corretos para a sua ocorrência.
Substituições nucleofílicas[editar | editar código-fonte]
Este tipo de reações de substituição ocorrem quando o reagente é um nucleófilo, o que significa, um átomo ou moléculas que reagem através de um par de elétrons isolados (não-ligantes).
- Um nucleófilo reage com um substrato alifático em uma reação de substituição nucleofílica alifática.
- Quando o substrato é um composto aromático o tipo da reação é uma substituição nucleofílica aromática, e um exemplo ocorre na substituição em derivados do trinitrobenzeno, como no esquema.
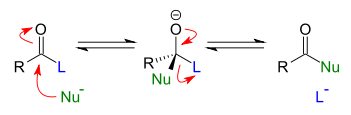
- Derivados de ácidos carboxílicos reagem com nucleófilos em substituição nucleofílica acílica (referente ao grupo acilo). Este tipo de reação é importante para a síntese de ésteres, amidas e na hidrólise destes compostos.
As substituições nucleofílicas (SN) em carbono alifático são importantes na síntese de álcoois, éteres, aminas, haloalcanos, entre outras funções orgânicas. O mecanismo da reação pode se dar por dois mecanismos principais:
- Substituição nucleofílica unimolecular (SN1): neste mecanismo de reação, ocorre a quebra da ligação C-X antes da formação da ligação C-Y. O grupo X abandona a cadeia carbônica, levando o par de elétrons da ligação C-X e o carbono fica com uma carga positiva, formando um carbocátion. Na etapa seguinte, nucleófilo reagem com o carbocátion, formando uma nova ligação covalente. A reação sobre carbonos assimétricos de moléculas quirais resulta na racemização. O mecanismo SN1 ocorre em carbonos terciários e solventes com alta constante dielétrica, como água, metanol e ácido acético.

mecanismo SN1 - Substituição nucleofílica bimolecular (SN2): no mecanismo SN2 a ruptura da ligação C-X e a formação da ligação C-Y ocorre na mesma etapa. O carbono passa por um estado de transição trigonal e não desenvolve carga. Este mecanismo ocorre com inversão de configuração em carbonos assimétricos. O mecanismo SN2 ocorre em carbonos primários e solventes de média constante dielétrica, como éter etílico, tetrahidrofurano, acetona, acetonitrila.

Substituições eletrofílicas[editar | editar código-fonte]
Eletrófilos estão envolvidos em reações de substituição eletrofílica e particularmente e, substituições eletrofílicas aromáticas:

O mecanismo típico destas reações passa pela ligação do eletrófilo à nuvem pi do anel, formando o intermediário 2b, seguido pela saída do H+ resultando no produto:

- Reações eletrofílicas sobre outros compostos insaturados como alcenos geralmente resultam na adição eletrofílica e não formam produtos de substituição.
Química de coordenação[editar | editar código-fonte]
Em química de coordenação nos complexos dos metais de transição em dissolução também se produzem reações de substituição de um ligando por outro:
- M-X + Y → M-Y + X
Onde X é o grupo de saída e Y o grupo de entrada. Se o grupo de entrada desloca uma molécula de água é conhecido como anionização, e se é o contrário, onde uma molécula de água desloca a um ligando é uma hidrólise.
Segundo seu mecanismo as reações de substituição de ligando podem ser do tipo:
- Dissociativa (D), onde se evidencia a existência de um intermediário com um número de coordenação inferior ao complexo inicial. Uma dissociação anterior ocorre do grupo de saída X seguida de uma coordenação com o grupo entrante. Neste caso a etapa determinante da velocidade é a dissociação de X.
- [MLnX] → [MLn] + X (Reação de equilíbrio)
- [MLn] + Y → [MLnY]
- Associativa (A), onde se comprova que existe um intermediário com um número de coordenação superior ao complexo inicial. Neste caso, primeiro ocorre a coordenação do grupo entrante Y e finalmente a dissociação do grupo de saída. A etapa limitante da velocidade de reação é a formação da ligação com e grupo de entrada Y.
- [MLnX] + Y → [MLnXY] → [MLnY] + X
- Intercâmbio (I), onde não existe evidência de intermediário. Se trata de um processo coordenado. Se diferencia entre intercâmbio associativo (Ia) se a associação tem algo a seguir posteriormente à formação de novas ligações ou dissociativo (Id) se é ao inverso.
Portanto os dois primeiros são mecanismos que dão em duas etapas e o segundo em uma somente.
Referências
- ↑ Fundamentos de Química Orgânica - Ciências da Vida e Saúde, Márcio Lazzarotto (ebook )
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A. ISBN 84-282-0882-4.
- A.G. Sharpe (1993). Química Inorgánica. Barcelona: Editorial Reverté, S.A. ISBN 84-291-7501-6.
- D.F. Shriver, P.W. Atkins, C.H. Langford (1998). Química Inorgánica. Barcelona: Editorial Reverté, S.A. ISBN 84-291-7006-5.