Seleneto de hidrogênio
| Seleneto de hidrogênio Alerta sobre risco à saúde | |
|---|---|

|

|
| |
| Nome IUPAC | Hydrogen selenide |
| Outros nomes | Ácido selenídrico selane Hidreto de selênio |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| KEGG | |
| ChEBI | |
| Número RTECS | X1050000 |
| SMILES |
|
| InChI | 1/H2Se/h1H2
|
| Propriedades | |
| Fórmula molecular | H2Se |
| Massa molar | 80,98 g/mol |
| Aparência | Gás incolor |
| Densidade | 3,66 g·l-1 (0 °C, 1013 hPa)[1] 1,97 g·cm-3 (líquido, no ponto de fusão)[1] |
| Ponto de fusão |
-66 °C [1] |
| Ponto de ebulição |
-41 °C (decompõe-se acima de 150 °C)[1] |
| Solubilidade em água | solúvel (9,8 g·l-1)[1] |
| Solubilidade | solúvel em CS2, fosgênio |
| Pressão de vapor | 0,91 MPa a 20 °C[1] |
| Acidez (pKa) | 3,89 |
| Estrutura | |
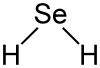
| Forma molecular | Angulada |
| Riscos associados | |
| MSDS | ICSC 0284 |
| Classificação UE | Altamente inflamável (F+) Tóxico (T) Perigoso para o ambiente (N) |
| Índice UE | 034-002-00-8 |
| NFPA 704 | |
| Frases R | R12, R26 |
| Frases S | S1, S9, S16, S33, S36, S45 |
| Ponto de fulgor | Gás inflamável |
| Compostos relacionados | |
| Outros aniões/ânions | H2O H2S H2Te H2Po |
| Outros catiões/cátions | Na2Se Ag2Se |
| Compostos relacionados | Arsina (AsH3) Brometo de hidrogênio Seleneto de metila (Se(CH3)2) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Seleneto de hidrogênio é o composto químico de fórmula H2Se, o mais simples hidreto de selênio. H2Se é um gás incolor, inflamável sob condições padrão. É o mais tóxico composto de selênio com um limite de exposição de 0,05 ppm em um período de 8 horas. Este composto tem um cheiro muito irritante que lembra raiz-forte deteriorada.
Estrutura e propriedades[editar | editar código-fonte]
H2Se adota uma estrutura "curvada" com um ângulo de 91° entre as ligações H-Se-H. Consistente com esta estrutura, três bandas vibracionais ativas em infravermelho são observadas: 2358, 2345 e 1034 cm−1.
As propriedades do H2S e do H2Se são similares, embora o seleneto seja mais ácido, com pKa = 3.89, e o segundo pKa = 11.0 at 25 °C. Refletindo sua acidez, H2Se é solúvel em água.
Preparação[editar | editar código-fonte]
Industrialmente, é produzido por tratar o selênio elementar a T > 300 °C com hidrogênio gasoso.[2] Uma variedade de rotas para obter-se H2Se tem sido apresentadas, as quais são adequadas tanto para preparações de grande como pequena escala. Em laboratório, H2Se é normalmente preparado pela ação de água sobre Al2Se3, concomitante com a formação de alumina hidratada. Uma reação relacionada envolve a hidrólise ácida de FeSe.[3]
- Al2Se3 + 6 H2O ⇌ 2 Al(OH)3 + 3 H2Se
H2Se também pode ser preparado por meio de métodos diferentes com base na geração in situ em solução aquosa usando-se hidreto de boro, o teste de Marsh e a liga de Devarda. De acordo com o método de Sonoda, H2Se é gerado pela reação de H2O e CO sobre Se na presença de Et3N.[4] H2Se pode ser adquirido em cilindros.
Reações[editar | editar código-fonte]
O selênio elementar pode ser recuperado de H2Se através de uma reação com solução aquosa de dióxido de enxofre (SO2).
- 2 H2Se + SO2 ⇌ 2 H2O + Se + S
Sua decomposição é usada pera preparar o selênio elemental altamente puro.
Aplicações[editar | editar código-fonte]
H2Se é comumente usado na síntese de compostos contendo Se. Ele permite acreções em alcenos. Ilustrativa é a síntese de selenourea de nitrilas.[5]

O seleneto de hidrogênio também é usado para obter o composto heterocíclico selenofeno com a condencação com os alquinos.
Segurança[editar | editar código-fonte]
O gás é perigoso, sendo um dos compostos mais tóxicos de selênio. O valor limite é de 0,05 ppm. Em altas concentrações, mesmo em exposição menores que um minuto, o gás ataca os olhos e mucosas causando sintomas similares aos gripais, pelo menos, por alguns dias.
Na Alemanha, o limite em água potável é 0,008 mg/L, e a US EPA recomenda uma contaminação máxima de 0,01 mg/L.[2][6]
Referências
- ↑ a b c d e f Registo de CAS RN 7783-07-5 na Base de Dados de Substâncias GESTIS do IFA.
- ↑ a b Bernd E. Langner "Selenium and Selenium Compounds" na Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a23_525.
- ↑ Féher, F. In "Handbook of Preparative Inorganic Chemistry"; Brauer, E., Ed.; Academic: New York, 1963; 1, p 418.
- ↑ Sonoda, N.; Kondo K.; Nagano, K.; Kambe, N.; Morimoto, F. Angewandte Chemie, International Edition English 1980, vol. 19, page 308
- ↑ V.I. Cohen "A Convenient Synthesis of Mono-, N,N′-Di-, and Trisubstituted Selenoureas from Methyl Carbamimidothioates (S-Methylpseudothioureas)" Synthesis, 1980, 60-3 (1980).
- ↑ http://www.osha.gov/dts/chemicalsampling/data/CH_246700.html, OSHA GENERAL INDUSTRY PEL: 0.05 ppm, 0.2 mg/m3 ,OSHA CONSTRUCTION INDUSTRY PEL: 0.05 ppm, 0.2 mg/m3 TWA

