Talidomida
| Talidomida Alerta sobre risco à saúde | |
|---|---|
| |
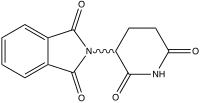
| Nome IUPAC | (RS)-2-(2,6-dioxopiperidin-3-il)-1H-isoindol-1,3(2H)-diona |
| Identificadores | |
| Número CAS | |
| PubChem | |
| DrugBank | APRD01251 |
| ChemSpider | |
| Código ATC | L04 |
| SMILES |
|
| Farmacologia | |
| Via(s) de administração | oral |
| Metabolismo | Hepático (CYP2C19)[1] |
| Meia-vida biológica | a meia-vida média varia entre 5 e 7 horas após dose única; não é alterada em dosagem múltipla |
| Ligação plasmática | 55% e 66% para os enantiômeros (+)-R e (–)-S, respectivamente |
| Classificação legal |
Lista de substâncias sujeitas a controle especial - Lista C3 (BR)
℞ Prescription only |
| Riscos na gravidez e lactação |
X (EUA) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
A talidomida (C13H10N2O4) é uma substância usualmente utilizada como medicamento sedativo, anti-inflamatório e hipnótico. Devido a seus efeitos teratogénicos, tal substância deve ser evitada durante a gravidez e em mulheres que podem engravidar, pois pode causar malformações ou ausência de membros no feto. A talidomida foi criada pelo médico alemão Heinrich Mückter, que participou dos experimentos nos campos nazistas onde drogas e vacinas inventadas por ele foram testadas em prisioneiros sem consentimento levando muitos a morte.[2]
História[editar | editar código-fonte]
A talidomida esteve no mercado pela primeira vez na Alemanha em 1 de outubro de 1957. Foi comercializada como um sedativo e hipnótico com poucos efeitos colaterais. A indústria farmacêutica que a desenvolveu acreditou que o medicamento era tão seguro que era propício para prescrever a mulheres grávidas, para combater enjoos matinais. Foi rapidamente prescrita a milhares de mulheres e espalhada para todas as partes do mundo (46 países), sem circular no mercado norte-americano.
Os procedimentos de testes de drogas naquela época eram muito menos rígidos e, por isso, os testes feitos na talidomida não revelaram seus efeitos teratogénicos. Os testes em roedores, que metabolizavam a droga de forma diferente de humanos, não acusaram problemas. Mais tarde, foram feitos os mesmos testes em coelhos e primatas, que produziram os mesmos efeitos que a droga causa em fetos humanos.
No final dos anos 1960, foram descritos na Alemanha, Reino Unido e Austrália os primeiros casos de más-formações congênitas onde crianças passaram a nascer com focomelia, mas não foi imediatamente óbvio o motivo para tal doença. Os bebês nascidos desta tragédia são chamados de "bebês da talidomida", ou "geração talidomida". Em 1962, quando já havia mais de 10 000 casos de defeitos congênitos a ela associados em todo o mundo, a talidomida foi removida da lista de remédios indicados.[3] Os Estados Unidos foram poupados deste problema graças à atuação firme de Frances Oldham Kelsey, farmacologista encarregada pelo FDA (Food and Drug Administration) de avaliar os testes clínicos apresentados pela indústria.
Cientistas japoneses identificaram em 2010 como a talidomida interfere na formação fetal. Eles descobriram que o medicamento inativa a enzima cereblon, importante nos primeiros meses de gestação para a formação dos membros.[4][5]
Por um longo tempo, a talidomida foi associada a um dos mais horríveis acidentes médicos da história. Por outro lado, estão em estudo novos tratamentos com a talidomida para doenças como o câncer de medula[6] e, já há algum tempo, para a hanseníase.[7]
Útil em doenças, como lúpus, alívio dos sintomas de portadores do HIV, diminuição do risco de rejeição em transplantes de medula e artrite reumatoide, a talidomida é indicada em cerca de 60 tratamentos.[4]
Em 2012, a Gruenenthal, empresa produtora da talidomida, pediu desculpas pelos danos causados.[8]
Química farmacêutica[editar | editar código-fonte]
A talidomida é um derivado do ácido glutâmico e estruturalmente contém dois anéis amida e um único centro quiral. Este composto existe na forma de mistura equivalente dos isómeros (S)-(-) e (R)-(+) que se interconvertem rapidamente em condições fisiológicas. O enantiómero (S) está relacionado com os efeitos teratogénicos da talidomida, enquanto o enantiómero (R) é responsável pelas suas propriedades sedativas.
Talidomida no Brasil[editar | editar código-fonte]
Inicialmente, a talidomida ficou disponível no Brasil, comercializada com os seguintes nomes comerciais: Ectiluram®, Ondosil®, Sedalis®, Sedim®, Verdil® e Slip®.[9]
Em 1960, foram relatados os primeiros casos de malformações. Até 1962, o medicamento era comercializado como “isento de efeitos adversos”, embora já tivesse sido banido na Alemanha. Em novembro de 1962, o Serviço Nacional de Fiscalização de Medicina e Farmácia (SNFMF) cassou a licença dos produtos contendo talidomida.[9]
Em 1964, o Termo de Inutilização do Medicamento, datado de 13 de novembro de 1962, entretanto, foi estabelecido formalmente em 30 de junho de 1964. Na prática, a talidomida continuou sendo comercializada no Brasil até 1965.[9]
Na década seguinte, a talidomida voltou a ser utilizada no Brasil para o tratamento da Hanseníase (uso regulamentado pelo MS).[9]
A Organização Mundial da Saúde (OMS) coordenou um ensaio clínico que comprovou a rápida melhora em número significativo de pacientes, levando à liberação do medicamento para tratamento do eritema nodoso hansênico, sob estrita regulação e precauções. Assim, a partir de estudos clínicos e da descoberta de suas aplicações terapêuticas, a talidomida voltou a ser comercializada em alguns países, entre eles o Brasil.[9]
O uso da talidomida no Brasil é regulamentado pela Portaria SVS/MS nº 354, de 15 de agosto de 1997.[10] No Rio de Janeiro, foi editada a Resolução SES nº 1504, de 15 de junho de 2000, com o objetivo de criar um Grupo Técnico de Trabalho para Implantação de Protocolo Terapêutico de Utilização da Talidomida.[11] Pouco se sabe sobre o uso da talidomida no Brasil. Segundo consta, a talidomida, por força da Portaria nº 354, é proibida para mulheres em idade fértil em todo o território nacional.[12]
A Lei nº 10.651, de 16 de abril de 2003, no art. 1º, inciso III, exige que a embalagem e o rótulo exibam “ostensivamente a proibição de seu uso por mulheres grávidas ou sob risco de engravidar, acompanhada de texto, em linguagem popular, que explicite a grande probabilidade de ocorrência de efeitos teratogênicos associados a esse uso”(19); as exceções em mulheres podem ocorrer apenas nos programas expressamente qualificados (art. 3°, II), (Anexo A).[9]
Em 2010, foi instituída a lei nº 12 190[13] que complementa a lei nº 7 070, de 1982, e representa gastos de aproximadamente R$ 34,5 milhões como pensão especial, mensal, vitalícia e intransferível aos portadores da deficiência. Serão 227 vítimas que vão receber R$ 50 mil em indenização, valor que aumentará na medida em que ocorra dependência resultante da deficiência física.[14] No Brasil, somente o laboratório da Fundação Ezequiel Dias está autorizado a produzir a talidomida.[4]
Em 2011, foi publicada a RDC nº 11, de 22 de março, que trata do controle da substância/ medicamento talidomida; regulamenta a Lei nº 10.651, de 16 de abril de 2003, trazendo como impactos positivos a simplificação de normas relacionadas à talidomida; maior esclarecimento de prescritores e demais profissionais de Saúde; melhor orientação a pacientes devido às alterações de materiais de embalagem e termos de esclarecimento; definição de responsabilidades das Vigilâncias Sanitárias e Assistências Farmacêuticas[9]
A RDC nº 11, de 22 de março de 2011, revoga: a) a Portaria MS/SVS nº 63/1994, a Portaria MS/SVS nº 354/1997, a RDC nº 34/2000; b) o art. 20, o art. 24, o parágrafo único do art. 26, o § 2º do art. 27, o § 8º do art. 35, o art. 49, os §§ 2º e 3º do art. 64, o art. 70 e o art. 85, todos da Portaria MS/SVS nº 344, de 12 de maio de 1998; c) revoga, unicamente no que se refere à substância talidomida, o art. 29, o caput e o § 7º do art. 35, o caput do art. 36, o art. 37, o art. 51 e o § 2º do art. 63, todos da Portaria MS/SVS nº 344, de 12 de maio de 1998; d) revoga o art. 50, o art. 51, o art. 52, o art. 83, o art. 88, o § 5º do art. 93 e o art. 105, todos da Portaria MS/SVS nº 6, de 29 de janeiro de 1999; e) revoga, unicamente no que se refere à substância talidomida, o art. 65 da Portaria MS/SVS nº 6, de 29 de janeiro de 1999. 2012. Publicada a RDC nº 24, de 12 de abril, que dispõe sobre a atualização do Anexo III, indicações previstas para tratamento com a talidomida, da RDC 11/2011 e RDC n° 50, de 11/11/2015, Dispõe sobre a atualização do Anexo III, da RDC 11/2011.[9]
Links de interesse[editar | editar código-fonte]
- Associação Brasileira dos Portadores da Síndrome da Talidomida
- «Associação Brasileira das Vítimas da Talidomida»
Referências
- ↑ Ando Y, Fuse E, Figg WD (1 de junho de 2002). «Thalidomide metabolism by the CYP2C subfamily». Clinical Cancer Research: an Official Journal of the American Association for Cancer Research. 8 (6): 1964–73. PMID 12060642. Consultado em 18 de junho de 2009
- ↑ Evans, Harold (14 de novembro de 2014). «Thalidomide: how men who blighted lives of thousands evaded justice». The Guardian (em inglês). ISSN 0261-3077
- ↑ Gerson Oliveira Penna, Celina M. T. Martelli, Mariane M. A. Stefani, Vanize O. Macedo, Maria de Fátima Maroja, Aiçar Chaul (2005). «Talidomida no tratamento do eritema nodoso hansênico: revisão sistemática dos ensaios clínicos e perspectivas de novas investigações». Anais Brasileiros da Dermatologia. 80 (5). Consultado em 4 de outubro de 2007. Arquivado do original em 24 de novembro de 2007
- ↑ a b c Cientista descobre como talidomida provoca má-formação em fetos - O Estado de S.Paulo, 12 de março de 2010 (visitado em 12-3-2010)
- ↑ (em inglês)Takumi Ito, Hideki Ando, Takayuki Suzuki, Toshihiko Ogura, Kentaro Hotta, Yoshimasa Imamura, Yuki Yamaguchi, Hiroshi Handa (12 de março de 2010). «Identification of a Primary Target of Thalidomide Teratogenicity». Science. 327 (5971). pp. 1345–1350. doi:10.1126/science.1177319. Consultado em 27 de julho de 2010
- ↑ «Talidomida aumenta sobrevida de idosos com câncer de medula». 5 de Outubro de 2007. Consultado em 5 de outubro de 2007
- ↑ «Defeitos em bebês elevam temor por uso de talidomida no Brasil, diz 'FT'». 2 de outubro de 2007. Consultado em 2 de outubro de 2007
- ↑ «Fabricante da talidomida pede desculpa 50 anos depois»
- ↑ a b c d e f g h Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Talidomida: orientação para o uso controlado / Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância das Doenças Transmissíveis. – Brasília: Ministério da Saúde, 2013.http://portalsaude.saude.gov.br/images/pdf/2014/abril/11/talidomida-orientacoes-web-2.pdf
- ↑ Ministério da Saúde, Brasil (15 de agosto de 1997). «Portaria SVS/MS Nº 354, de 15 de agosto de 1997». 15/08/1997. Consultado em 31 de agosto de 2013
- ↑ «Resolução SES nº 1504, de 15 de junho de 2000». 2000. Consultado em 31 de outubro de 2007
- ↑ «Como Nascemos». Associação Brasileira dos Portadores de Talidomida. Consultado em 31 de outubro de 2007
- ↑ Revista Jurídica - LEI Nº 12.190, DE 13 DE JANEIRO DE 2010 - DOU 14.01.2010
- ↑ Jornal Diário do Nordeste - União vai indenizar deficientes físicos
