Transformação isobárica
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Abril de 2013) |

Uma transformação isobárica é uma transformação termodinâmica na qual a pressão permanece constante em um sistema fechado, sistema este que permite trocas de energia, mas não de matéria, entre o sistema e sua vizinhança. Essa transformação também recebe o nome de Lei de Charles e Gay-Lussac. No século XVIII, o físico francês Jacques Alexandre César Charles descobriu essa relação entre volume e temperatura. Seu interesse surgiu a partir da prática do balonismo. Em 1787 formula a lei da proporção direta entre o volume e a temperatura de um gás a pressão constante. Essas conclusões foram comprovadas experimentalmente por Joseph Louis Gay-Lussac no início do século XIX, sendo então oficialmente publicada. O termo deriva da língua grega iso, "igual" e baros, "pressão". O calor transferido para o sistema realiza trabalho e, portanto, altera a energia interna do sistema, conforme a primeira lei da termodinâmica:
Onde é o calor, a energia interna e o trabalho feito pelo sistema.
Formalismo[editar | editar código-fonte]
À pressão constante, sendo a temperatura da amostra T e o seu volume V, essa relação pode ser expressa matematicamente por:
Onde essa constante depende da temperatura em que ocorre a transformação da amostra do gás confinado no recipiente. Essa relação pode ser descrita ainda de outra forma. Se a amostra de gás, a uma temperatura inicial , ocupando o volume , passar a ter temperatura e volume , mantendo sempre a pressão constante, pode-se afirmar que:
Trabalho[editar | editar código-fonte]
O trabalho realizado por uma transformação isobárica, em um sistema fechado, é definido como:
Como a pressão é constante ela sai fora da integral:
A integral de é a própria variação do volume .
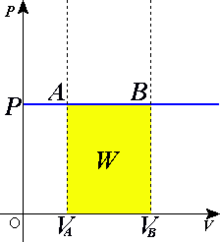
Obs: Vide o diagrama PxV e veja que o valor dessa integral é a própria área W, em amarelo.
Aplicando a Lei dos Gases Ideais, onde segue a relação , o trabalho torna -se:
assumindo que a quantidade de gás permanece constante, por exemplo, não existe uma transição de fase , durante uma reação química. De acordo com o teorema da equipartição, a mudança na energia interna está relacionado com a temperatura do sistema,
onde é o calor específico a volume constante.
Substituindo as duas últimas equações na primeira equação, , temos:
onde é o calor específico à pressão constante.
Convenção para o sinal do trabalho:
- Se o volume comprime (), então . Ou seja, durante a compressão o gás realiza trabalho negativo e o ambiente realiza trabalho sobre o sistema.
- Se o volume aumenta (), então . Isto é, durante a expansão do gás o trabalho é positivo, ou equivalentemente, o ambiente recebe o trabalho exercido pelo gás.
Ver também[editar | editar código-fonte]
Bibliografia[editar | editar código-fonte]
- HALLIDAY, D., RESNICK,R., WALKER, J., Fundamentos de física. 8ª edição, vol. 2, editora LTC




























