Doença de Chagas: diferenças entre revisões
m Foram revertidas as edições de 187.117.164.103 para a última revisão de Vitor Mazuco (usando Huggle) |
ampliando + nova versão |
||
| Linha 16: | Linha 16: | ||
Os sintomas da doença de Chagas podem variar durante o curso da [[infecção]]. A fase aguda, que dura em torno de 4 a 16 semanas,geralmente é assintomática. Porém, quando surgem sintomas, estes podem variar de leves (febre baixa, adinamia,anorexia), moderados (linfoadenopatia, esplenomegalia, hepatomegalia) até graves ( meningite e miocardite). Após a total reversão do quadro clínico agudo, inicia-se uma fase totalmente assintomática. Na metade dos casos o indivíduo infectado com T. cruzi pode manter-se sem sintomas ao longo de toda a sua vida. Esta forma clínica é chamada de 'Indeterminada". A outra metade pode desenvolver cardiopatia, em vários graus, megaesôfago e ou megacólon. O aparecimento destas manifestações ocorrem após décadas da infecção aguda (10 a 40 anos). Esta forma clínica é denominada de forma crônica, e diferente da forma indeterminada, é responsável pela morbimortalidade da doença de Chagas. O tratamento etiológico, trypanossomicida, é indicado na fase aguda, quando a sua eficácia é inquestionável e pode-se obter cura definitiva. Já na fase crônica não há consenso quanto ao tratamento etiológico. O tratamento é focado no órgão acometido e pode ser clínico medicamentoso ou cirúrgico. Nesta fase o tratamento não visa a cura da doença de Chagas, mas sim a qualidade de vida, minimizando intercorrências e aumentando a sobrevida, em especial, dos portadores de cardiopatia chagásica crônica. |
Os sintomas da doença de Chagas podem variar durante o curso da [[infecção]]. A fase aguda, que dura em torno de 4 a 16 semanas,geralmente é assintomática. Porém, quando surgem sintomas, estes podem variar de leves (febre baixa, adinamia,anorexia), moderados (linfoadenopatia, esplenomegalia, hepatomegalia) até graves ( meningite e miocardite). Após a total reversão do quadro clínico agudo, inicia-se uma fase totalmente assintomática. Na metade dos casos o indivíduo infectado com T. cruzi pode manter-se sem sintomas ao longo de toda a sua vida. Esta forma clínica é chamada de 'Indeterminada". A outra metade pode desenvolver cardiopatia, em vários graus, megaesôfago e ou megacólon. O aparecimento destas manifestações ocorrem após décadas da infecção aguda (10 a 40 anos). Esta forma clínica é denominada de forma crônica, e diferente da forma indeterminada, é responsável pela morbimortalidade da doença de Chagas. O tratamento etiológico, trypanossomicida, é indicado na fase aguda, quando a sua eficácia é inquestionável e pode-se obter cura definitiva. Já na fase crônica não há consenso quanto ao tratamento etiológico. O tratamento é focado no órgão acometido e pode ser clínico medicamentoso ou cirúrgico. Nesta fase o tratamento não visa a cura da doença de Chagas, mas sim a qualidade de vida, minimizando intercorrências e aumentando a sobrevida, em especial, dos portadores de cardiopatia chagásica crônica. |
||
== |
==Sinais e sintomas== |
||
[[ |
[[Imagem:Chagoma.jpg|thumb|Na fase aguda da doença de Chagas, pode haver edema unilateral da órbita ocular ([[sinal de Romaña]]).]] |
||
[[Imagem:Heart pathology Chagas disease.JPG|thumb|Peça anatômica de um coração acometido pela doença de Chagas crônica – ver também: [[:Image:Heart radiology Chagas disease.JPG|coração chagásico em uma radiografia]].]] |
|||
A doença tem uma fase aguda, de curta duração, que em alguns doentes progride para uma fase crônica. Dentre os sintomas possíveis na fase aguda estão<ref>http://www.drauziovarella.com.br/Sintomas/239/doenca-de-chagas</ref>: |
|||
A doença apresenta dois estágios em seres humanos: uma fase [[doença aguda|aguda]], que ocorre pouco tempo após a infecção, e uma fase [[doença crônica|crônica]] que se desenvolve ao longo de muitos anos.<ref name=Guerrant/> |
|||
*[[Febre]]; |
|||
*[[Mal-estar]]; |
|||
*[[Linfadenopatia|inflamação e dor nos gânglios linfáticos]]; |
|||
*[[Eritema|Vermelhidão]]; |
|||
*[[Sinal de Romaña]] (inchaço nos olhos); |
|||
*[[Hepatoesplenomegalia|aumento do fígado e do baço]]; |
|||
*[[Miocardite|Problemas cardíacos]]; |
|||
* |
|||
*[[Diarreia]]. |
|||
Porém a fase aguda é frequentemente pouco sintomática, geralmente passando despercebida, motivo pelo qual é tão difícil fazer a prevenção adequada de Chagas. A incubação dura de uma semana a um mês após a picada. No local da picada pode-se desenvolver uma lesão volumosa, o ''chagoma'', local [[eritema|eritematosa]] (vermelha), inflamação e dor nos gânglios e [[edema]]tosa (inchada). Se a picada for perto do [[olho]] é frequente a [[conjuntivite]] com edema da pálpebra, também conhecido por [[sinal de Romaña]]. Raramente ocorre também [[meningoencefalite|infecção da meninge]]. Entre 20 a 60% dos casos agudos se transformam, em 2 a 3 meses, em portadores com parasitas sanguíneos continuamente, curando-se os restantes. No entanto, em todos os casos param os sintomas após cerca de dois meses. Muitos, mas não todos, os portadores do parasita desenvolvem sintomas devido à doença crônica. |
|||
A fase aguda ocorre durante as primeiras semanas ou meses desde a infecção. Geralmente, ela não é notada por ser assintomática ou por exibir apenas sintomas moderados que não são únicos da doença de Chagas. Os sintomas podem incluir febre, fadiga, dor no corpo, dor de cabeça, [[exantema]], perda de apetite, diarreia e vômitos. Os sinais no exame físico podem incluir aumento moderado do fígado, do baço e de linfonodos, e inchaço no local da picada do barbeiro (o [[chagoma]]).<ref name=Kashiwabara/> |
|||
O caso crônico permanece assintomático durante cinco a trinta anos. No entanto neste período de bem-estar geral, o parasita está a reproduzir-se continuamente em baixos números, causando danos sérios a órgãos como [[baço]], [[intestino]], [[sistema nervoso]], [[coração]], e causa também pequenos danos no [[Pulmão|pulmão]]. O [[fígado]] também é afetado mas como é capaz de regeneração, os problemas são raros. O resultado é apenas aparente após uma ou duas décadas de progressão, com aparecimento gradual de [[demência]] (3% dos casos iniciais), cardiomiopatia (em 30% dos casos), ou dilatação do trato digestivo, conhecidas como [[megaesófago]] ou [[megacólon]] (6% dos casos iniciais), devido à destruição da inervação e das células musculares destes órgãos, responsável pelo seu tónus muscular. No [[cérebro]] há frequentemente formação de [[granuloma]]s. Neste estágio a doença é frequentemente fatal, mesmo com tratamento, geralmente devido à cardiomiopatia ([[insuficiência cardíaca]]). No entanto o tratamento pode aumentar a esperança e qualidade de vida (ver mais abaixo secção sobre tratamento). |
|||
O marcador mais conhecido da fase aguda da doença de Chagas é chamado sinal de Romaña. O sinal é caracterizado pelo edema das pálpebras do mesmo lado do rosto em que se localiza a ferida produzida pela picada do barbeiro, onde as fezes foram depositadas pelo inseto ou mesmo quando acidentalmente esfregadas para dentro do olho. Raramente, crianças e adultos morrem durante a fase aguda da doença, porém pode ocorrer uma grave inflamação do músculo cardíaco ([[miocardite]]) ou do cérebro ([[meningoencefalite]]), que colocam a vida em risco.<ref name=Guerrant /> A fase aguda também pode ser grave em pessoas com o sistema imunitário comprometido.<ref name=CDC>{{cite web|publisher=Centers for Disease Control (CDC) |url= http://www.cdc.gov/dpdx/trypanosomiasisAmerican/index.html |title=DPDx – Trypanosomiasis, American. Fact Sheet |accessdate=12 de maio de 2010}}</ref> |
|||
Há ainda infrequentemente casos de morte súbita, quer em doentes agudos quer em crónicos, devido à destruição pelo parasita do sistema condutor dos batimentos no coração ou danos cerebrais em áreas críticas. |
|||
Se houver o desenvolvimento de sintomas durante a fase aguda, eles geralmente se resolvem espontaneamente dentro de três a oito semanas em aproximadamente 90% dos indivíduos.<ref name=Rassi2010>{{citar periódico |autor=Rassi, A.; Rassi, A.; Marin-Neto, J.A. |título=Chagas disease |periódico=Lancet |volume=375 |número=9723 |páginas=1388–402 |ano=2010 |pmid=20399979 |doi=10.1016/S0140-6736(10)60061-X}}</ref><ref name=Bern>{{citar periódico |autor=Bern, C.; Montgomery, S.P.; Herwaldt, B.L. ''et al.''|título=Evaluation and treatment of chagas disease in the United States: a systematic review |journal=JAMA |volume=298 |número=18 |páginas=2171–81 |ano=2007|pmid=18000201 |doi=10.1001/jama.298.18.2171}}</ref> Embora os sintomas se resolvam, mesmo com o tratamento, a infecção persiste e entra em sua fase crônica. Dos indivíduos com doença de Chagas crônica, 60–80% jamais desenvolverão sintomas (chamada doença de Chagas crônica ''indeterminada''), enquanto 20–40% desenvolverão sintomas cardíacos e/ou problemas digestivos (chamada doença de Chagas crônica ''determinada''). Em 10% dos indivíduos, a doença progride diretamente da fase aguda para uma forma clínica sintomática da doença de Chagas.<ref name=Rassi2010/><ref name=Bern/> |
|||
== Ciclo de Vida do Agente Causador == |
|||
A doença crônica sintomática (determinada) afeta vários sistemas do organismo, como [[sistema nervoso|nervoso]], [[sistema digestório|digestório]] e [[sistema cardiovascular|cardíaco]]. Cerca de dois terços das pessoas com sintomas crônicos apresentam danos ao coração, incluindo a [[miocardiopatia dilatada]], que causa anormalidades do ritmo cardíaco e pode resultar em morte súbita. Cerca de um terço dos pacientes apresenta danos ao sistema digestório, resultando em dilatação do [[trato digestivo]] ([[megacólon]] e [[megaesôfago]]), acompanhados de grave [[emagrecimento]]. A dificuldade de [[deglutição]] (secundária à [[acalásia]]) pode ser o primeiro sintoma dos distúrbios digestivos e pode levar à [[desnutrição]].<ref name=emed>{{citar web|url=http://emedicine.medscape.com/article/214581-overview |título=Chagas Disease (American Trypanosomiasis) |autor=Kirchhoff, L.V. |data=17 de dezembro de 2010 |publicado=eMedicine |acessodata=12 de maio de 2010}}</ref> |
|||
[[Ficheiro:Chagas ciclo de doença.JPG|frame|center|Ciclo do Trypanossoma cruzi]] |
|||
[[Ficheiro:Triatoma infestans.jpg|left|thumb|''[[Triatoma]] infestans'', um dos insetos ''barbeiros'' transmissores da doença de Chagas]] |
|||
20% a 50% dos indivíduos com envolvimento intestinal também exibem acometimento cardíaco.<ref name=emed/> Mais de 10% das pessoas cronicamente infectadas desenvolvem [[neurite]], que resulta em alterações sensoriais e dos reflexos tendinosos. Casos isolados exibem envolvimento do sistema nervoso central, incluindo [[demência]], confusão, [[encefalopatia]] crônica e perdas [[estímulo (fisiologia)|sensoriais]] e [[motricidade|motoras]].<ref>{{citar periódico |autor=Córdova, E.; Maiolo, E.; Corti, M.; Orduña, T. |título=Neurological manifestations of Chagas' disease |periódico=Neurolology Research |volume=32 |número=3 |páginas=238–44 |ano=2010 |pmid=20406601 |doi=10.1179/016164110X12644252260637}}</ref> |
|||
=== Percevejos === |
|||
Os principais percevejos hematófagos (que se alimentam de sangue) da subfamília [[Triatominae]] (família [[Reduviidae]]) das espécies pertencentes aos gêneros [[Triatoma]], [[Rhodnius]] e [[Panstrongylus]], sendo os principais vetores o: |
|||
*[[Triatoma infestans]]; |
|||
*[[Triatoma brasiliensis]]; |
|||
*[[Triatoma pseudomaculata]]; |
|||
*[[Triatoma sordida]] e o; |
|||
*[[Panstrongylus megistus]]. |
|||
As manifestações clínicas da doença de Chagas se devem à morte de células nos tecidos envolvidos no ciclo infeccioso do parasita, induzindo a [[inflamação|respostas inflamatórias]], lesões celulares e [[fibrose]]. Por exemplo, o [[amastigoto]] intracelular destrói os neurônios intramurais do [[sistema nervoso autônomo]] do intestino e do coração, levando ao megacólon e aos [[aneurisma]]s cardíacos, respectivamente. Se não tratada, a doença de Chagas pode ser fatal, na maioria dos casos por danificação do tecido muscular cardíaco.<ref name=emed/> |
|||
O [[Triatoma infestans|barbeiro]] é o principal vetor da doença, responsável por mais de 50% dos casos, e habitando 11 estados brasileiros. Se infecta ao sugar o sangue de um organismo infectado. No intestino do vetor, o tripomastigoto se transforma em epimastigoto que então se reproduz. O tripomastigoto não se reproduz. O homem por sua vez, é infectado pelas fezes ou urina contaminadas do [[Triatomíneo]] (barbeiro no Brasil) que, enquanto suga o sangue, defeca nesse mesmo local. O [[DDT]] ainda é usado no controle dos percevejos apesar de sua toxicidade. |
|||
Os insetos ainda não apresentaram resistência aos inseticidas o que é importante para o combate ao vetor da doença de chagas. |
|||
Há uma considerável variação geográfica na ocorrência das complicações cardíacas e de dilatações gastrointestinais em pacientes com doença de Chagas crônica. Na maioria dos países da América do Sul, as dilatações são quase tão comuns quanto o comprometimento cardíaco. Mas na Colômbia, Venezuela, América Central e México as dilatações são praticamente desconhecidas. Não se sabe se fatores do hospedeiro ou diferenças nas cepas do parasita causariam estes diferentes padrões de expressão clínica da doença.<ref name=Guerrant/> |
|||
Em florestas densas esses percevejos são controlados por seus predadores naturais (como sapos e lagartos), porém em áreas recém devastadas e rurais eles se reproduzem rapidamente sem a ameaça dos predadores.<ref>Teixeira AR, Monteiro PS, Rebelo JM (2001). "Emerging Chagas disease: trophic network and cycle of transmission of Trypanosoma cruzi from palm trees in the Amazon". Emerging Infect Dis 7 (1): 100–12. doi:10.3201/eid0701.010115. PMC 2631687. PMID 11266300.</ref> |
|||
==Transmissão== |
|||
=== Transfusão de sangue === |
|||
[[Imagem:Tbrasiliensis-pintura.jpg|thumb|left|''[[Triatoma brasiliensis]]'' é o principal vetor da doença no Brasil, está presente em 12 estados.<ref>{{citar periódico |autor=Costa, J.; Peterson, A.T.; Beard, C.B. |ano=2002 |título=Ecologic niche modeling and differentiation of populations of ''Triatoma brasiliensis'' Neiva, 1911, the most important Chagas' disease vector in northeastern Brazil (Hemiptera, Reduviidae, Triatominae) |periódico=American Journal of Tropical Medicine and Hygiene |volume=67 |número=5 |páginas=516-520 |doi=}}</ref>]] |
|||
Nas áreas endêmicas, o principal mecanismo de transmissão é o vetorial, ou seja, através de um inseto [[vetor (epidemiologia)|vetor]] da subfamília [[Triatominae]].<ref name=CDC/> O inseto infecta-se com ''T. cruzi'' ao alimentar-se de sangue de animais ou humanos contaminados. De hábitos noturnos, o inseto esconde-se durante o dia em fendas nas paredes e telhados. À noite ele emerge, quando os habitantes estão dormindo. Por causa da tendência de picar a face das pessoas, o inseto é popularmente conhecido como "barbeiro" ou "chupão". Após a picada e a ingestão de sangue, ele defeca próximo ao local. O [[prurido]] intenso no local da picada ajuda as formas infectantes de ''T. cruzi'' (denominadas de [[tripomastigota]]s), nas fezes, a penetrarem na ferida da picadura, mas elas também podem penetrar por mucosas intactas, como a [[conjuntiva]]l.<ref name=CDC/> |
|||
A infecção também pode se dar por transfusão de sangue ou [[transplante de órgãos]], ou por via placentária. Diversos programas de saúde em países latino-americanos estão tentando controlar a incidência, dentre eles o Brasil. Desde então as de taxas de infecção natural de T. infestans foram reduzidas de 8,4% (1983) a 2,9% (em 1997).<ref name=Vinhaes>Márcio C. Vinhaes, João Carlos Pinto Dias. Doença de Chagas no Brasil. Cad. Saúde Pública, Rio de Janeiro, 16(Sup. 2):7-12, 200</ref> Segundo o [[Sinan]], o número de casos e mortes segue caindo rapidamente, chegando a apenas 187 notificações de casos agudos no país inteiro e apenas 3 mortes em 2008. <ref>https://sites.google.com/site/tripacruzi/incidencia-e-prevalencia</ref> |
|||
Uma vez dentro do hospedeiro, o tripomastigota invade as células próximas à inoculação, onde diferenciam-se em [[amastigota]]s intracelulares. Os amastigotas multiplicam-se por [[divisão binária]] e diferenciam-se em tripomastigotas, que são liberados na corrente sanguínea, infectando células de tecidos variados, e este ciclo então é repetido diversas vezes. As manifestações clínicas são resultado deste ciclo infeccioso. Os tripomastigotas circulantes não se replicam (diferente da [[tripanossomíase africana]]). E a replicação só recomeça quando os parasitas entram em outras células ou são ingeridos por outro vetor.<ref name=CDC/> |
|||
Notícia de março de 2005 relatava uma forma alternativa, oral, de infecção, abre um campo de pesquisa ainda não explorado sobre novas formas de infestação. No entanto esta forma de transmissão é, quase certamente, rara. Embora exista uma descrição de megaesôfago por ''T. cruzi'' em [[Santa Catarina]] em 2003<ref>MAEGAWA, Felipe Antonio Boff et al. Autochthonous Chagas' disease in Santa Catarina State, Brazil: report of the first case of digestive tract involvement. Rev. Soc. Bras. Med. Trop. [online]. 2003, vol.36, n.5 [cited 2011-06-08], pp. 609-612 . Available from: [http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0037-86822003000500011&lng=en&nrm=iso]. ISSN 0037-8682. doi: 10.1590/S0037-86822003000500011.</ref>, não há evidência de infestação oral. Em SC, o ''T. cruzi'', apesar de encontrado na proporção de 21 a 45% em um de seus [[reservatório natural|reservatórios naturais]], o [[gambá]] (''Didelphis marsupialis''), existe nesta espécie sob uma forma menos infectante que a encontrada em [[Minas Gerais]], onde a doença de Chagas é [[endemia|endêmica]]. |
|||
Como doença caracteristicamente rural, tradicionalmente acomete pessoas de origem interiorana que habitam ou habitaram casas de baixa qualidade, onde o vetor facilmente se aloja e coloniza.<ref name=Kashiwabara>{{citar periódico |autor=Kashiwabara, Y.B.; Paiva, R.M.R.A.; Nakaoka, V.Y.; Silva, E.; Kashiwabara, T.G.B. |ano=2010 |título=Doença de Chagas - Revisão de Literatura |periódico=Brazilian Journal of Surgery and Clinical Research |volume=4 |número=3 |páginas=49-52 }}</ref> Vegetação densa (como as das [[florestas tropicais]]) e habitats urbanos não são ideais para o estabelecimento do ciclo de transmissão humano. No entanto, em regiões onde o habitat silvestre e sua fauna são reduzidos pela exploração econômica e ocupação humana, como em áreas recém desmatadas, áreas de cultura da ''[[Leopoldinia piassaba]]'', e algumas partes da [[região amazônica]], um ciclo de transmissão humano pode desenvolver-se quando os insetos procuram por novas fontes de alimentação.<ref>{{citar periódico |autor=Teixeira, A.R.; Monteiro, P.S.; Rebelo, J.M. |ano=2001 |título=Emerging Chagas disease: trophic network and cycle of transmission of ''Trypanosoma cruzi'' from palm trees in the Amazon |periódico=Emerging Infectious Diseases |volume=7 |número=1 |páginas=100–12 |pmid=11266300 |doi=10.3201/eid0701.010115 |pmc=2631687}}</ref> |
|||
=== Transmissão vertical === |
|||
''T. cruzi'' pode também ser transmitido por [[transfusões de sangue]]. Com a exceção dos derivados sanguíneos (como [[anticorpo]]s fracionados), todos os componentes do sangue são infecciosos. O parasita permanece viável a 4 °C por até no mínimo 18 dias ou mais de 250 dias quando mantido em temperatura ambiente. Não está claro se o ''T. cruzi'' pode ser transmitido por meio de componentes do sangue congelados e descongelados.<ref>{{citar periódico |autor=Wendel, S. |ano=2010 |título=Transfusion transmitted Chagas disease: Is it really under control? |periódico=Acta Tropica |volume= 115 |número=1–2 |páginas=28–34 |pmid=20044970 |doi=10.1016/j.actatropica.2009.12.006}}</ref> |
|||
O parasita pode ser transmitido tanto por via placentária quanto pelo leite materno.<ref>Santos Ferreira C, Amato Neto V, Gakiya E, Bezerra RC, Alarcón RS (2003). "Microwave treatment of human milk to prevent transmission of Chagas disease". Revista do Instituto de Medicina Tropical de São Paulo 45 (1): 41–2. PMID 12751321.</ref> A transmissão representa cerca de 13% das mortes durante o parto em algumas partes do Brasil.<ref>Hudson L, Turner MJ (November 1984). "Immunological consequences of infection and vaccination in South American trypanosomiasis [and discussion"]. Philos Trans R Soc Lond, B, Biol Sci 307 (1131): 51–61. doi:10.1098/rstb.1984.0108. PMID 6151688. Retrieved 22 February 2007 through JSTOR.</ref> Em Minas Gerais cerca de 1% das grávidas tem chagas. <ref>Andrade GMQ, Gontijo ED. Diagnóstico e tratamento da Doença de Chagas Congênita. 2007 [online] Disponível: http://www.medicina.ufmg.br/edump/ped/chagas.htm [Acesso em 15 set. 2007].</ref> Em alguns municípios do Brasil o número de grávidas contaminadas chega a 33%, enquanto em outros os casos são raros. A pasteurização do leite materno pode prevenir a transmissão da doença.<ref>http://www.webartigos.com/articles/14293/1/TRANSMISSAO-VERTICAL-DA-DOENCA-DE-CHAGAS-EM-GESTANTES/pagina1.html#ixzz1OuwrHtWu</ref> |
|||
Outros modos de transmissão incluem o transplante de órgãos, amamentação,<ref>{{citar periódico |autor=Santos Ferreira, C.; Amato Neto, V.; Gakiya, E.; Bezerra, R.C.; Alarcón, R.S. |ano=2003 |título=Microwave treatment of human milk to prevent transmission of Chagas disease |periódico=Revista do Instituto de Medicina Tropical de São Paulo |volume=45 |número=1 |páginas=41–2 |pmid=12751321 |doi=10.1590/S0036-46652003000100008 }}</ref> e por exposição laboratorial acidental. A doença de Chagas também pode ser passada congenitamente (de uma mulher grávida para seu filho) através da [[placenta]], e é responsável por aproximadamente 13% das mortes em recém-nascidos em partes do Brasil.<ref>{{citar periódico |autor=Hudson, L.; Turner, M.J.; |ano=1984 |título=Immunological consequences of infection and vaccination in South American trypanosomiasis [and discussion] |periódico=Philosophical Transactions of the Royal Society B |volume=307 |número=1131 |páginas=51–61 |pmid=6151688 |jstor=2990154 |doi=10.1098/rstb.1984.0108 |bibcode = 1984RSPTB.307...51H}}</ref> |
|||
Não existem ainda medidas que evitem a transmissão vertical do parasita, logo a estratégia de controle da infecção congênita é centrada no diagnóstico precoce da infecção em recém-nascidos de mães infectadas e em tratamento específico imediato das crianças ao nascimento. Não se trata o Chagas durante a gravidez pois é difícil acompanhar eficazmente as reações do feto no útero. Felizmente, crianças tratadas ao nascer tem altos índices de cura.<ref>Andrade GMQ, Gontijo ED. Diagnóstico e tratamento da Doença de Chagas Congênita. 2007 [online] Disponível: http://www.medicina.ufmg.br/edump/ped/chagas.htm [Acesso em 15 set. 2007].</ref> |
|||
A transmissão oral é uma via pouco frequente de infecção, mas tem sido descrita. Em 1991, trabalhadores rurais no estado da [[Paraíba]], Brasil, foram infectados ao ingerir comida contaminada; transmissão também foi documentada pela ingestão de suco de [[açaí]] e [[caldo de cana]] infectados.<ref>{{citar periódico |autor=Benchimol-Barbosa, P.R. |título=The oral transmission of Chagas' disease: an acute form of infection responsible for regional outbreaks |periódico=International Journal of Cardiology |volume=112 |número=1 |páginas=132–133 |ano=2006 |pmid=16600406 |doi=10.1016/j.ijcard.2005.11.087 }}</ref><ref>{{citar periódico |autor=Benchimol-Barbosa, P.R. |título=Trends on acute Chagas' disease transmitted by oral route in Brazil: steady increase in new cases and a concealed residual fluctuation |periódico=International Journal of Cardiology |volume=145 |número=3 |páginas=494–496 |ano=2010 |pmid=19762096 |doi=10.1016/j.ijcard.2009.08.030 }}</ref><ref>{{citar periódico |ano=2005 |título=Chagas' disease (American trypanosomiasis) in southern Brazil |periódico=CDR Weekly |volume=15 |número=13 |url=http://www.hpa.org.uk/CDR/archives/2005/cdr1305.pdf}}</ref><ref>{{citar periódico |autor=Shikanai-Yasuda, M.A.; Marcondes, C.B.; Guedes, L.A. |título=Possible oral transmission of acute Chagas' disease in Brazil |periódico=Rev Inst Med Trop São Paulo |volume=33 |número=5 |páginas=351–357 |ano=1991 |pmid=1844961 |doi=10.1590/S0036-46651991000500003 }}</ref><ref>{{citar periódico |autor=da Silva Valente S.A.; de Costa Valente, V.; Neto, H.F. |título=Considerations on the epidemiology and transmission of Chagas disease in the Brazilian Amazon |periódico=Memórias do Instituto Oswaldo Cruz |volume=94 |número=Suppl 1 |páginas=395–8 |ano=1999 |pmid=10677763 |url=http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0074-0276(99)09400077&lng=en&nrm=iso&tlng=en |doi=10.1590/s0074-02761999000700077}}</ref> Um surto em 2007 em 103 crianças numa escola na Venezuela foi atribuído a contaminação do suco de [[Psidium|guava]].<ref>{{citar periódico |autor=de Noya, B.A.; Díaz-Bello, Z.; Colmenares, C.; Ruiz-Guevara, R.; Mauriello, L.; Zavala-Jaspe, R.; Suarez, J.A.; Abate, T.; Naranjo, L.; Paiva, M.; Rivas, L.; Castro, J.; Márques, J.; Mendoza, I.; Acquatella, H.; Torres, J.; Noya, O. |título=Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela |periódico=The Journal of Infectious Diseases |ano=2010 |volume=201 |número=9 |páginas=1308–1315 |pmid=20307205 |doi=10.1086/651608}}</ref> |
|||
=== Açaí e cana de açucar === |
|||
Há ainda casos recentes no Pará que podem estar ligados ao consumo de [[açaí]], estão sendo pesquisados para comprovar essa ligação, pois a fruta pode ser tirada junto com o inseto transmissor e o preparo do alimento talvez não seja seguro<ref>Jornal O Liberal 22.08.2007</ref>. Para impedir a transmissão a [[cana]] e o açaí devem ser [[pasteurização|pasteurizados]], como normalmente é feito nos produtos industrializados, porém não pelos vendedores de sucos artesanais. Em 2007 estimam que 37 contaminações por mal de Chagas ocorreram no Pará dessa forma.<ref>http://g1.globo.com/Noticias/Brasil/0,,MUL95750-5598,00.html</ref> |
|||
A doença de Chagas é um problema emergente na Europa, por causa da grande maioria dos casos de infecção crônica serem assintomáticos e por causa de migrantes provenientes da América Latina.<ref name="Roca2011">{{citar periódico |autor=Roca, C.; Pinazo, M.J.; López-Chejade, P.; Bayó, J.; Posada, E.; López-Solana, J.; Gállego, M.; Portús, M.; Gascón, J.; Chagas-Clot Research Group |título=Chagas Disease among the Latin American Adult Population Attending in a Primary Care Center in Barcelona, Spain |periódico=PLoS Neglected Tropical Diseases |ano=2011 |volume=5 |número=4 |páginas=e1135 |pmid=21572511 |doi=10.1371/journal.pntd.0001135 |pmc=3082512}}</ref> |
|||
=== Relações sexuais === |
|||
A [[relação sexual]] é uma forma de transmissão nunca comprovada na espécie humana, porém já foram encontrados tripomastigotas em menstruação de mulheres com chagas e no esperma de cobaias infectadas.<ref name="Neves">NEVES. David Pereira. ''Parasitologia Humana.'' São Paulo:Atheneu, 2000.</ref> |
|||
== |
==Diagnóstico== |
||
Na fase aguda, a presença do ''T. cruzi'' é diagnóstica para a doença de Chagas. Essa fase é caracterizada pela alta [[parasitemia]], o que permite um diagnóstico parasitológico.<ref name=Pereira2013>{{citar periódico |autor=Pereira, P.C.M.; Navarro, E.C. |ano=2013 |título=Challenges and perspectives of Chagas disease: a review |periódico=Journal of Venomous Animals and Toxins including Tropical Diseases |volume=19 |páginas=34 |doi=10.1186/1678-9199-19-34}}</ref> O parasita, em sua forma móvel (tripomastigota), pode ser detectado por exame microscópico direto no [[esfregaço de sangue]] fresco ou da camada leucocitária; ou pela preparação de esfregaços corados com [[Giemsa]] ou [[Leishman]].<ref name=Kashiwabara/> Microscopicamente, o ''T. cruzi'' pode ser confundido com o ''[[Trypanosoma rangeli]]'', que não é patogênico para humanos.<ref>{{citar livro |autor=Dias, J.C.P.; Coura, J.R. |título=Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral |local=Rio de Janeiro |editora=FIOCRUZ |ano=1997 |páginas=486 |isbn=85-85676-31-0}}</ref> O ''T. cruzi'' pode também ser isolado por [[cultura microbiológica|cultura]] em meios específicos (por exemplo NNN, LIT), tanto na fase aguda como na crônica.<ref name=Portela/><ref>{{citar periódico |autor=Bezerra, R.C.; Neto, V.A. |ano=2010 |título=''Trypanosoma cruzi'', hemocultura: uma abordagem prática |periódico=Revista Brasileira de Clínica Médica |volume=8 |número=3 |páginas=205-207}}</ref> |
|||
[[Ficheiro:Trypanosoma blood.jpg|thumb|'Trypanosoma cruzi' visto no plasma sanguíneo usando um microscópio.]] |
|||
A fase crônica da enfermidade é caracterizada pela baixa parasitemia e alto nível de anticorpos,<ref name=Portela>{{citar periódico |autor=Portela-Lindoso, A.A.B.; Shikanai-Yasuda, M.A. |ano=2003 |título=Doença de Chagas crônica: do xenodiagnóstico e hemocultura à reação em cadeia da polimerase |periódico=Revista de Saúde Pública |volume=37 |número=1 |páginas=107-115 |doi=10.1590/S0034-89102003000100016}}</ref> diminuindo a eficiência da identificação direta do parasita. Portanto, outros métodos são empregados durante esta fase, entre eles a [[hemoaglutinação indireta]] (IFA), [[imunoflurescência indireta]] (IIF), ''enzyme-linked immunosorbent assay'' ([[ELISA]]), [[quimioluminescência]], [[TESA-blot]], [[reação em cadeia da polimerase]] (PCR) e pelo [[xenodiagnóstico]],<ref name=Pereira2013/> onde percevejos não infectados são alimentados com o sangue do paciente suspeito, e então seus intestinos são examinados para a detecção do parasita.<ref>{{citar periódico |autor=Brumpt, E. |ano=1914 |título=Le xénodiagnostic. Application au diagnostic de quelques infections parasitaires et en particulier à la trypanosomose de Chagas |periódico=Bulletin de la Société de Pathologie Exotique |volume=7 |número=10 |páginas=706–710}}</ref> |
|||
O diagnóstico pode ser: |
|||
# [[microscópio óptico|Usando microscópio]] para buscar o parasita no sangue do paciente, o que é possível apenas na fase aguda após cerca de 2 semanas depois da picada. Detecta mais de 60% dos casos nesta fase. |
|||
# Xenodiagnóstico, onde o paciente é intencionalmente picado por barbeiros não contaminados e, quatro semanas depois, seu intestino é examinado em busca de parasitas; ou pela inoculação de sangue do doente em animais de laboratório e verificação se desenvolvem a doença aguda. |
|||
# Detecção do [[DNA]] do parasita por [[PCR]] (reação em cadeia da polimerase). |
|||
# Detecção de [[anticorpo]]s específicos contra o parasita no sangue. É útil nos casos crónicos mas a distinção entre estes e as curas é difícil. Os testes sorológicos sendo os mais utilizados a [[imunofluorescência indireta]] (IFI), [[hemaglutinação]] (HAI) e 'enzyme-linked immunosorbent assay' ([[ELISA]]).<ref name=fiocruz/> |
|||
==Prevenção== |
|||
Testes de maiores complexidades como o teste molecular, utilizando '[[Polymerase Chain Reaction]]' (PCR) acoplado à [[hibridização]] com sondas moleculares, e o [[Western blot]] (WB) têm apresentado resultados promissores e poderão ser utilizados como teste confirmatório tanto na fase aguda como nas formas crônicas da doença (segundo Consenso do Ministério da Saúde em 2005).<ref name=fiocruz>http://www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=102</ref> |
|||
[[Imagem:Chagas disease. Awareness & prevention campaign poster. French Guiana 2008.JPG|thumb|Pôster de uma campanha de alerta e prevenção em [[Caiena]], [[Guiana Francesa]], 2008.]] |
|||
Atualmente, ainda não existe uma vacina contra a doença de Chagas<ref>{{citar web|url=http://www.msf.org/source/actrep/2004/pdf/62-63.pdf |título=A killer that preys on the poor: Chagas disease |format= pdf |trabalho=Médecins Sans Frontières: Activity Report 2003/2004 |acessodata=29 de agosto de 2008}}</ref> e a prevenção é, em geral, focada em eliminar o inseto [[vetor (epidemiologia)|vetor]] com a utilização de sprays e tintas contendo [[inseticida]]s ([[piretroide]]s sintéticos), e em melhorar as condições de saneamento e habitação nas áreas rurais.<ref>{{citar periódico |autor=Zerba, E.N. |título=Susceptibility and resistance to insecticides of Chagas disease vectors |periódico=Medicina (Buenos Aires) |volume=59 |número=Suppl 2 |páginas=41–6 |ano=1999 |url=http://www.medicinabuenosaires.com/revistas/vol59-99/supl2/v59_s2_41_46.pdf |format=PDF}}</ref> Para os moradores de áreas urbanas que vão passar temporadas, como férias ou acampamentos, em regiões endêmicas, recomenda-se o uso de [[mosquiteiro]]s. Algumas medidas de controle incluem: |
|||
== Prevenção == |
|||
* Uma armadilha contendo uma levedura pode ser utilizada para monitorar infestações de certas espécies de triatomíneos (''Triatoma sordida'', ''Triatoma brasiliensis'', ''Triatoma pseudomaculata'' e ''Panstrongylus megistus'').<ref>{{citar periódico |autor=Pires, H.H.; Lazzari, C.R.; Diotaiuti, L.; Lorenzo, M.G. |título=Performance of yeast-baited traps with ''Triatoma sordida'', ''Triatoma brasiliensis'', ''Triatoma pseudomaculata'', and ''Panstrongylus megistus'' in laboratory assays |periódico=Revista Panamena de Salud Publica |volume=7 |número=6 |páginas=384–8 |ano=2000 |pmid=10949899 |doi=10.1590/S1020-49892000000600005}}</ref> |
|||
[[Ficheiro:Rhodnius prolixus70-300.jpg|thumb| O [[Rhodnius prolixus]] também é um perigoso vetor da doença, principalmente nas áreas próximas da floresta Amazônica.]] |
|||
* Foram apresentados resultados promissores com o tratamento dos [[habitat]]s de vetores com o fungo ''[[Beauveria bassiana]]''.<ref>{{cite journal |author=Luz C, Rocha LF, Nery GV, Magalhães BP, Tigano MS |title=Activity of oil-formulated ''Beauveria bassiana'' against ''Triatoma sordida'' in peridomestic areas in Central Brazil |journal=Mem Inst Oswaldo Cruz |volume=99 |issue=2 |pages=211–8 |date=March 2004 |pmid=15250478 |doi=10.1590/S0074-02762004000200017 |url=http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0074-02762004000200017&lng=en&nrm=iso&tlng=en}}</ref> |
|||
* Pode-se selecionar [[simbionte]]s do [[Triatominae]] através de [[paratransgênese]].<ref name="pmid11729071">{{citar periódico |autor=Beard, C.B.; Cordon-Rosales, C.; Durvasula, R.V. |título=Bacterial symbionts of the Triatominae and their potential use in control of Chagas disease transmission |periódico=Annual Review of Entomology |volume=47 |páginas=123–41 |ano=2002 |pmid=11729071 |doi=10.1146/annurev.ento.47.091201.145144}}</ref> |
|||
Inúmeras vacinas estão sendo testadas atualmente. A vacinação com o ''[[Trypanosoma rangeli]]'' tem produzido resultados positivos em modelos animais.<ref name="pmid18660992">{{citar periódico |autor=Basso, B.; Moretti, E.; Fretes, R. |título=Vaccination with epimastigotes of different strains of''Trypanosoma rangeli'' protects mice against ''Trypanosoma cruzi'' infection |periódico=Memórias do Instituto Oswaldo Cruz |volume=103 |número=4 |páginas=370–4 |ano=2008 |pmid=18660992 |doi= 10.1590/S0074-02762008000400010}}</ref> Mais recentemente, o potencial de vacinas com DNA para [[imunoterapia]] da doença de Chagas nas fases aguda e crônica tem sido testado por vários grupos de pesquisadores.<ref>{{citar periódico |autor=Dumonteil, E.; Escobedo-Ortegon, J.; Reyes-Rodriguez, N.; Arjona-Torres, A.; Ramirez-Sierra, M. |título=Immunotherapy of ''Trypanosoma cruzi'' Infection with DNA Vaccines in Mice |periódico=Infection and Immunity |volume=72 |número=1 |páginas=46–53 |ano=2004 |pmid=14688079 |doi=10.1128/IAI.72.1.46-53.2004 |pmc=343959}}</ref> |
|||
Ainda não há vacina para a prevenção da doença<ref>{{cite web |
|||
| title =Doença de Chagas |
|||
| url =http://www.sucen.sp.gov.br/doencas/chagas/texto_chagas.htm |
|||
| date =2001 |
|||
| author =Claudia Antonia Ussui, Rubens Antonio da Silva |
|||
| accessdate =2008-01-09}}</ref>. A prevenção está centrada no combate ao vetor, o barbeiro, principalmente através da melhoria das moradias rurais a fim de impedir que lhe sirvam de abrigo. A melhoria das condições de higiene e a limpeza frequente das palhas e roupas são eficazes. Uma forma possível de prevenir a transmissão dessa doença é o fato do o exame para identificar Chagas ser realizado em todas amostras coletadas, ainda é enviada uma carta nominal com os resultados. <ref>http://www.shdb.com.br/Exames.htm</ref> |
|||
Antigamente, a [[transfusão de sangue]] era o segundo modo mais comum de transmissão da doença de Chagas, mas, com o desenvolvimento e a implementação do controle dos [[banco de sangue|bancos de sangue]], houve uma redução dramática desse risco na última década. A [[doação de sangue]] em todos os países endêmicos da América Latina é submetida a uma pesquisa para Chagas. O teste está sendo expandido para outros países, como França, Espanha e Estados Unidos, que apresentam populações significativas ou em crescimento de imigrantes oriundos de áreas endêmicas.<ref>{{citar periódico |autor=Castro, E. |título=Chagas' disease: lessons from routine donation testing |periódico=Transfus Med |volume=19 |número=1 |páginas=16–23 |ano=2009 |pmid=19302451 |doi=10.1111/j.1365-3148.2009.00915.x}}</ref><ref name=Gascon>{{citar periódico |autor=Gascon, J.; Bern, C.; Pinazo, M.J. |título=Chagas disease in Spain, the United States and other non-endemic countries |periódico=Acta Tropica |volume=115 |número=1–2 |páginas= 22–7 |ano=2009 |pmid=19646412 |doi=10.1016/j.actatropica.2009.07.019}}</ref> Na Espanha, os doadores são avaliados com questionários para identificar indivíduos em risco de exposição à doença de Chagas para realizar a triagem.<ref name=Gascon/> |
|||
Basicamente, a prevenção se dá pela eliminação do vetor, o barbeiro, por meio de medidas que tornem menos propício o convívio deste próximo aos humanos, como a construção de melhores habitações, pois este inseto vive nas frestas das casas de pau-a-pique, ninhos de pássaros, tocas de animais, casca de troncos e sob pedras. |
|||
O ''[[Food and Drug Administration]]'' (FDA), órgão responsável pela aprovação de medicamentos nos EUA, aprovou dois testes para Chagas e publicou manuais que recomendam a triagem de qualquer sangue ou tecido doados.<ref name=Gascon/><ref name=FDA>{{citar web |url=http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm210429.htm |título=FDA Approves Chagas Disease Screening Test for Blood, Tissue and Organ Donors |publicado=FDA |acessodata=12 de maio de 2010}}</ref> Apesar de esses testes não serem obrigatórios nos EUA, estima-se que atualmente 75-90% das doações são testadas para Chagas, incluindo todas as unidades coletadas pela [[Cruz Vermelha Americana]], o que corresponde a 40% de todo o suprimento sanguíneo do país.<ref name=FDA/><ref>{{citar web |url=http://www.redcrossblood.org/hospitals/infectious-disease-testing#Chagas__disease__T._cruzi___2007_ |título=Infectious Disease Testing |publicado=American Red Cross|acessodata=12 de maio de 2010}}</ref> O ''Chagas Biovigilance Network'' relata a incidência atual de produtos sanguíneos positivos para Chagas nos Estados Unidos, segundo o que é notificado pelos laboratórios utilizando os testes de rastreio aprovados pelo FDA em 2007.<ref>{{citar web |url=http://www.aabb.org/programs/biovigilance/Pages/chagas.aspx |título=Chagas' Biovigilance Network |acessodata=12 de maio de 2010}}</ref> |
|||
O uso do [[insecticida]] extremamente eficaz mas tóxico [[DDT]] está indicado em zonas endémicas, já que o perigo dos insetos transmissores é muito maior. |
|||
== |
==Tratamento== |
||
Na doença de Chagas, o tratamento é baseado em drogas [[antiparasitário|antiparasitárias]], para aniquilar o parasita, e no controle dos sinais e sintomas da infecção. O tratamento tem como objetivo reduzir a velocidade de acometimento do [[sistema nervoso parassimpático]]. Os distúrbios autonômicos provocados pela doença podem resultar, eventualmente, em megaesôfago, megacólon e miocardiopatia dilatada acelerada.<ref name="Guerrant">{{citar livro|título=Tropical Infectious Diseases Principles, Pathogens, & Practice |primeiro=RL |último=Guerrant |coautores=Walker, DH; Weller, PF |capítulo=93: American Trypanosomiasis (Chagas' Disease) |edição=2 |local=Philadelphia |editora=Churchill Livingstone Elsevier |páginas=1082-94}}</ref> |
|||
=== Medicamentos === |
|||
Na fase inicial aguda, a administração de fármacos como [[nifurtimox]], [[alopurinol]] e [[Benzonidazol]] curam completamente ou diminuem a probabilidade de [[doença crônica|cronicidade]] em mais de 80% dos casos. |
|||
===Medicamentos=== |
|||
A fase crônica é incurável, já que os danos em órgãos como o [[coração]] e o sistema nervoso são irreversíveis. Tratamento paliativo pode ser usado. |
|||
O tratamento antiparasitário é mais eficiente no início da infecção, mas não está limitado à fase aguda. As drogas de escolha incluem os derivados [[azol|azóis]] e [[nitroderivado|nitro]], tais como o [[benznidazol]]<ref>{{citar periódico |autor=Garcia, S.; Ramos, C.O.; Senra, J.F. |título=Treatment with Benznidazole during the Chronic Phase of Experimental Chagas' Disease Decreases Cardiac Alterations |periódico=Antimicrobial Agents and Chemotherapy |volume=49 |número=4 |páginas=1521–8 |ano=2005 |pmid=15793134 |pmc=1068607 |doi=10.1128/AAC.49.4.1521-1528.2005}}</ref> e o [[nifurtimox]]. Ambos os agentes são limitados na sua capacidade de atingir a cura parasitológica (uma eliminação completa do ''T. cruzi'' do organismo), especialmente em pacientes cronicamente infectados, e já foram relatados casos de resistência a essas drogas.<ref>{{citar periódico |autor=Buckner, F.S.; Wilson, A.J.; White, T.C.; Van Voorhis, W.C. |título=Induction of Resistance to Azole Drugs in ''Trypanosoma cruzi'' |periódico=Antimicrob Agents Chemother |volume=42 |número=12 |páginas=3245–50 |ano=1998 |pmid=9835521 |pmc=106029}}</ref> |
|||
Estudos sugerem que o tratamento antiparasitário leva à cura parasitológica em cerca de 60–85% dos adultos e em mais de 90% das crianças tratadas no primeiro ano desde a fase aguda da doença de Chagas. Crianças (idades entre seis e 12 anos) com a doença crônica apresentam uma taxa de cura de aproximadamente 60% com o benznidazol. Apesar de a taxa de cura diminuir com o tempo em que o adulto está infectado com a doença de Chagas, o tratamento com benznidazol tem se mostrado capaz de postergar o início do acometimento cardíaco em adultos com doença de Chagas crônica.<ref name=Rassi2010/><ref name=emed/> |
|||
Segundo a [[DNDi]], o mal de Chagas, juntamente com a [[doença do sono]] e a [[leishmaniose]], está entre as doenças "extremamente negligenciadas", basicamente em razão da extrema pobreza dos pacientes - que, assim, estão fora do mercado da [[indústria farmacêutica]]. |
|||
O tratamento da infecção crônica em mulheres antes ou durante a gravidez não parece reduzir a probabilidade de a doença ser transmitida para o bebê. Da mesma forma, não está claro se o tratamento [[profilaxia|profilático]] da infecção crônica é benéfico em pessoas que serão submetidas à imunossupressão (por exemplo, em recipientes de transplantes de órgãos) ou em pessoas que já são imunossuprimidas (por exemplo, em pessoas infectadas pelo vírus HIV).<ref name=emed/> |
|||
=== Complicações === |
|||
===Complicações=== |
|||
A [[Cardiopatia chagásica crônica]] (CCC), é uma das principais complicações na doença de Chagas. Trata-se de uma inflamação e destruição progressiva do tecido cardíaco, levando a alterações da condução dos impulsos elétricos no coração e [[arritmia]]s. Paralelamente, ocorre um progressivo afinamento do músculo cardíaco, levando à dilatação das cavidades do coração, tendo como conseqüência a incapacidade de bombear adequadamente o sangue para o organismo, um quadro chamado de [[insuficiência cardíaca]] congestiva. Dessa forma, a CCC freqüentemente tem um curso fatal, uma vez que o tratamento é apenas sintomático e a possibilidade de realização de [[transplante de coração|transplantes cardíacos]] é bem menor que a demanda. Em 1999 existiam cerca de 2 milhões de pacientes acometidos de CCC no Brasil. A CCC é a indicação mais |
|||
No estado crônico, o tratamento envolve o controle das manifestações clínicas da doença. Por exemplo, [[marcapasso]]s e medicamentos para [[arritmia]]s (ritmo irregular dos batimentos cardíacos), como a [[amiodarona]], podem ser muito benéficos para alguns pacientes com acometimento cardíaco crônico,<ref>{{citar periódico |autor=Dubner, S.; Schapachnik, E.; Riera, A.R.; Valero, E. |título=Chagas disease: state-of-the-art of diagnosis and management |periódico=Cardiology Journal |volume=15 |número=6 |páginas=493–504 |ano=2008 |pmid=19039752}}</ref> enquanto a cirurgia pode ser necessária no megacólon. Apesar disso, a doença não tem cura nessa fase. A doença crônica do coração causada pela doença de Chagas tem sido, hoje, uma indicação comum de [[transplante cardíaco]]. Até recentemente, contudo, a doença de Chagas era considerada uma contraindicação para esse procedimento, pois acreditava-se que o parasita poderia se aproveitar da [[imunossupressão]] após a cirurgia para retomar o acometimento do coração.<ref>{{citar periódico |autor=Bocchi, E.A.; Bellotti, G.; Mocelin, A.O. |título=Heart transplantation for chronic Chagas' heart disease |periódico=The Annals of Thoracic Surgery |volume=61 |número=6 |páginas=1727–33 |ano=1996 |pmid=8651775 |doi=10.1016/0003-4975(96)00141-5}}</ref> |
|||
comum para o implante de [[marca-passos]] cardíacos artificiais em nosso país. Nos pacientes com insuficiência cardíaca refratária, o único caminho é o transplante cardíaco, um procedimento dispendioso e inacessível a boa parte da população brasileira.<ref name=bio/> Estudos com animais experimentalmente infectados indicaram que o tratamento com drogas anti-T. cruzi não parece evitar a progressão da cardiopatia. <ref> Teixeira, A.R.L. et al. J. Infect. Dis. 162:1420, 199</ref> |
|||
Notou-se que as taxas de sobrevida em pacientes com Chagas poderiam aumentar significativamente com a administração de doses menores de drogas imunossupressoras, como a [[ciclosporina]]. Recentemente, tem sido demonstrado que o tratamento direto do músculo cardíaco com [[célula-tronco|células-tronco]] através do [[transplante de medula óssea|transplante de células da medula óssea]] reduz dramaticamente os riscos de insuficiência cardíaca em pacientes com doença de Chagas.<ref>{{citar periódico |autor=Vilas-Boas, F.; Feitosa, G.S.; Soares, M.B. |título=Resultados iniciais do transplante de células de medula óssea para o miocárdio de pacientes com insuficiência cardíaca de etiologia chagásica |periódico=Arquivos Brasileiros de Cardiologia |volume=87 |número=2 |páginas=159–66 |ano=2006 |pmid=16951834 |doi=10.1590/S0066-782X2006001500014}}</ref> |
|||
Cerca de 5% a 8% dos infectados desenvolvem alterações no tubo digestivo (os chamados megaesôfago e megacólon, aparentemente por destruição dos neurônios que controlam sua [[motilidade]], esses problemas digestivos dificilmente levam ao óbito. Felizmente o coeficiente de mortalidade |
|||
específica para doença de Chagas caiu de 5,2/100.000 habitantes, em 1980, para 3,5/100.000 em 1997, e segue em queda a cada ano. <ref name=Vinhaes>http://www.scielo.br/pdf/%0D/csp/v16s2/3480.pdf</ref> |
|||
==Epidemiologia== |
|||
=== Tratamentos experimentais === |
|||
[[Imagem:Distribution of Chagas' disease.svg|thumb|[[endemia|Zonas endêmicas]] da doença de Chagas na América Latina.]] |
|||
A doença de Chagas afeta de 8 a 10 milhões de pessoas vivendo em países endêmicos da América Latina, com um adicional de {{fmtn|300000}}–{{fmtn|400000}} vivendo em países não endêmicos, como Espanha e Estados Unidos. Estima-se que anualmente ocorrem {{fmtn|41200}} novos casos em países endêmicos e que {{fmtn|14400}} crianças nascem com Chagas congênito todos os anos.<ref name=Rassi2010/><ref name=emed/> Em 2010, a doença resultou em aproximadamente {{fmtn|10300}} mortes em comparação com {{fmtn|9300}} em 1990.<ref name=Loz2012>{{citar periódico |autor=Lozano, R. ''et al.''|título=Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 |periódico=Lancet |ano=2012 |volume=380 |número=9859 |páginas=2095–128 |pmid=23245604 |doi=10.1016/S0140-6736(12)61728-0}}</ref> Estima-se que a taxa de mortalidade anual seja em torno de {{fmtn|14000}}.<ref>{{citar periódico |autor=World Health Organization |ano=2010 |título=Chagas’disease(American trypanosomiasis) factsheet |periódico=The Weekly Epidemiological Record |volume=34 |páginas= |
|||
334–336}}</ref> No Brasil, estimativas recentes apontam que {{fmtn|2000000}}–{{fmtn|3000000}} de pessoas estejam infectadas, e que ocorram cerca de {{fmtn|6000}} mortes anualmente.<ref>{{citar periódico |autor=Martins-Melo, F.R.; Ramos Jr., A.N.; Alencar, C.H.; Lange, W.; Heukelbach, J. |ano=2012d |título=Mortality of Chagas’disease in Brazil: spatial patterns and definition of high-risk areas |periódico=Tropical Medicine & International Health |volume=17 |número=9 |páginas=1066–1075 |doi=10.1111/j.1365-3156.2012.03043.x}}</ref> |
|||
A doença está presente em 18 países do continente americano, estendendo-se do sul dos Estados Unidos até o norte da [[Argentina]].<ref name="CDC"/> Chagas existe em duas zonas ecológicas diferentes. Na região do [[Cone Sul]], o principal vetor vive no interior ou nos arredores das habitações humanas. Na América Central e no México, as principais espécies vetoras vivem tanto no interior das casas como em áreas desabitadas. Em ambas as zonas, a doença de Chagas ocorre quase exclusivamente em áreas rurais, onde os triatomíneos procriam e se alimentam das mais de 150 espécies de 24 famílias de mamíferos domésticos e selvagens, bem como de humanos, que servem de [[reservatório natural|reservatórios naturais]] do ''T. cruzi''.<ref name=NatRev>{{citar periódico |autor=Morel, C.M.; Lazdins, J. |título=Chagas disease |periódico=Nature Reviews Microbiology |volume=1 |número=1 |páginas=14–15 |ano=2003 |pmid=15040175 |doi=10.1038/nrmicro735}}</ref> |
|||
== Epidemiologia == |
|||
[[Ficheiro:Distribution tika? of Chagas' disease.svg|direita|thumb|Mapa da incidência da doença de Chagas]] |
|||
[[Ficheiro:Chagas disease world map - DALY - WHO2004.svg|thumb|Segundo a OMS, 90 milhões de pessoas estão expostas ao risco de contaminação. <ref name=bio>http://biotechnology.com.br/revista/bio09/bio_9.pdf#page=20</ref> A Bolívia é o país que mais sofre com a doença.]] |
|||
Embora os triatomíneos também se alimentem do sangue de pássaros, estes parecem ser imunes à infecção e não são considerados reservatórios do ''T. cruzi''. Mesmo quando colônias de insetos são erradicadas de uma casa ou de abrigos de animais nas redondezas, eles podem re-emergir de plantas ou animais que fizeram parte do ciclo [[silvático]] (referente a animais selvagens) do parasita. Esse fenômeno é especialmente provável em zonas com vegetações abertas misturadas a agrupamentos de árvores e interpostas por habitações humanas.<ref>{{cite conference |author=Pinto-Dias, J.C. |year=1992 |title=Epidemiology of Chagas disease |conference=ISBT Brazil '92. XXII Congress of the International Society of Blood Transfusion. XX Brazilian Congress of Hematology. Extraordinary Congress of the Brazilian College of Hematology |booktitle=Chagas Disease – American Trypanosomiasis: its impact on transfusion and clinical medicine |editor=Wendel S, Brener Z, Camargo ME, Rassi A (eds.) |publisher=Editorial ISBT Brazil |location=São Paulo |url=http://www.dbbm.fiocruz.br/tropical/chagas/chapter4.html |accessdate=11 September 2008}} |
|||
A doença de Chagas afeta 8 a 10 milhões de pessoas que vivem nos países latino-americanos [[Endemia|endêmicos]], e uma quantidade adicional de 300 a 400 mil indivíduos em países não endêmicos, como a [[Espanha]] e os [[Estados Unidos]]. Estima-se que 41.200 casos novos ocorram anualmente nos países endêmicos e que 14.400 crianças nasçam por ano com a doença de Chagas congênita. Cerca de 20.000 mortes são atribuídas à doença de Chagas a cada ano. |
|||
</ref> |
|||
A doença de Chagas crônica permanece um importante problema de saúde pública em muitos países da América Latina, apesar das medidas efetivas de higiene e prevenção, como a eliminação dos insetos transmissores. Entretanto, algumas conquistas foram alcançadas na luta contra a doença na América Latina, como a redução de 72% da incidência da infecção em crianças e adultos jovens nos países da Iniciativa do [[Cone Sul]] e pelo menos três países ([[Uruguai]], em 1997, [[Chile]], em 1999, e Brasil, em 2006) foram certificados como livres da transmissão vetorial e transfusional.<ref name=emed/><ref name= TDR1>{{cite press release |url=http://www.who.int/tdrold/publications/tdrnews/news65/chagas.htm |title=The Southern Cone Initiative: an update |work=Special Programme for Research and Training in Tropical Diseases (TDR) |publisher=WHO |year=2004 |accessdate=29 August 2008}} {{Dead link|date=May 2012|bot=BlevintronBot}}</ref><ref name="pmid18053273">{{citar periódico |autor=Massad, E. |título=The elimination of Chagas' disease from Brazil |periódico=Epidemiology and Infection |volume=136 |número=9 |páginas=1153–64 |ano=2008 |pmid=18053273 |doi=10.1017/S0950268807009879 |pmc=2870925}}</ref> Na Argentina, a transmissão vetorial foi interrompida em 13 das 19 províncias endêmicas e progressos significativos têm sido feitos nesse sentido no Paraguai e na Bolívia.<ref name= TDR1/> |
|||
A doença de Chagas crônica é um problema epidemiológico apenas em alguns países da [[América Latina]], mas a migração crescente de populações aumentou o risco de transmissão por transfusão de [[sangue]] até mesmo nos [[Estados Unidos]], e têm surgido casos da doença em animais silvestres até à [[Carolina do Norte]]. |
|||
O monitoramento para ''T. cruzi'' do sangue doado e dos doadores de componentes sanguíneos e de órgãos sólidos, assim como dos doadores de células, tecidos e produtos de células e tecidos, é mandatório nos países endêmicos de Chagas e tem sido implementado.<ref>{{citar periódico |autor=Castro, E. |título=Chagas' disease: lessons from routine donation testing |periódico=Transfusion Medicine |volume=19 |número=1 |páginas=16–23 |ano=2009 |pmid=19302451 |doi=10.1111/j.1365-3148.2009.00915.x}}</ref> Há, aproximadamente, {{fmtn|300000}} pessoas infectadas vivendo nos Estados Unidos, o que é provavelmente resultado da imigração de países latino-americanos.<ref>{{citar web |publicado=National Institutes of Health |url= http://www.nlm.nih.gov/medlineplus/ency/article/001372.htm |título=Medical Encyclopedia: Chagas disease |acessodata=11 de setembro de 2008}}</ref> Com o aumento dos movimentos populacionais, a possibilidade de transmissão por transfusão de sangue se tornou mais substancial nos Estados Unidos. A transfusão de sangue e produtos de tecidos é ativamente monitorada nos Estados Unidos, diminuindo, portanto, o risco.<ref>{{citar periódico |autor=Kirchhoff, L.V. |título=American trypanosomiasis (Chagas' disease) – a tropical disease now in the United States |periódico=The New England Journal of Medicine |volume=329 |número=9 |páginas=639–44 |ano=1993 |pmid=8341339 |doi=10.1056/NEJM199308263290909}}</ref> |
|||
Distribuída pelas [[Américas]] desde os [[Estados Unidos]] até a [[Argentina]], atinge principalmente as populações rurais pobres. As casas pobres, com reboco defeituoso e sem forro, são ''[[habitat]]'' para o inseto barbeiro, que dorme de dia nas rachaduras das paredes e sai à noite para sugar o sangue da pessoas que dormem, geralmente no rosto ou onde a pele é mais fina. Os casos nos [[Estados Unidos]] de origem endémica (e não em imigrantes) são raríssimos, devido ao maior afastamento das casas dos animais e do menor número de locais dentro das casas onde os insectos possam se reproduzir. |
|||
==Histórico== |
|||
A doença afecta muitos outros [[vertebrado]]s além do Homem: [[cão|cães]], [[gato]]s, [[roedor]]es, [[tatu]]s, e [[gambá]]s podem ser infectados e servir de reservatório do parasita. |
|||
[[Imagem:Carlos chagas 2.jpg|thumb|[[Carlos Chagas]], em seu laboratório no [[Instituto Oswaldo Cruz]].]] |
|||
A enfermidade foi nomeada em homenagem ao médico e epidemiologista brasileiro [[Carlos Chagas]], que foi o primeiro a descrevê-la em 1909,<ref name=Chagas1909a>{{citar periódico |autor=Chagas, C. |título=Neue Trypanosomen |periódico=Vorläufige Mitteilung Arch. Schiff. Tropenhyg. |ano=1909 |volume=13 |páginas=120–122}}</ref><ref name=Redhead_2006>{{citar periódico |autor=Redhead, S.A.; Cushion, M.T.; Frenkel, J.K.; Stringer, J.R. |título=''Pneumocystis'' and ''Trypanosoma cruzi'': nomenclature and typifications |periódico=Journal of Eukaryotic Microbiology |ano=2006 |páginas=2–11 |volume=53 |número=1 |pmid=16441572 |doi=10.1111/j.1550-7408.2005.00072.x}}</ref><ref name=Chagas1909b>{{citar periódico |autor=Chagas, C. |título=Nova tripanozomiase humana: Estudos sobre a morfolojia e o ciclo evolutivo do ''Schizotrypanum cruzi'' n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [New human trypanosomiasis. Studies about the morphology and life-cycle of ''Schizotripanum cruzi'', etiological agent of a new morbid entity of man] |periódico=Mem Inst Oswaldo Cruz |ano=1909 |volume=1 |número=2 |páginas=159–218 |issn=0074-0276 |doi=10.1590/S0074-02761909000200008}}</ref><ref>{{citar periódico |periódico=História, Ciências Saúde-Manguinhos |volume=16 |número=Suppl 1 |páginas=13–34 |título=The discovery of ''Trypanosoma cruzi'' and Chagas disease (1908–1909): tropical medicine in Brazil |autor=Kropf, S.P.; Sá, M.R. |pmid=20027916}}</ref> mas a doença não foi vista como um problema maior de [[saúde pública]] até a década de 1960 (a epidemia da doença de Chagas no Brasil na década de 1920 foi amplamente ignorada<ref>{{citar periódico |autor=Coutinho, M. |título=Review of ''Historical Aspects of American Trypanosomiasis (Chagas' Disease)'' by Matthias Perleth |periódico=Isis |volume=90 |número=2 |mês=junho |ano=1999 |páginas=397 |doi=10.1086/384393 |jstor=237120}}</ref>). Chagas descobriu que o intestino dos Triatomidae (atualmente [[Reduviidae]]: [[Triatominae]]) abrigava um protozoário flagelado, uma nova espécie do gênero ''[[Trypanosoma]]'', e foi capaz de provar experimentalmente que poderia ser transmitida a saguis do gênero ''[[Callithrix]]'' que haviam sido picados pelo inseto infectado. Estudos posteriores demonstraram que o [[macaco-de-cheiro]] (do gênero ''[[Saimiri]]'') também era vulnerável a infecção.<ref name=Hulsebos_1989>{{citar periódico |autor=Hulsebos, L.H.; Choromanski, L.; Kuhn, R.E. |título=The effect of interleukin-2 on parasitemia and myocarditis in experimental Chagas' disease |periódico=Journal of Protozoology |volume=36 |número=3 |páginas=293–8 |ano=1989 |pmid=2499678}}</ref> |
|||
== História == |
|||
A história da descoberta da doença de chagas tem início em [[1902]], quando o jovem estudante da Faculdade de Medicina do Rio de Janeiro, [[Carlos Chagas]], foi interpelado por Miguel Couto a frequentar o órgão de pesquisa ''Instituto Soroterápico'', criado em [[1900]] pelo Barão de Pedro Afonso<ref name="EFN">NEVES, BRENER, Zigman. A descoberta (Homenagem aos 80 anos da descoberta da Doença de Chagas). Memórias do Instituto Oswaldo Cruz, Rio de Janeiro, v.84, p.1-6, nov. 1989.</ref>. |
|||
Carlos Chagas descreveu o parasita patogênico como ''Trypanosoma cruzi'' em 1909,<ref name=Chagas1909a/> em homenagem a [[Oswaldo Cruz]], médico e epidemiologista brasileiro que combateu com sucesso epidemias de [[febre amarela]], [[varíola]] e [[peste bubônica]] no Rio de Janeiro e outras cidades no começo do século XX. No mesmo ano recombinou o [[nome científico]] do parasita para ''Schizotrypanum cruzi'', após reconhecer particularidades biológicas no ciclo reprodutivo que o diferenciava dos demais parasitas do gênero ''Trypanosoma''.<ref name=Chagas1909b/> Em 1912, Delanoë e Delanoë descrevem o parasita ''[[Pneumocystis carinii]]'', demonstrando que as particularidades do ciclo reprodutivo observadas por Chagas eram na verdade de um outro parasita, fazendo com que Chagas retomasse o uso de ''Trypanosoma cruzi''.<ref>{{citar periódico |autor=Delanoë, P.; Delanoë, M. |ano=1912 |título=Sur les rapports des kystes de Carini du poumon des rats avec le ''Trypanosoma lewisi'' |periódico=Comptes rendus de l'Academie des sciences |volume=155 |páginas=658–661}}</ref><ref>{{citar periódico |autor=Chagas, C. |ano=1913 |título=Revisão do cyclo evolutivo do “''Trypanosoma Cruzi''” |periódico=Brazil-Médico |volume=27 |páginas=225}}</ref> |
|||
No ano de [[1907]], Carlos Chagas, solicitado agora por Oswaldo Cruz, segue para Estrada de Ferro Central do Brasil, em um pequeno vilarejo chamado Lassance, localizado ao norte de Minas Gerais, para controlar o surto de malária entre operários. Em [[1903]], escolhera "These Inaugural", com o tema "Estudos hematológicos no impaludismo" e uma monografia, em [[1906]], "Prophylaxia do Impaludismo", em que já alertava a "destruição domiciliária dos culicídios alados" como medida para controlar a malária. |
|||
Na Argentina, a doença é conhecida como ''mal de Chagas-Mazza'', em homenagem ao médico argentino [[Salvador Mazza]], que em 1926 começou a investigar a enfermidade e que nos anos seguintes tornou-se o principal pesquisador da doença naquele país.<ref>{{citar web |url=http://www.drwebsa.com.ar/alcha/hist4.htm |publicado=Asociación Lucha Contra el Mal de Chagas |título=Enfermedad de Chagas – Mazza |língua=Espanhol |accessodata=15 de setembro de 2011}}</ref> |
|||
Descoberta em [[1909]] pelo médico brasileiro [[Carlos Chagas]] , a doença não foi vista como problema até à década de '60. Estudos desenvolvidos pelo [[Instituto Oswaldo Cruz]] no município de [[Bambuí]], [[Minas Gerais]], possibilitaram dimensionar a moléstia como problema de saúde pública. O nome de ''Tripanossoma cruzi'' ao agente causador foi dado por Chagas em homenagem ao [[epidemia|epidemiologista]] [[Oswaldo Cruz]]. |
|||
Existe a hipótese de que [[Charles Darwin]] possa ter sofrido de doença de Chagas, como resultado de uma picada do chamado "grande besouro preto dos Pampas" (''vinchuca''). O episódio foi relatado por ele em seu diário da [[viagem do Beagle]] como tendo ocorrido em março de 1835, a leste dos Andes, próximo a [[Mendoza (Argentina)|Mendoza]]. Darwin era jovem e gozava de boa saúde, embora seis meses depois ele adoeceu por quase um mês perto de [[Valparaíso (Chile)|Valparaíso]], mas em 1837, quase um ano depois de ter regressado a Inglaterra, começou a sofrer de um estranho grupo de sintomas, tornando-se incapacitado na maior parte do resto de sua vida. As tentativas de testar os restos mortais de Darwin na [[Abadia de Westminster]] usando técnicas modernas de PCR foram negadas pelo curador.<ref>{{citar periódico |autor=Adler, D. |título=Darwin's Illness |periódico=Israel Journal of Medical Science |volume=25 |número=4 |páginas=218–21 |ano=1989 |pmid=2496051}}</ref> |
|||
Na [[Argentina]], a doença é chamada oficialmente ''Mal de Chagas-Mazza'', em homenagem ao médico argentino [[Salvador Mazza]], que em [[1926]] começou a estudar a enfermidade e com os anos transformou-se no principal estudioso da doença naquele país. |
|||
==Pesquisa== |
|||
Uma passagem do diário de [[Charles Darwin]] levou à suposição de que ele sofresse da doença de Chagas, em consequência da picada de um inseto, e esta seria a causa do declínio de sua saúde depois da viagem no Beagle. Testes feitos com técnicas [[PCR]] em seus restos mortais não foram conclusivos. |
|||
Vários tratamentos experimentais mostraram-se promissores em animais modelos. Estes incluem inibidores da [[ciclase]] de [[2,3-oxidosqualeno|oxidosqualeno]] e [[squaleno sintase]],<ref name=Grupo>Scientific Working Group on Chagas Disease [April 2005] (July 2007). Guhl F, Lazdins-Helds JK (eds.): [http://www.who.int/tdr/publications/publications/pdf/swg_chagas.pdf ''Reporte del grupo de trabajo científico sobre la enfermedad de Chagas''] {{Wayback|date=20081217000134|url=http://www.who.int/tdr/publications/publications/pdf/swg_chagas.pdf|df=yes}} (in Spanish). Geneva: WHO. Retrieved on 29 August 2008. [http://www.who.int/tdr/diseases/chagas/swg_chagas.pdfExecutive summary in English]</ref><ref>{{citar periódico |autor=Urbina, J.A.; Concepcion, J.L.; Rangel, S.; Visbal, G.; Lira, R. |título=Squalene synthase as a chemotherapeutic target in ''Trypanosoma cruzi'' and ''Leishmania mexicana'' |periódico=Mol Biochem Parasitol |volume=125 |número=1–2 |páginas=35–45 |ano=2002 |pmid=12467972 |doi= 10.1016/S0166-6851(02)00206-2|url=http://linkinghub.elsevier.com/retrieve/pii/S0166685102002062}}</ref> inibidores da [[cisteína protease]],<ref name=Grupo/><ref>{{citar periódico |autor=Engel, J.C.; Doyle, P.S.; Hsieh, I.; McKerrow, J.H. |título=Cysteine Protease Inhibitors Cure an Experimental Trypanosoma cruzi Infection |periódico=The Journal of Experimental Medicine |volume=188 |número=4 |páginas=725–34 |ano=1998 |pmid=9705954 |pmc=2213346|doi= 10.1084/jem.188.4.725}}</ref> [[dermaseptina]]s coletadas de sapos do gênero ''[[Phyllomedusa]]'' (''[[Phyllomedusa oreades|P. oreades]]'' e ''[[Phyllomedusa distincta|P. distincta]]''),<ref>{{citar periódico |autor=Brand, G.D.; Leite, J.R.; Silva, L.P. |título=Dermaseptins from ''Phyllomedusa oreades'' and ''Phyllomedusa distincta''. Anti-''Trypanosoma cruzi'' activity without cytotoxicity to mammalian cells |periódico=Journal of Biological Chemistry |volume=277 |número=51 |páginas=49332–40 |ano=2002 |pmid=12379643 |doi=10.1074/jbc.M209289200}}</ref> a [[lactona sesquiterpênica]] [[dehidroleucodina]] (DhL), que afeta o crescimento de ''Trypanosoma cruzi'' na fase epimastigota em meio de cultura,<ref>{{citar periódico |autor=Brengio, S.D.; Belmonte, S.A.; Guerreiro, E.; Giordano, O.S.; Pietrobon, E.O.; Sosa, M.A. |título=The sesquiterpene lactone dehydroleucodine (DhL) affects the growth of cultured epimastigotes of ''Trypanosoma cruzi'' |periódico=J Parasitol |volume=86 |número=2 |páginas=407–12 |ano=2000 |pmid=10780563 |doi=10.1645/0022-3395(2000)086[0407:TSLDDA]2.0.CO;2 |issn=0022-3395}}</ref> inibidores da captação de [[purina]],<ref name=Grupo/> e inibidores de enzimas envolvidas no metabolismo da [[trypanotiona]].<ref>{{citar periódico |autor=Fairlamb, A.H.; Cerami, A. |título=Metabolism and functions of trypanothione in the Kinetoplastida |periódico=Annual Reviews Microbiology |volume=46 |páginas=695–729 |ano=1992 |pmid=1444271 |doi=10.1146/annurev.mi.46.100192.003403}}</ref> Novas drogas podem ser pesquisadas com o prosseguimento da sequenciamento do genoma do ''T. cruzi''.<ref name=ElSayed2005>{{citar periódico |autor=El-Sayed, N.M.; Myler, P.J.; Bartholomeu, D.C. |título=The genome sequence of ''Trypanosoma cruzi'', etiologic agent of Chagas disease |periódico=Science |volume=309 |número=5733 |páginas=409–15 |ano=2005 |pmid=16020725 |doi=10.1126/science.1112631 |bibcode=2005Sci...309..409E}}</ref> |
|||
Um estudo ''[[in vitro]]'' de 2004 sugeriu que componentes do [[chá verde]] ([[catequina]]s) podem ser efetivos contra o ''T. cruzi''.<ref>{{citar periódico |título=Anti-''Trypanosoma cruzi'' Activity of Green Tea (''Camellia sinensis'') Catechins |periódico=Antimicrobial Agents and Chemotherapy |doi=10.1128/AAC.48.1.69-74.2004 |volume=48|páginas=69–74 |autor=Paveto, C.; Güida, M.C.; Esteva, M.I.; Martino, V.; Coussio, J.; Flawiá, M.M.; Torres, H.N. |ano=2004 |número=1 |pmid=14693520 |pmc=310206}}</ref> |
|||
Pesquisadores em 2013 da Universidade de Vanderbilt divulgaram um estudo intitulado "[[VNI (biomolécula)|VNI]] Cures Acute and Chronic Experimental Chagas Disease." No estudo, foi administrado essa bio-molécula a ratos por 30 dias com índices de cura de 100% e 100% de sobrevivência. A droga foi descrita como atóxica e altamente seletiva. Seu mecanismo de ação é através da inibição da esterol 14α-dimetilase no ''T. cruzi''.<ref>{{citar periódico |autor=Villalta, F.; Dobish, M.C.; Nde, P.N.; Kleshchenko, Y.Y.; Hargrove, T.Y.; Johnson, C.A.; Waterman, M.R.; Johnston, J.N.; Lepesheva, G.I. |título=VNI cures acute and chronic experimental Chagas disease |periódico=The Journal of infectious diseases |ano=2013 |volume=208 |número=3 |páginas=504–11 |pmid=23372180 |doi=10.1093/infdis/jit042 |pmc=3698996}}</ref> |
|||
Um dos centros de excelência da pesquisa médica em doença de Chagas é a [[Universidade de São Paulo|Faculdade de Medicina da USP em Ribeirão Preto]], onde nos [[década de 1950|anos 50]] o Dr. [[Fritz Köberle]] demonstrou que os [[amastigoto]]s destroem os neurônios do [[sistema nervoso autônomo]] no intestino e no coração. |
|||
A doença de Chagas têm um sério impacto econômico no mundo. O custo do tratamento nos Estados Unidos é estimado em $900 milhões anualmente, que inclui hospitalização e dispositivos médicos como marca-passos. O custo global é estimado em $7 bilhões.<ref>{{citar periódico |autor=Schmuñis, G. |título=Status of and cost of Chagas disease worldwide |periódico=The Lancet infectious diseases |ano=2013 |volume=13 |número=4 |páginas=283–4 |pmid=23395247 |doi=10.1016/S1473-3099(13)70032-X}}</ref> |
|||
[[Ficheiro:Carlos chagas 2.jpg|thumb|[[Carlos Chagas]], em seu laboratório no [[Instituto Oswaldo Cruz]].]] |
|||
Apesar de ser a principal enfermidade parasitária do Ocidente, a doença de Chagas é considerada uma das [[doenças negligenciadas]]. Embora seja prevenível e potencialmente erradicável, recursos insuficientes têm sido destinados à pesquisa e desenvolvimento de inovações diagnósticas e terapêuticas para Chagas.<ref name=Feasey>{{citar periódico |autor=Feasey, N.; Wansbrough-Jones, M.; Mabey, D.C.W.; Solomon, A.W. |título=Neglected Tropical Diseases |periódico=British Medical Bulletin |ano=2009 |volume=93 |número=1 |páginas=179 |doi=10.1093/bmb/ldp046}}</ref> Em resposta a essa crise, organizações do terceiro setor, como a [[Drugs for Neglected Diseases initiative]], em colaboração com universidades e instituições públicas de biotecnologia, têm buscado o desenvolvimento de novos fármacos e vacinas para o controle da doença de Chagas.<ref>{{citar periódico |autor=Hotez, P.J.; Dumonteil, E.; Woc-Colburn, L.; Serpa, J.A.; Bezek, S. ''et al''. |ano=2012 |título=Chagas disease: 'The new HIV/AIDS of the Americas' |periódico=PLoS Neglected Tropical Diseases |volume=6 |número=5 |páginas=e1498 |doi=10.1371/journal.pntd.0001498 |pmid=22666504 |pmc=3362306}}</ref>{{Referências|col=2}} |
|||
A doença foi nomeada em homenagem ao cientista brasileiro e [[infectologista]] [[Carlos Chagas]], que foi o primeiro a descrevê-la em 1909,<ref name=Chagas_1909>{{cite journal |author=Chagas C | title=Neue Trypanosomen |journal=Vorläufige Mitteilung Arch Schiff Tropenhyg |year=1909 |volume=13 |pages = 120–2 }}</ref><ref name=Redhead_2006>{{cite journal |author=Redhead SA, Cushion MT, Frenkel JK, Stringer JR |title=''Pneumocystis'' and ''Trypanosoma cruzi'': nomenclature and typifications |journal=J Eukaryot Microbiol |year=2006 |pages=2–11 |volume=53 |issue=1 |pmid=16441572 |doi=10.1111/j.1550-7408.2005.00072.x}}</ref><ref name=Chagas_1909b>{{cite journal |author=Chagas C |title=Nova tripanozomiase humana: Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [New human trypanosomiasis. Studies about the morphology and life-cycle of ''Schizotripanum cruzi'', etiological agent of a new morbid entity of man] |journal=Mem Inst Oswaldo Cruz |year=1909 |volume=1 |issue=2 |pages=159–218 |issn=0074-0276 |doi=10.1590/S0074-02761909000200008 |format=PDF}} (in Portuguese with German full translation as "Ueber eine neue Trypanosomiasis des Menschen.")</ref><ref>{{cite journal |journal=Hist Cienc Saude Manguinhos |date=2009 Jul |volume=16 |issue=Suppl 1 |pages=13–34 |title=The discovery of Trypanosoma cruzi and Chagas disease (1908–1909): tropical medicine in Brazil |author=Kropf SP, Sá MR |pmid=20027916}}</ref> mas a enfermidade não foi vista como um problema maior de [[saúde pública]] até a década de 1960 (a epidemia da doença de Chagas no Brasil na década de 1920 foi amplamente ignorada<ref>{{cite journal |format=fee required |author=Coutinho M |title=Review of ''Historical Aspects of American Trypanosomiasis (Chagas' Disease)'' by Matthias Perleth |journal=Isis |volume=90 |issue=2 |month=June |year=1999 |pages=397 |doi=10.1086/384393 |jstor=237120}}</ref>). Chagas descobriu que o intertino da Triatomidae (atualmente [[Reduviidae]]: [[Triatominae]]) abrigava um protozoário flagelado, uma nova espécie do gênero ''[[Trypanosoma]]'', e foi capaz de provar experimentalmente que poderia ser transmitida a saguis do gênero [[Callithrix]] que haviam sido mordidos pelo inseto infectado. Estudos posteriores mostraram que o [[macaco-esquilo]] também era vulnerável a infecção.<ref name=Hulsebos_1989>{{cite journal |author=Hulsebos LH, Choromanski L, Kuhn RE |title=The effect of interleukin-2 on parasitemia and myocarditis in experimental Chagas' disease |journal=J Protozool |volume=36 |issue=3 |pages=293–8 |year=1989 |pmid=2499678}}</ref> |
|||
== Leitura adicional == |
|||
Chagas nomeou o parasita [[patogênico]] como ''Trypanosoma cruzi''<ref name=Chagas_1909 /> e posteriormente no mesmo ano como ''Schizotrypanum cruzi'',<ref name=Chagas_1909b /> ambos homenageando o [[epidemiologista]] [[Oswaldo Cruz]], que havia combatido com sucesso as epidemias de [[febre amarela]], [[varíola]] e [[peste bubônica]] na cidade do [[Rio de Janeiro (cidade)|Rio de Janeiro]] e outras cidades no início do século XX. O trabalho de Chagas permanece único na [[história da medicina]] por ter sido o único pesquisador a descrever por completo uma nova [[doença infecciosa]], seu [[patógeno]], [[vetor (epidemiologia)|vetor]], [[hospedeiro]], manifestações clínicas e epidemiologia. |
|||
{{Referências|col=2}} |
|||
== Bibliografia == |
|||
* [http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0037-86822003000500011&tlng=es&lng=en&nrm=iso Autochthonous Chagas' disease in Santa Catarina State, Brazil: report of the first case of digestive tract involvement] |
|||
* [http://www.vertentes.com.br/chagas/ Doença de Chagas: 90 anos da descoberta] |
|||
== Leituras == |
|||
* Brener, Z., Andrade, Z. e M Barral-Neto (eds.). '''Trypanosoma cruzi''' e doença de Chagas'', 2.ª edição. Rio de Janeiro: Guanabara Koogan Ed., 2000. |
* Brener, Z., Andrade, Z. e M Barral-Neto (eds.). '''Trypanosoma cruzi''' e doença de Chagas'', 2.ª edição. Rio de Janeiro: Guanabara Koogan Ed., 2000. |
||
* Dias, J.C.P. & Coura, J.R. (eds.). ''Clínica e Terapêutica da Doença de Chagas: um manual para o clínico geral''. Rio de Janeiro: Editora Fiocruz, 1997. |
* Dias, J.C.P. & Coura, J.R. (eds.). ''Clínica e Terapêutica da Doença de Chagas: um manual para o clínico geral''. Rio de Janeiro: Editora Fiocruz, 1997. |
||
* Gontijo, E.D. e Rocha, M.°C. (eds.).''Manejo clínico em doença de Chagas''. Brasília: Fundação Nacional de Saúde, Ministério da Saúde, 1998. |
* Gontijo, E.D. e Rocha, M.°C. (eds.).''Manejo clínico em doença de Chagas''. Brasília: Fundação Nacional de Saúde, Ministério da Saúde, 1998. |
||
* Storino, R. & Milei, J. (eds.).''Enfermedad de Chagas''. Buenos Aires: Doyma Argentina, 1994. |
* Storino, R. & Milei, J. (eds.).''Enfermedad de Chagas''. Buenos Aires: Doyma Argentina, 1994. |
||
* [http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0037-86822003000500011&tlng=es&lng=en&nrm=iso Autochthonous Chagas' disease in Santa Catarina State, Brazil: report of the first case of digestive tract involvement] |
|||
== Ligações externas == |
== Ligações externas == |
||
Revisão das 03h46min de 25 de junho de 2014
| Doença de Chagas | |
|---|---|
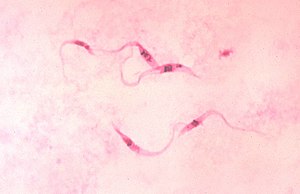
| Imagem microscópica do Trypanosoma cruzi, o agente infeccioso da Doença de Chagas | |
| Especialidade | infecciologia, parasitologia |
| Classificação e recursos externos | |
| CID-10 | B57 |
| CID-9 | 086 |
| CID-11 | 1365585570 |
| DiseasesDB | 13415 |
| MedlinePlus | 001372 |
| eMedicine | 214581 |
| MeSH | D014355 |
A doença de Chagas ou Mal de Chagas, também chamada tripanossomíase americana, é uma infecção causada pelo protozoário cinetoplástida flagelado Trypanosoma cruzi[1], e transmitida por insetos, conhecidos no Brasil como barbeiros, ou ainda, chupança, fincão, bicudo, chupão, procotó (da família dos Reduvídeos - Reduviidae), pertencentes aos gêneros Triatoma, Rhodnius e Panstrongylus. Trypanosoma cruzi é um membro do mesmo gênero do agente infeccioso africano da doença do sono e da mesma ordem que o agente infeccioso da leishmaniose, mas as suas manifestações clínicas, distribuição geográfica, ciclo de vida e de insetos vetores são bastante diferentes.
Os sintomas da doença de Chagas podem variar durante o curso da infecção. A fase aguda, que dura em torno de 4 a 16 semanas,geralmente é assintomática. Porém, quando surgem sintomas, estes podem variar de leves (febre baixa, adinamia,anorexia), moderados (linfoadenopatia, esplenomegalia, hepatomegalia) até graves ( meningite e miocardite). Após a total reversão do quadro clínico agudo, inicia-se uma fase totalmente assintomática. Na metade dos casos o indivíduo infectado com T. cruzi pode manter-se sem sintomas ao longo de toda a sua vida. Esta forma clínica é chamada de 'Indeterminada". A outra metade pode desenvolver cardiopatia, em vários graus, megaesôfago e ou megacólon. O aparecimento destas manifestações ocorrem após décadas da infecção aguda (10 a 40 anos). Esta forma clínica é denominada de forma crônica, e diferente da forma indeterminada, é responsável pela morbimortalidade da doença de Chagas. O tratamento etiológico, trypanossomicida, é indicado na fase aguda, quando a sua eficácia é inquestionável e pode-se obter cura definitiva. Já na fase crônica não há consenso quanto ao tratamento etiológico. O tratamento é focado no órgão acometido e pode ser clínico medicamentoso ou cirúrgico. Nesta fase o tratamento não visa a cura da doença de Chagas, mas sim a qualidade de vida, minimizando intercorrências e aumentando a sobrevida, em especial, dos portadores de cardiopatia chagásica crônica.
Sinais e sintomas


A doença apresenta dois estágios em seres humanos: uma fase aguda, que ocorre pouco tempo após a infecção, e uma fase crônica que se desenvolve ao longo de muitos anos.[2]
A fase aguda ocorre durante as primeiras semanas ou meses desde a infecção. Geralmente, ela não é notada por ser assintomática ou por exibir apenas sintomas moderados que não são únicos da doença de Chagas. Os sintomas podem incluir febre, fadiga, dor no corpo, dor de cabeça, exantema, perda de apetite, diarreia e vômitos. Os sinais no exame físico podem incluir aumento moderado do fígado, do baço e de linfonodos, e inchaço no local da picada do barbeiro (o chagoma).[3]
O marcador mais conhecido da fase aguda da doença de Chagas é chamado sinal de Romaña. O sinal é caracterizado pelo edema das pálpebras do mesmo lado do rosto em que se localiza a ferida produzida pela picada do barbeiro, onde as fezes foram depositadas pelo inseto ou mesmo quando acidentalmente esfregadas para dentro do olho. Raramente, crianças e adultos morrem durante a fase aguda da doença, porém pode ocorrer uma grave inflamação do músculo cardíaco (miocardite) ou do cérebro (meningoencefalite), que colocam a vida em risco.[2] A fase aguda também pode ser grave em pessoas com o sistema imunitário comprometido.[4]
Se houver o desenvolvimento de sintomas durante a fase aguda, eles geralmente se resolvem espontaneamente dentro de três a oito semanas em aproximadamente 90% dos indivíduos.[5][6] Embora os sintomas se resolvam, mesmo com o tratamento, a infecção persiste e entra em sua fase crônica. Dos indivíduos com doença de Chagas crônica, 60–80% jamais desenvolverão sintomas (chamada doença de Chagas crônica indeterminada), enquanto 20–40% desenvolverão sintomas cardíacos e/ou problemas digestivos (chamada doença de Chagas crônica determinada). Em 10% dos indivíduos, a doença progride diretamente da fase aguda para uma forma clínica sintomática da doença de Chagas.[5][6]
A doença crônica sintomática (determinada) afeta vários sistemas do organismo, como nervoso, digestório e cardíaco. Cerca de dois terços das pessoas com sintomas crônicos apresentam danos ao coração, incluindo a miocardiopatia dilatada, que causa anormalidades do ritmo cardíaco e pode resultar em morte súbita. Cerca de um terço dos pacientes apresenta danos ao sistema digestório, resultando em dilatação do trato digestivo (megacólon e megaesôfago), acompanhados de grave emagrecimento. A dificuldade de deglutição (secundária à acalásia) pode ser o primeiro sintoma dos distúrbios digestivos e pode levar à desnutrição.[7]
20% a 50% dos indivíduos com envolvimento intestinal também exibem acometimento cardíaco.[7] Mais de 10% das pessoas cronicamente infectadas desenvolvem neurite, que resulta em alterações sensoriais e dos reflexos tendinosos. Casos isolados exibem envolvimento do sistema nervoso central, incluindo demência, confusão, encefalopatia crônica e perdas sensoriais e motoras.[8]
As manifestações clínicas da doença de Chagas se devem à morte de células nos tecidos envolvidos no ciclo infeccioso do parasita, induzindo a respostas inflamatórias, lesões celulares e fibrose. Por exemplo, o amastigoto intracelular destrói os neurônios intramurais do sistema nervoso autônomo do intestino e do coração, levando ao megacólon e aos aneurismas cardíacos, respectivamente. Se não tratada, a doença de Chagas pode ser fatal, na maioria dos casos por danificação do tecido muscular cardíaco.[7]
Há uma considerável variação geográfica na ocorrência das complicações cardíacas e de dilatações gastrointestinais em pacientes com doença de Chagas crônica. Na maioria dos países da América do Sul, as dilatações são quase tão comuns quanto o comprometimento cardíaco. Mas na Colômbia, Venezuela, América Central e México as dilatações são praticamente desconhecidas. Não se sabe se fatores do hospedeiro ou diferenças nas cepas do parasita causariam estes diferentes padrões de expressão clínica da doença.[2]
Transmissão

Nas áreas endêmicas, o principal mecanismo de transmissão é o vetorial, ou seja, através de um inseto vetor da subfamília Triatominae.[4] O inseto infecta-se com T. cruzi ao alimentar-se de sangue de animais ou humanos contaminados. De hábitos noturnos, o inseto esconde-se durante o dia em fendas nas paredes e telhados. À noite ele emerge, quando os habitantes estão dormindo. Por causa da tendência de picar a face das pessoas, o inseto é popularmente conhecido como "barbeiro" ou "chupão". Após a picada e a ingestão de sangue, ele defeca próximo ao local. O prurido intenso no local da picada ajuda as formas infectantes de T. cruzi (denominadas de tripomastigotas), nas fezes, a penetrarem na ferida da picadura, mas elas também podem penetrar por mucosas intactas, como a conjuntival.[4]
Uma vez dentro do hospedeiro, o tripomastigota invade as células próximas à inoculação, onde diferenciam-se em amastigotas intracelulares. Os amastigotas multiplicam-se por divisão binária e diferenciam-se em tripomastigotas, que são liberados na corrente sanguínea, infectando células de tecidos variados, e este ciclo então é repetido diversas vezes. As manifestações clínicas são resultado deste ciclo infeccioso. Os tripomastigotas circulantes não se replicam (diferente da tripanossomíase africana). E a replicação só recomeça quando os parasitas entram em outras células ou são ingeridos por outro vetor.[4]
Como doença caracteristicamente rural, tradicionalmente acomete pessoas de origem interiorana que habitam ou habitaram casas de baixa qualidade, onde o vetor facilmente se aloja e coloniza.[3] Vegetação densa (como as das florestas tropicais) e habitats urbanos não são ideais para o estabelecimento do ciclo de transmissão humano. No entanto, em regiões onde o habitat silvestre e sua fauna são reduzidos pela exploração econômica e ocupação humana, como em áreas recém desmatadas, áreas de cultura da Leopoldinia piassaba, e algumas partes da região amazônica, um ciclo de transmissão humano pode desenvolver-se quando os insetos procuram por novas fontes de alimentação.[10]
T. cruzi pode também ser transmitido por transfusões de sangue. Com a exceção dos derivados sanguíneos (como anticorpos fracionados), todos os componentes do sangue são infecciosos. O parasita permanece viável a 4 °C por até no mínimo 18 dias ou mais de 250 dias quando mantido em temperatura ambiente. Não está claro se o T. cruzi pode ser transmitido por meio de componentes do sangue congelados e descongelados.[11]
Outros modos de transmissão incluem o transplante de órgãos, amamentação,[12] e por exposição laboratorial acidental. A doença de Chagas também pode ser passada congenitamente (de uma mulher grávida para seu filho) através da placenta, e é responsável por aproximadamente 13% das mortes em recém-nascidos em partes do Brasil.[13]
A transmissão oral é uma via pouco frequente de infecção, mas tem sido descrita. Em 1991, trabalhadores rurais no estado da Paraíba, Brasil, foram infectados ao ingerir comida contaminada; transmissão também foi documentada pela ingestão de suco de açaí e caldo de cana infectados.[14][15][16][17][18] Um surto em 2007 em 103 crianças numa escola na Venezuela foi atribuído a contaminação do suco de guava.[19]
A doença de Chagas é um problema emergente na Europa, por causa da grande maioria dos casos de infecção crônica serem assintomáticos e por causa de migrantes provenientes da América Latina.[20]
Diagnóstico
Na fase aguda, a presença do T. cruzi é diagnóstica para a doença de Chagas. Essa fase é caracterizada pela alta parasitemia, o que permite um diagnóstico parasitológico.[21] O parasita, em sua forma móvel (tripomastigota), pode ser detectado por exame microscópico direto no esfregaço de sangue fresco ou da camada leucocitária; ou pela preparação de esfregaços corados com Giemsa ou Leishman.[3] Microscopicamente, o T. cruzi pode ser confundido com o Trypanosoma rangeli, que não é patogênico para humanos.[22] O T. cruzi pode também ser isolado por cultura em meios específicos (por exemplo NNN, LIT), tanto na fase aguda como na crônica.[23][24]
A fase crônica da enfermidade é caracterizada pela baixa parasitemia e alto nível de anticorpos,[23] diminuindo a eficiência da identificação direta do parasita. Portanto, outros métodos são empregados durante esta fase, entre eles a hemoaglutinação indireta (IFA), imunoflurescência indireta (IIF), enzyme-linked immunosorbent assay (ELISA), quimioluminescência, TESA-blot, reação em cadeia da polimerase (PCR) e pelo xenodiagnóstico,[21] onde percevejos não infectados são alimentados com o sangue do paciente suspeito, e então seus intestinos são examinados para a detecção do parasita.[25]
Prevenção

Atualmente, ainda não existe uma vacina contra a doença de Chagas[26] e a prevenção é, em geral, focada em eliminar o inseto vetor com a utilização de sprays e tintas contendo inseticidas (piretroides sintéticos), e em melhorar as condições de saneamento e habitação nas áreas rurais.[27] Para os moradores de áreas urbanas que vão passar temporadas, como férias ou acampamentos, em regiões endêmicas, recomenda-se o uso de mosquiteiros. Algumas medidas de controle incluem:
- Uma armadilha contendo uma levedura pode ser utilizada para monitorar infestações de certas espécies de triatomíneos (Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata e Panstrongylus megistus).[28]
- Foram apresentados resultados promissores com o tratamento dos habitats de vetores com o fungo Beauveria bassiana.[29]
- Pode-se selecionar simbiontes do Triatominae através de paratransgênese.[30]
Inúmeras vacinas estão sendo testadas atualmente. A vacinação com o Trypanosoma rangeli tem produzido resultados positivos em modelos animais.[31] Mais recentemente, o potencial de vacinas com DNA para imunoterapia da doença de Chagas nas fases aguda e crônica tem sido testado por vários grupos de pesquisadores.[32]
Antigamente, a transfusão de sangue era o segundo modo mais comum de transmissão da doença de Chagas, mas, com o desenvolvimento e a implementação do controle dos bancos de sangue, houve uma redução dramática desse risco na última década. A doação de sangue em todos os países endêmicos da América Latina é submetida a uma pesquisa para Chagas. O teste está sendo expandido para outros países, como França, Espanha e Estados Unidos, que apresentam populações significativas ou em crescimento de imigrantes oriundos de áreas endêmicas.[33][34] Na Espanha, os doadores são avaliados com questionários para identificar indivíduos em risco de exposição à doença de Chagas para realizar a triagem.[34]
O Food and Drug Administration (FDA), órgão responsável pela aprovação de medicamentos nos EUA, aprovou dois testes para Chagas e publicou manuais que recomendam a triagem de qualquer sangue ou tecido doados.[34][35] Apesar de esses testes não serem obrigatórios nos EUA, estima-se que atualmente 75-90% das doações são testadas para Chagas, incluindo todas as unidades coletadas pela Cruz Vermelha Americana, o que corresponde a 40% de todo o suprimento sanguíneo do país.[35][36] O Chagas Biovigilance Network relata a incidência atual de produtos sanguíneos positivos para Chagas nos Estados Unidos, segundo o que é notificado pelos laboratórios utilizando os testes de rastreio aprovados pelo FDA em 2007.[37]
Tratamento
Na doença de Chagas, o tratamento é baseado em drogas antiparasitárias, para aniquilar o parasita, e no controle dos sinais e sintomas da infecção. O tratamento tem como objetivo reduzir a velocidade de acometimento do sistema nervoso parassimpático. Os distúrbios autonômicos provocados pela doença podem resultar, eventualmente, em megaesôfago, megacólon e miocardiopatia dilatada acelerada.[2]
Medicamentos
O tratamento antiparasitário é mais eficiente no início da infecção, mas não está limitado à fase aguda. As drogas de escolha incluem os derivados azóis e nitro, tais como o benznidazol[38] e o nifurtimox. Ambos os agentes são limitados na sua capacidade de atingir a cura parasitológica (uma eliminação completa do T. cruzi do organismo), especialmente em pacientes cronicamente infectados, e já foram relatados casos de resistência a essas drogas.[39]
Estudos sugerem que o tratamento antiparasitário leva à cura parasitológica em cerca de 60–85% dos adultos e em mais de 90% das crianças tratadas no primeiro ano desde a fase aguda da doença de Chagas. Crianças (idades entre seis e 12 anos) com a doença crônica apresentam uma taxa de cura de aproximadamente 60% com o benznidazol. Apesar de a taxa de cura diminuir com o tempo em que o adulto está infectado com a doença de Chagas, o tratamento com benznidazol tem se mostrado capaz de postergar o início do acometimento cardíaco em adultos com doença de Chagas crônica.[5][7]
O tratamento da infecção crônica em mulheres antes ou durante a gravidez não parece reduzir a probabilidade de a doença ser transmitida para o bebê. Da mesma forma, não está claro se o tratamento profilático da infecção crônica é benéfico em pessoas que serão submetidas à imunossupressão (por exemplo, em recipientes de transplantes de órgãos) ou em pessoas que já são imunossuprimidas (por exemplo, em pessoas infectadas pelo vírus HIV).[7]
Complicações
No estado crônico, o tratamento envolve o controle das manifestações clínicas da doença. Por exemplo, marcapassos e medicamentos para arritmias (ritmo irregular dos batimentos cardíacos), como a amiodarona, podem ser muito benéficos para alguns pacientes com acometimento cardíaco crônico,[40] enquanto a cirurgia pode ser necessária no megacólon. Apesar disso, a doença não tem cura nessa fase. A doença crônica do coração causada pela doença de Chagas tem sido, hoje, uma indicação comum de transplante cardíaco. Até recentemente, contudo, a doença de Chagas era considerada uma contraindicação para esse procedimento, pois acreditava-se que o parasita poderia se aproveitar da imunossupressão após a cirurgia para retomar o acometimento do coração.[41]
Notou-se que as taxas de sobrevida em pacientes com Chagas poderiam aumentar significativamente com a administração de doses menores de drogas imunossupressoras, como a ciclosporina. Recentemente, tem sido demonstrado que o tratamento direto do músculo cardíaco com células-tronco através do transplante de células da medula óssea reduz dramaticamente os riscos de insuficiência cardíaca em pacientes com doença de Chagas.[42]
Epidemiologia

A doença de Chagas afeta de 8 a 10 milhões de pessoas vivendo em países endêmicos da América Latina, com um adicional de 300 000–400 000 vivendo em países não endêmicos, como Espanha e Estados Unidos. Estima-se que anualmente ocorrem 41 200 novos casos em países endêmicos e que 14 400 crianças nascem com Chagas congênito todos os anos.[5][7] Em 2010, a doença resultou em aproximadamente 10 300 mortes em comparação com 9 300 em 1990.[43] Estima-se que a taxa de mortalidade anual seja em torno de 14 000.[44] No Brasil, estimativas recentes apontam que 2 000 000–3 000 000 de pessoas estejam infectadas, e que ocorram cerca de 6 000 mortes anualmente.[45]
A doença está presente em 18 países do continente americano, estendendo-se do sul dos Estados Unidos até o norte da Argentina.[4] Chagas existe em duas zonas ecológicas diferentes. Na região do Cone Sul, o principal vetor vive no interior ou nos arredores das habitações humanas. Na América Central e no México, as principais espécies vetoras vivem tanto no interior das casas como em áreas desabitadas. Em ambas as zonas, a doença de Chagas ocorre quase exclusivamente em áreas rurais, onde os triatomíneos procriam e se alimentam das mais de 150 espécies de 24 famílias de mamíferos domésticos e selvagens, bem como de humanos, que servem de reservatórios naturais do T. cruzi.[46]
Embora os triatomíneos também se alimentem do sangue de pássaros, estes parecem ser imunes à infecção e não são considerados reservatórios do T. cruzi. Mesmo quando colônias de insetos são erradicadas de uma casa ou de abrigos de animais nas redondezas, eles podem re-emergir de plantas ou animais que fizeram parte do ciclo silvático (referente a animais selvagens) do parasita. Esse fenômeno é especialmente provável em zonas com vegetações abertas misturadas a agrupamentos de árvores e interpostas por habitações humanas.[47]
A doença de Chagas crônica permanece um importante problema de saúde pública em muitos países da América Latina, apesar das medidas efetivas de higiene e prevenção, como a eliminação dos insetos transmissores. Entretanto, algumas conquistas foram alcançadas na luta contra a doença na América Latina, como a redução de 72% da incidência da infecção em crianças e adultos jovens nos países da Iniciativa do Cone Sul e pelo menos três países (Uruguai, em 1997, Chile, em 1999, e Brasil, em 2006) foram certificados como livres da transmissão vetorial e transfusional.[7][48][49] Na Argentina, a transmissão vetorial foi interrompida em 13 das 19 províncias endêmicas e progressos significativos têm sido feitos nesse sentido no Paraguai e na Bolívia.[48]
O monitoramento para T. cruzi do sangue doado e dos doadores de componentes sanguíneos e de órgãos sólidos, assim como dos doadores de células, tecidos e produtos de células e tecidos, é mandatório nos países endêmicos de Chagas e tem sido implementado.[50] Há, aproximadamente, 300 000 pessoas infectadas vivendo nos Estados Unidos, o que é provavelmente resultado da imigração de países latino-americanos.[51] Com o aumento dos movimentos populacionais, a possibilidade de transmissão por transfusão de sangue se tornou mais substancial nos Estados Unidos. A transfusão de sangue e produtos de tecidos é ativamente monitorada nos Estados Unidos, diminuindo, portanto, o risco.[52]
Histórico

A enfermidade foi nomeada em homenagem ao médico e epidemiologista brasileiro Carlos Chagas, que foi o primeiro a descrevê-la em 1909,[53][54][55][56] mas a doença não foi vista como um problema maior de saúde pública até a década de 1960 (a epidemia da doença de Chagas no Brasil na década de 1920 foi amplamente ignorada[57]). Chagas descobriu que o intestino dos Triatomidae (atualmente Reduviidae: Triatominae) abrigava um protozoário flagelado, uma nova espécie do gênero Trypanosoma, e foi capaz de provar experimentalmente que poderia ser transmitida a saguis do gênero Callithrix que haviam sido picados pelo inseto infectado. Estudos posteriores demonstraram que o macaco-de-cheiro (do gênero Saimiri) também era vulnerável a infecção.[58]
Carlos Chagas descreveu o parasita patogênico como Trypanosoma cruzi em 1909,[53] em homenagem a Oswaldo Cruz, médico e epidemiologista brasileiro que combateu com sucesso epidemias de febre amarela, varíola e peste bubônica no Rio de Janeiro e outras cidades no começo do século XX. No mesmo ano recombinou o nome científico do parasita para Schizotrypanum cruzi, após reconhecer particularidades biológicas no ciclo reprodutivo que o diferenciava dos demais parasitas do gênero Trypanosoma.[55] Em 1912, Delanoë e Delanoë descrevem o parasita Pneumocystis carinii, demonstrando que as particularidades do ciclo reprodutivo observadas por Chagas eram na verdade de um outro parasita, fazendo com que Chagas retomasse o uso de Trypanosoma cruzi.[59][60]
Na Argentina, a doença é conhecida como mal de Chagas-Mazza, em homenagem ao médico argentino Salvador Mazza, que em 1926 começou a investigar a enfermidade e que nos anos seguintes tornou-se o principal pesquisador da doença naquele país.[61]
Existe a hipótese de que Charles Darwin possa ter sofrido de doença de Chagas, como resultado de uma picada do chamado "grande besouro preto dos Pampas" (vinchuca). O episódio foi relatado por ele em seu diário da viagem do Beagle como tendo ocorrido em março de 1835, a leste dos Andes, próximo a Mendoza. Darwin era jovem e gozava de boa saúde, embora seis meses depois ele adoeceu por quase um mês perto de Valparaíso, mas em 1837, quase um ano depois de ter regressado a Inglaterra, começou a sofrer de um estranho grupo de sintomas, tornando-se incapacitado na maior parte do resto de sua vida. As tentativas de testar os restos mortais de Darwin na Abadia de Westminster usando técnicas modernas de PCR foram negadas pelo curador.[62]
Pesquisa
Vários tratamentos experimentais mostraram-se promissores em animais modelos. Estes incluem inibidores da ciclase de oxidosqualeno e squaleno sintase,[63][64] inibidores da cisteína protease,[63][65] dermaseptinas coletadas de sapos do gênero Phyllomedusa (P. oreades e P. distincta),[66] a lactona sesquiterpênica dehidroleucodina (DhL), que afeta o crescimento de Trypanosoma cruzi na fase epimastigota em meio de cultura,[67] inibidores da captação de purina,[63] e inibidores de enzimas envolvidas no metabolismo da trypanotiona.[68] Novas drogas podem ser pesquisadas com o prosseguimento da sequenciamento do genoma do T. cruzi.[69] Um estudo in vitro de 2004 sugeriu que componentes do chá verde (catequinas) podem ser efetivos contra o T. cruzi.[70]
Pesquisadores em 2013 da Universidade de Vanderbilt divulgaram um estudo intitulado "VNI Cures Acute and Chronic Experimental Chagas Disease." No estudo, foi administrado essa bio-molécula a ratos por 30 dias com índices de cura de 100% e 100% de sobrevivência. A droga foi descrita como atóxica e altamente seletiva. Seu mecanismo de ação é através da inibição da esterol 14α-dimetilase no T. cruzi.[71]
A doença de Chagas têm um sério impacto econômico no mundo. O custo do tratamento nos Estados Unidos é estimado em $900 milhões anualmente, que inclui hospitalização e dispositivos médicos como marca-passos. O custo global é estimado em $7 bilhões.[72]
Apesar de ser a principal enfermidade parasitária do Ocidente, a doença de Chagas é considerada uma das doenças negligenciadas. Embora seja prevenível e potencialmente erradicável, recursos insuficientes têm sido destinados à pesquisa e desenvolvimento de inovações diagnósticas e terapêuticas para Chagas.[73] Em resposta a essa crise, organizações do terceiro setor, como a Drugs for Neglected Diseases initiative, em colaboração com universidades e instituições públicas de biotecnologia, têm buscado o desenvolvimento de novos fármacos e vacinas para o controle da doença de Chagas.[74]
Referências
- ↑ Fundação Oswaldo Cruz Acessado em 2 de maio de 2008
- ↑ a b c d Guerrant, RL; Walker, DH; Weller, PF. «93: American Trypanosomiasis (Chagas' Disease)». Tropical Infectious Diseases Principles, Pathogens, & Practice 2 ed. Philadelphia: Churchill Livingstone Elsevier. pp. 1082–94
- ↑ a b c Kashiwabara, Y.B.; Paiva, R.M.R.A.; Nakaoka, V.Y.; Silva, E.; Kashiwabara, T.G.B. (2010). «Doença de Chagas - Revisão de Literatura». Brazilian Journal of Surgery and Clinical Research. 4 (3): 49-52
- ↑ a b c d e «DPDx – Trypanosomiasis, American. Fact Sheet». Centers for Disease Control (CDC). Consultado em 12 de maio de 2010
- ↑ a b c d Rassi, A.; Rassi, A.; Marin-Neto, J.A. (2010). «Chagas disease». Lancet. 375 (9723): 1388–402. PMID 20399979. doi:10.1016/S0140-6736(10)60061-X
- ↑ a b Bern, C.; Montgomery, S.P.; Herwaldt, B.L.; et al. (2007). «Evaluation and treatment of chagas disease in the United States: a systematic review». JAMA. 298 (18): 2171–81. PMID 18000201. doi:10.1001/jama.298.18.2171
- ↑ a b c d e f g Kirchhoff, L.V. (17 de dezembro de 2010). «Chagas Disease (American Trypanosomiasis)». eMedicine. Consultado em 12 de maio de 2010
- ↑ Córdova, E.; Maiolo, E.; Corti, M.; Orduña, T. (2010). «Neurological manifestations of Chagas' disease». Neurolology Research. 32 (3): 238–44. PMID 20406601. doi:10.1179/016164110X12644252260637
- ↑ Costa, J.; Peterson, A.T.; Beard, C.B. (2002). «Ecologic niche modeling and differentiation of populations of Triatoma brasiliensis Neiva, 1911, the most important Chagas' disease vector in northeastern Brazil (Hemiptera, Reduviidae, Triatominae)». American Journal of Tropical Medicine and Hygiene. 67 (5): 516-520
- ↑ Teixeira, A.R.; Monteiro, P.S.; Rebelo, J.M. (2001). «Emerging Chagas disease: trophic network and cycle of transmission of Trypanosoma cruzi from palm trees in the Amazon». Emerging Infectious Diseases. 7 (1): 100–12. PMC 2631687
 . PMID 11266300. doi:10.3201/eid0701.010115
. PMID 11266300. doi:10.3201/eid0701.010115
- ↑ Wendel, S. (2010). «Transfusion transmitted Chagas disease: Is it really under control?». Acta Tropica. 115 (1–2): 28–34. PMID 20044970. doi:10.1016/j.actatropica.2009.12.006
- ↑ Santos Ferreira, C.; Amato Neto, V.; Gakiya, E.; Bezerra, R.C.; Alarcón, R.S. (2003). «Microwave treatment of human milk to prevent transmission of Chagas disease». Revista do Instituto de Medicina Tropical de São Paulo. 45 (1): 41–2. PMID 12751321. doi:10.1590/S0036-46652003000100008
- ↑ Hudson, L.; Turner, M.J.; (1984). «Immunological consequences of infection and vaccination in South American trypanosomiasis [and discussion]». Philosophical Transactions of the Royal Society B. 307 (1131): 51–61. Bibcode:1984RSPTB.307...51H. JSTOR 2990154. PMID 6151688. doi:10.1098/rstb.1984.0108
- ↑ Benchimol-Barbosa, P.R. (2006). «The oral transmission of Chagas' disease: an acute form of infection responsible for regional outbreaks». International Journal of Cardiology. 112 (1): 132–133. PMID 16600406. doi:10.1016/j.ijcard.2005.11.087
- ↑ Benchimol-Barbosa, P.R. (2010). «Trends on acute Chagas' disease transmitted by oral route in Brazil: steady increase in new cases and a concealed residual fluctuation». International Journal of Cardiology. 145 (3): 494–496. PMID 19762096. doi:10.1016/j.ijcard.2009.08.030
- ↑ «Chagas' disease (American trypanosomiasis) in southern Brazil» (PDF). CDR Weekly. 15 (13). 2005
- ↑ Shikanai-Yasuda, M.A.; Marcondes, C.B.; Guedes, L.A. (1991). «Possible oral transmission of acute Chagas' disease in Brazil». Rev Inst Med Trop São Paulo. 33 (5): 351–357. PMID 1844961. doi:10.1590/S0036-46651991000500003
- ↑ da Silva Valente S.A.; de Costa Valente, V.; Neto, H.F. (1999). «Considerations on the epidemiology and transmission of Chagas disease in the Brazilian Amazon». Memórias do Instituto Oswaldo Cruz. 94 (Suppl 1): 395–8. PMID 10677763. doi:10.1590/s0074-02761999000700077
- ↑ de Noya, B.A.; Díaz-Bello, Z.; Colmenares, C.; Ruiz-Guevara, R.; Mauriello, L.; Zavala-Jaspe, R.; Suarez, J.A.; Abate, T.; Naranjo, L.; Paiva, M.; Rivas, L.; Castro, J.; Márques, J.; Mendoza, I.; Acquatella, H.; Torres, J.; Noya, O. (2010). «Large urban outbreak of orally acquired acute Chagas disease at a school in Caracas, Venezuela». The Journal of Infectious Diseases. 201 (9): 1308–1315. PMID 20307205. doi:10.1086/651608
- ↑ Roca, C.; Pinazo, M.J.; López-Chejade, P.; Bayó, J.; Posada, E.; López-Solana, J.; Gállego, M.; Portús, M.; Gascón, J.; Chagas-Clot Research Group (2011). «Chagas Disease among the Latin American Adult Population Attending in a Primary Care Center in Barcelona, Spain». PLoS Neglected Tropical Diseases. 5 (4): e1135. PMC 3082512
 . PMID 21572511. doi:10.1371/journal.pntd.0001135
. PMID 21572511. doi:10.1371/journal.pntd.0001135
- ↑ a b Pereira, P.C.M.; Navarro, E.C. (2013). «Challenges and perspectives of Chagas disease: a review». Journal of Venomous Animals and Toxins including Tropical Diseases. 19. 34 páginas. doi:10.1186/1678-9199-19-34
- ↑ Dias, J.C.P.; Coura, J.R. (1997). Clínica e terapêutica da doença de Chagas: uma abordagem prática para o clínico geral. Rio de Janeiro: FIOCRUZ. 486 páginas. ISBN 85-85676-31-0
- ↑ a b Portela-Lindoso, A.A.B.; Shikanai-Yasuda, M.A. (2003). «Doença de Chagas crônica: do xenodiagnóstico e hemocultura à reação em cadeia da polimerase». Revista de Saúde Pública. 37 (1): 107-115. doi:10.1590/S0034-89102003000100016
- ↑ Bezerra, R.C.; Neto, V.A. (2010). «Trypanosoma cruzi, hemocultura: uma abordagem prática». Revista Brasileira de Clínica Médica. 8 (3): 205-207
- ↑ Brumpt, E. (1914). «Le xénodiagnostic. Application au diagnostic de quelques infections parasitaires et en particulier à la trypanosomose de Chagas». Bulletin de la Société de Pathologie Exotique. 7 (10): 706–710
- ↑ «A killer that preys on the poor: Chagas disease» (pdf). Médecins Sans Frontières: Activity Report 2003/2004. Consultado em 29 de agosto de 2008
- ↑ Zerba, E.N. (1999). «Susceptibility and resistance to insecticides of Chagas disease vectors» (PDF). Medicina (Buenos Aires). 59 (Suppl 2): 41–6
- ↑ Pires, H.H.; Lazzari, C.R.; Diotaiuti, L.; Lorenzo, M.G. (2000). «Performance of yeast-baited traps with Triatoma sordida, Triatoma brasiliensis, Triatoma pseudomaculata, and Panstrongylus megistus in laboratory assays». Revista Panamena de Salud Publica. 7 (6): 384–8. PMID 10949899. doi:10.1590/S1020-49892000000600005
- ↑ Luz C, Rocha LF, Nery GV, Magalhães BP, Tigano MS (March 2004). «Activity of oil-formulated Beauveria bassiana against Triatoma sordida in peridomestic areas in Central Brazil». Mem Inst Oswaldo Cruz. 99 (2): 211–8. PMID 15250478. doi:10.1590/S0074-02762004000200017 Verifique data em:
|data=(ajuda) - ↑ Beard, C.B.; Cordon-Rosales, C.; Durvasula, R.V. (2002). «Bacterial symbionts of the Triatominae and their potential use in control of Chagas disease transmission». Annual Review of Entomology. 47: 123–41. PMID 11729071. doi:10.1146/annurev.ento.47.091201.145144
- ↑ Basso, B.; Moretti, E.; Fretes, R. (2008). «Vaccination with epimastigotes of different strains ofTrypanosoma rangeli protects mice against Trypanosoma cruzi infection». Memórias do Instituto Oswaldo Cruz. 103 (4): 370–4. PMID 18660992. doi:10.1590/S0074-02762008000400010
- ↑ Dumonteil, E.; Escobedo-Ortegon, J.; Reyes-Rodriguez, N.; Arjona-Torres, A.; Ramirez-Sierra, M. (2004). «Immunotherapy of Trypanosoma cruzi Infection with DNA Vaccines in Mice». Infection and Immunity. 72 (1): 46–53. PMC 343959
 . PMID 14688079. doi:10.1128/IAI.72.1.46-53.2004
. PMID 14688079. doi:10.1128/IAI.72.1.46-53.2004
- ↑ Castro, E. (2009). «Chagas' disease: lessons from routine donation testing». Transfus Med. 19 (1): 16–23. PMID 19302451. doi:10.1111/j.1365-3148.2009.00915.x
- ↑ a b c Gascon, J.; Bern, C.; Pinazo, M.J. (2009). «Chagas disease in Spain, the United States and other non-endemic countries». Acta Tropica. 115 (1–2): 22–7. PMID 19646412. doi:10.1016/j.actatropica.2009.07.019
- ↑ a b «FDA Approves Chagas Disease Screening Test for Blood, Tissue and Organ Donors». FDA. Consultado em 12 de maio de 2010
- ↑ «Infectious Disease Testing». American Red Cross. Consultado em 12 de maio de 2010
- ↑ «Chagas' Biovigilance Network». Consultado em 12 de maio de 2010
- ↑ Garcia, S.; Ramos, C.O.; Senra, J.F. (2005). «Treatment with Benznidazole during the Chronic Phase of Experimental Chagas' Disease Decreases Cardiac Alterations». Antimicrobial Agents and Chemotherapy. 49 (4): 1521–8. PMC 1068607
 . PMID 15793134. doi:10.1128/AAC.49.4.1521-1528.2005
. PMID 15793134. doi:10.1128/AAC.49.4.1521-1528.2005
- ↑ Buckner, F.S.; Wilson, A.J.; White, T.C.; Van Voorhis, W.C. (1998). «Induction of Resistance to Azole Drugs in Trypanosoma cruzi». Antimicrob Agents Chemother. 42 (12): 3245–50. PMC 106029
 . PMID 9835521
. PMID 9835521
- ↑ Dubner, S.; Schapachnik, E.; Riera, A.R.; Valero, E. (2008). «Chagas disease: state-of-the-art of diagnosis and management». Cardiology Journal. 15 (6): 493–504. PMID 19039752
- ↑ Bocchi, E.A.; Bellotti, G.; Mocelin, A.O. (1996). «Heart transplantation for chronic Chagas' heart disease». The Annals of Thoracic Surgery. 61 (6): 1727–33. PMID 8651775. doi:10.1016/0003-4975(96)00141-5
- ↑ Vilas-Boas, F.; Feitosa, G.S.; Soares, M.B. (2006). «Resultados iniciais do transplante de células de medula óssea para o miocárdio de pacientes com insuficiência cardíaca de etiologia chagásica». Arquivos Brasileiros de Cardiologia. 87 (2): 159–66. PMID 16951834. doi:10.1590/S0066-782X2006001500014
- ↑ Lozano, R.; et al. (2012). «Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010». Lancet. 380 (9859): 2095–128. PMID 23245604. doi:10.1016/S0140-6736(12)61728-0
- ↑ World Health Organization (2010). «Chagas'disease(American trypanosomiasis) factsheet». The Weekly Epidemiological Record. 34: 334–336
- ↑ Martins-Melo, F.R.; Ramos Jr., A.N.; Alencar, C.H.; Lange, W.; Heukelbach, J. (2012d). «Mortality of Chagas'disease in Brazil: spatial patterns and definition of high-risk areas». Tropical Medicine & International Health. 17 (9): 1066–1075. doi:10.1111/j.1365-3156.2012.03043.x
- ↑ Morel, C.M.; Lazdins, J. (2003). «Chagas disease». Nature Reviews Microbiology. 1 (1): 14–15. PMID 15040175. doi:10.1038/nrmicro735
- ↑ Pinto-Dias, J.C. (1992). «Epidemiology of Chagas disease». In: Wendel S, Brener Z, Camargo ME, Rassi A (eds.). Chagas Disease – American Trypanosomiasis: its impact on transfusion and clinical medicine. ISBT Brazil '92. XXII Congress of the International Society of Blood Transfusion. XX Brazilian Congress of Hematology. Extraordinary Congress of the Brazilian College of Hematology. São Paulo: Editorial ISBT Brazil. Consultado em 11 September 2008 Verifique data em:
|acessodata=(ajuda) - ↑ a b «The Southern Cone Initiative: an update». Special Programme for Research and Training in Tropical Diseases (TDR) (Nota de imprensa). WHO. 2004. Consultado em 29 August 2008 Verifique data em:
|acessodata=(ajuda) [ligação inativa] - ↑ Massad, E. (2008). «The elimination of Chagas' disease from Brazil». Epidemiology and Infection. 136 (9): 1153–64. PMC 2870925
 . PMID 18053273. doi:10.1017/S0950268807009879
. PMID 18053273. doi:10.1017/S0950268807009879
- ↑ Castro, E. (2009). «Chagas' disease: lessons from routine donation testing». Transfusion Medicine. 19 (1): 16–23. PMID 19302451. doi:10.1111/j.1365-3148.2009.00915.x
- ↑ «Medical Encyclopedia: Chagas disease». National Institutes of Health. Consultado em 11 de setembro de 2008
- ↑ Kirchhoff, L.V. (1993). «American trypanosomiasis (Chagas' disease) – a tropical disease now in the United States». The New England Journal of Medicine. 329 (9): 639–44. PMID 8341339. doi:10.1056/NEJM199308263290909
- ↑ a b Chagas, C. (1909). «Neue Trypanosomen». Vorläufige Mitteilung Arch. Schiff. Tropenhyg. 13: 120–122
- ↑ Redhead, S.A.; Cushion, M.T.; Frenkel, J.K.; Stringer, J.R. (2006). «Pneumocystis and Trypanosoma cruzi: nomenclature and typifications». Journal of Eukaryotic Microbiology. 53 (1): 2–11. PMID 16441572. doi:10.1111/j.1550-7408.2005.00072.x
- ↑ a b Chagas, C. (1909). «Nova tripanozomiase humana: Estudos sobre a morfolojia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., n. sp., ajente etiolojico de nova entidade morbida do homem [New human trypanosomiasis. Studies about the morphology and life-cycle of Schizotripanum cruzi, etiological agent of a new morbid entity of man]». Mem Inst Oswaldo Cruz. 1 (2): 159–218. ISSN 0074-0276. doi:10.1590/S0074-02761909000200008
- ↑ Kropf, S.P.; Sá, M.R. «The discovery of Trypanosoma cruzi and Chagas disease (1908–1909): tropical medicine in Brazil». História, Ciências Saúde-Manguinhos. 16 (Suppl 1): 13–34. PMID 20027916
- ↑ Coutinho, M. (junho de 1999). «Review of Historical Aspects of American Trypanosomiasis (Chagas' Disease) by Matthias Perleth». Isis. 90 (2). 397 páginas. JSTOR 237120. doi:10.1086/384393
- ↑ Hulsebos, L.H.; Choromanski, L.; Kuhn, R.E. (1989). «The effect of interleukin-2 on parasitemia and myocarditis in experimental Chagas' disease». Journal of Protozoology. 36 (3): 293–8. PMID 2499678
- ↑ Delanoë, P.; Delanoë, M. (1912). «Sur les rapports des kystes de Carini du poumon des rats avec le Trypanosoma lewisi». Comptes rendus de l'Academie des sciences. 155: 658–661
- ↑ Chagas, C. (1913). «Revisão do cyclo evolutivo do "Trypanosoma Cruzi"». Brazil-Médico. 27. 225 páginas
- ↑ «Enfermedad de Chagas – Mazza» (em espanhol). Asociación Lucha Contra el Mal de Chagas. Consultado em 15 de setembro de 2011
- ↑ Adler, D. (1989). «Darwin's Illness». Israel Journal of Medical Science. 25 (4): 218–21. PMID 2496051
- ↑ a b c Scientific Working Group on Chagas Disease [April 2005] (July 2007). Guhl F, Lazdins-Helds JK (eds.): Reporte del grupo de trabajo científico sobre la enfermedad de Chagas Arquivado em 17 de dezembro de 2008 no Wayback Machine. (in Spanish). Geneva: WHO. Retrieved on 29 August 2008. summary in English
- ↑ Urbina, J.A.; Concepcion, J.L.; Rangel, S.; Visbal, G.; Lira, R. (2002). «Squalene synthase as a chemotherapeutic target in Trypanosoma cruzi and Leishmania mexicana». Mol Biochem Parasitol. 125 (1–2): 35–45. PMID 12467972. doi:10.1016/S0166-6851(02)00206-2
- ↑ Engel, J.C.; Doyle, P.S.; Hsieh, I.; McKerrow, J.H. (1998). «Cysteine Protease Inhibitors Cure an Experimental Trypanosoma cruzi Infection». The Journal of Experimental Medicine. 188 (4): 725–34. PMC 2213346
 . PMID 9705954. doi:10.1084/jem.188.4.725
. PMID 9705954. doi:10.1084/jem.188.4.725
- ↑ Brand, G.D.; Leite, J.R.; Silva, L.P. (2002). «Dermaseptins from Phyllomedusa oreades and Phyllomedusa distincta. Anti-Trypanosoma cruzi activity without cytotoxicity to mammalian cells». Journal of Biological Chemistry. 277 (51): 49332–40. PMID 12379643. doi:10.1074/jbc.M209289200
- ↑ Brengio, S.D.; Belmonte, S.A.; Guerreiro, E.; Giordano, O.S.; Pietrobon, E.O.; Sosa, M.A. (2000). «The sesquiterpene lactone dehydroleucodine (DhL) affects the growth of cultured epimastigotes of Trypanosoma cruzi». J Parasitol. 86 (2): 407–12. ISSN 0022-3395. PMID 10780563. doi:10.1645/0022-3395(2000)086[0407:TSLDDA]2.0.CO;2
- ↑ Fairlamb, A.H.; Cerami, A. (1992). «Metabolism and functions of trypanothione in the Kinetoplastida». Annual Reviews Microbiology. 46: 695–729. PMID 1444271. doi:10.1146/annurev.mi.46.100192.003403
- ↑ El-Sayed, N.M.; Myler, P.J.; Bartholomeu, D.C. (2005). «The genome sequence of Trypanosoma cruzi, etiologic agent of Chagas disease». Science. 309 (5733): 409–15. Bibcode:2005Sci...309..409E. PMID 16020725. doi:10.1126/science.1112631
- ↑ Paveto, C.; Güida, M.C.; Esteva, M.I.; Martino, V.; Coussio, J.; Flawiá, M.M.; Torres, H.N. (2004). «Anti-Trypanosoma cruzi Activity of Green Tea (Camellia sinensis) Catechins». Antimicrobial Agents and Chemotherapy. 48 (1): 69–74. PMC 310206
 . PMID 14693520. doi:10.1128/AAC.48.1.69-74.2004
. PMID 14693520. doi:10.1128/AAC.48.1.69-74.2004
- ↑ Villalta, F.; Dobish, M.C.; Nde, P.N.; Kleshchenko, Y.Y.; Hargrove, T.Y.; Johnson, C.A.; Waterman, M.R.; Johnston, J.N.; Lepesheva, G.I. (2013). «VNI cures acute and chronic experimental Chagas disease». The Journal of infectious diseases. 208 (3): 504–11. PMC 3698996
 . PMID 23372180. doi:10.1093/infdis/jit042
. PMID 23372180. doi:10.1093/infdis/jit042
- ↑ Schmuñis, G. (2013). «Status of and cost of Chagas disease worldwide». The Lancet infectious diseases. 13 (4): 283–4. PMID 23395247. doi:10.1016/S1473-3099(13)70032-X
- ↑ Feasey, N.; Wansbrough-Jones, M.; Mabey, D.C.W.; Solomon, A.W. (2009). «Neglected Tropical Diseases». British Medical Bulletin. 93 (1). 179 páginas. doi:10.1093/bmb/ldp046
- ↑ Hotez, P.J.; Dumonteil, E.; Woc-Colburn, L.; Serpa, J.A.; Bezek, S.; et al. (2012). «Chagas disease: 'The new HIV/AIDS of the Americas'». PLoS Neglected Tropical Diseases. 6 (5): e1498. PMC 3362306
 . PMID 22666504. doi:10.1371/journal.pntd.0001498
. PMID 22666504. doi:10.1371/journal.pntd.0001498
Leitura adicional
- Brener, Z., Andrade, Z. e M Barral-Neto (eds.). Trypanosoma cruzi e doença de Chagas, 2.ª edição. Rio de Janeiro: Guanabara Koogan Ed., 2000.
- Dias, J.C.P. & Coura, J.R. (eds.). Clínica e Terapêutica da Doença de Chagas: um manual para o clínico geral. Rio de Janeiro: Editora Fiocruz, 1997.
- Gontijo, E.D. e Rocha, M.°C. (eds.).Manejo clínico em doença de Chagas. Brasília: Fundação Nacional de Saúde, Ministério da Saúde, 1998.
- Storino, R. & Milei, J. (eds.).Enfermedad de Chagas. Buenos Aires: Doyma Argentina, 1994.
- Autochthonous Chagas' disease in Santa Catarina State, Brazil: report of the first case of digestive tract involvement
Ligações externas
- Médicos sem Fronteiras. A descoberta da doença de Chagas está fazendo 100 anos.
- Antimicrob. Agents Chemother. 49: 1521-1528 Garcia, S., Ramos, C. O., Senra, J. F. V., Vilas-Boas, F., Rodrigues, M. M., Campos-de-Carvalho, A. C., Ribeiro-dos-Santos, R., Soares, M. B. P. (2005). Treatment with Benznidazole during the Chronic Phase of Experimental Chagas' Disease Decreases Cardiac Alterations.
- Arquivos Brasileiros de Cardiologia, 82(2):185-7, 2004. Vilas-Boas F., Feitosa G.S., Soares M. B. P., Pinho Filho J.A., Almeida A., Mota A., Carvalho H. G., Oliveira A. D. D. Ribeiro-dos-Santos R. Bone marrow cell transplantation to the myocardium of a patient with heart failure due to Chagas cardiomyopathy. A case report.
- Programa Integrado da Doença de Chagas
- "Doença de Chagas" material do curso de Medicina da Universidade Federal Fluminense
- «Doença de Chagas é tão antiga nas Américas quanto a presença humana». UOL, 10/07/2009 .
- Biblioteca Virtual Carlos Chagas. A doença de Chagas Acessado em 21 de outubro de 2009.
- Exposição Virtual Carlos Chagas | A doença de Chagas