2-Metiltetraidrofurano
| 2-Metiltetraidrofurano Alerta sobre risco à saúde | |
|---|---|

| |
| Identificadores | |
| Número CAS | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/C5H10O/c1-5-3-2-4-6-5/h5H,2-4H2,1H3
|
| Propriedades | |
| Fórmula química | C5H10O |
| Massa molar | 86.13 g mol-1 |
| Densidade | 0.854 g/mL |
| Ponto de fusão |
-136 °C, 137 K, -213 °F |
| Ponto de ebulição |
80.3 °C, 353 K, 177 °F |
| Riscos associados | |
| MSDS | External MSDS |
| Compostos relacionados | |
| Éteres cíclicos relacionados | Tetraidrofurano |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
2-Metiltetraidrofurano é um composto orgânico com a fórmula molecular CH3C4H7O. É um líquido móvel altamente inflamável. É principalmente usado como um substituinte para o THF e aplicações especializadas por sua melhor performance, tal como obter temperaturas de reação mais altas, ou separações mais fácveis devido a seus solubilidade. É derivado do furfural e é utilizável como biocombustível.
Estruturas e propriedades[editar | editar código-fonte]
2-Metiltetraidrofurano é "inversamente solúvel" em água. Ou seja, a sua solubilidade diminui com o aumento da temperatura, o que é uma propriedade rara.[1] 2-Metiltetraidrofurano comporta-se, tal como o tetraidrofurano, como uma base de Lewis em reações organometálicas.[2]
Preparação[editar | editar código-fonte]
2-Metiltetraidrofurano é usualmente sintetizado por hidrogenação catalítica do furfural.[3]
- OC4H3CHO + 4 H2 → OC4H7CH3 + H2O
Furfural é produzido pela digestão catalisada por ácido de açúcares pentosanos, C5 polisacarídeos, em biomassa. Então, as matérias-primas do 2-metiltetraidrofurano são biomassas renováveis ricas em celulose, hemiceluloses e lignina, tais como espigas de milho ou bagaço e outros resíduos vegetais e agrícolas.[4]
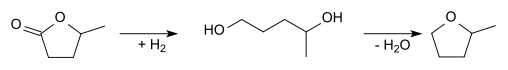
2-Metiltetraidrofurano pode também ser produzido partindo-se do ácido levulínico. Ciclização e redução resultam em γ-valerolactona:
Esta lactona pode ser hidrogenada a 1,4-pentanediol, o qual pode ser desidratado resultando em 2-metiltetraidrofurano:
2-Metiltetraidrofurano tem um estereocentro, logo existe em duas formas enantioméricas. O processo comercial envolvendo a hidrogenação resulta em uma mistura racêmica dos dois. A síntese assimétrica de (S)-(+)-2-metiltetraidrofurano pode ser obtida usando-se um complexo de "lã" de ródio como um catalisador quiral para a hidrogenação de metilfurano.[1]
Aplicações[editar | editar código-fonte]
2-Metiltetraidrofurano é principalmente utilizado como um substituto de ponto de ebulição superior para o tetraidrofurano como um solvente especial, popular, embora mais caro. É também utilizado na formulação de eletrólito eletrodos de lítio secundários e como um componente em combustíveis alternativos. É um solvente valioso para reações a baixa temperatura. 2-Metiltetraidrofurano forma um vidro, que não cristaliza, e é frequentemente usado como um solvente para estudos espectroscópicos a −196 °C.[2]
Outros usos comuns de 2-metiltetraidrofurano é como um solvente para reagentes de Grignard usados em processos químicos organometálicos e bifásicos, por causa da habilidade do átomo de oxigênio em coordenar-se ao componente íon magnésio do reagente de Grignard, ou a produtos secos azeotropicamente. O uso de 2-metiltetraidrofurano fornece separações de fases água-orgânico muito definidas.
2-Metiltetraidrofurano tem um número de octano de 74 ou 87. É aprovado pelo Departamento de Energia dos Estados Unidos como um aditivo para gasolina. Furfural e outros compostos furila parcialmente hidrogenados e reduzidos entre ele e 2-metiltetraidrofurano (álcool furfurílico, letilfurano, álcool tetraidrofurfural) tem uma tendência a polimerizar-se e serem bastante voláteis. 2-Metiltetraidrofurano em si, entretando, é mais estável e menos volátil, sendo então adequado para uso como combustível para motores.[5]
Referências
- ↑ a b He, Man; Zhou, Da-Qing; Ge, Hong-Li; Huang, Mei-Yu; Jiang, Ying-Yan (2003). «Caytalytic Behavior of Wool-Rh Complex in Aymmetric Hydrogenation of 2-Methyl Furan». Polymer Advanced technology. 14: 273–277. doi:10.1002/pat.305
- ↑ a b Aycock, David F. (2007). «Solvent Applications of 2-Methyltetrahydrofuran in Organometallic and Biphasic Reactions». Org. Proc. Res. Dev. 11: 156−159. doi:10.1021/op060155c
- ↑ George W. Huber, Sara Iborra, and Avelino Corma; Synthesis of Transportation Fuels from Biomass: Chemistry, Catalysts, and Engineering; Chem. Rev., 2006, 106 (9), pp 4044–4098; DOI: 10.1021/cr068360d
- ↑ Hoydonckx, H. E.; Van Rhijn, W. M.; Van Rhijn, W.; De Vos, D. E.; Jacobs, P. A. (2005), "Furfural and Derivatives", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a12_119.pub2
- ↑ George W. Huber , Sara Iborra , and Avelino Corma; Synthesis of Transportation Fuels from Biomass: Chemistry, Catalysts, and Engineering; Chem. Rev., 2006, 106 (9), pp 4044–4098 - DOI: 10.1021/cr068360d
Leitura adicional[editar | editar código-fonte]
- Zheng, Hong-Yan; Zhu, Yu-Lei; Teng, Bo-Tao; Bai, Zong-Qing; Zhang, Cheng-Hua; Xiang, Hong-Wei; Li, Yong-Wang (2006). «Towards understanding the reaction pathway in vapor phasehydrogenation of furfural to 2-methylfuran». Journal of Molecular Catalysis A, Chemical. 246. 18 páginas. doi:10.1016/j.molcata.2005.10.003