Azodicarboxilato de dietilo
| Azodicarboxilato de dietilo Alerta sobre risco à saúde | |
|---|---|

| |
| |
| Nome IUPAC | Diethyl diazenedicarboxylate |
| Outros nomes | Azidoformato de dietilo, Ácido diazenedicarboxílico, Azo diformato de dietilo[1] |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/C6H10N2O4/c1-3-11-5(9)7-8-6(10)12-4-2/h3-4H2,1-2H3/b8-7+
|
| Propriedades | |
| Fórmula química | C6H10N2O4 |
| Massa molar | 174.13 g mol-1 |
| Aparência | Líquido laranja a avermelhado[2] |
| Densidade | 1.11 g/cm3[3] |
| Ponto de fusão |
6 °C, 279 K, 43 °F |
| Ponto de ebulição |
104.5 °C, 378 K, 220 °F |
| Índice de refracção (nD) | 1.420 (20 °C)[3] |
| Riscos associados | |
| Frases R | R20 R21 R22 R36 R37 R38 R40 R44 |
| Frases S | S15 S23 S26 S36 |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
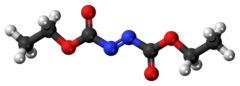
Azodicarboxilato de dietilo, abreviado na literatura como DEAD (do inglês diethyl azodicarboxylate, e algumas vezes como DEADCAT),[4][5] é um composto orgânico com a fórmula estrutural CH3CH2O2CN=NCO2CH2CH3. Sua estrutura molecular consiste em um grupo funcional azo central, RN=NR, flanqueado por dois grupos etil éster. Este líquido laranja a avermelhado é um reagente valioso, mas também bastante perigoso e explode com aquecimento. Por conseguinte, o transporte comercial de azodicarboxilato de dietilo puro é proibido nos Estados Unidos e é realizado em solução ou em armazenamento com partículas de poliestireno.
DEAD é um aza-dienófilo e um eficiente agente de desidrogenação, convertendo álcoois a aldeídos, tióis a dissulfetos e grupos hidrazo a grupos azo; também é um bom aceitador de elétrons. Enquanto DEAD é usado em numerosas reações químicas é mais conhecido como um componente chave da reação de Mitsunobu, uma estratégia comum para a preparação de uma amina, azida, éter, tioéter ou éster do álcool correspondente.[6] É utilizado na síntese de vários produtos naturais e farmacêuticos como zidovudina, uma droga para tratamento de AIDS; FdUMP, um potente agente antitumor e procarbazina, uma droga quimioterápica.
Propriedades[editar | editar código-fonte]
DEAD é um líquido laranja-avermelhado que enfraquece sua cor em amarelo ou incolor após diluição ou reação química. Esta mudança de cor é convencionalmente utilizada para o monitoramento visual da síntese. DEAD dissolve-se na maioria dos solventes orgânicos comuns, como tolueno, clorofórmio, etanol,[7] tetraidrofurano e diclorometano[3][8] mas tem baixa solubilidade em água ou tetracloreto de carbono; a solubilidade em água é mais alta para o composto azo relacionado azodicarboxilato de dimetila.[9]
DEAD é um forte aceitador de elétrons e oxida facilmente uma solução de iodeto de sódio em ácido acético glacial. Também reage vigorosamente com hidrato de hidrazina produzindo hidrazodicarboxilato de dietila e desprendendo nitrogênio. Cálculos por método de orbitais moleculares como uma combinação linear de orbitais atômicos (LCAO-MO) sugerem que a molécula de DEAD é incomum por ter um orbital de ligação vago alto e, portanto, tende a retirar átomos de hidrogênio de vários doadores de hidrogênio. Remoção fotoassistida de hidrogênio por DEAD foi demonstrada por álcool isopropílico, resultando em pinacol e tetrazanotetracarboxilato de tetraetila, e para acetaldeído rendendo hidrazodicarboxilato de diacetila e dietila. Similarmente, reagindo DEAD com etanol e cicloexanol abstrai hidrogênio produzindo acetaldeído e cicloexanona. Essas reações também prosseguem sem luz, embora com rendimentos muito mais baixos.[7] Assim, em geral, DEAD é um aza-dienófilo e agente de desidrogenação, convertendo álcoois a aldeídos, tióis a dissulfetos e grupos hidrazo a grupos azo.[10] Também combina reações pericíclicas com alquenos e dienos via mecanismos eno e Diels–Alder.[11]
Preparação[editar | editar código-fonte]
Embora disponível comercialmente, azodicarboxilato de dietila é frequentemente preparado fresco no laboratório, especialmente se necessário na forma pura, não diluída. Uma síntese de duas etapas começa a partir de hidrazina, primeiro por alquilação com cloroformato de etila, seguido pelo tratamento do resultante hidrazodicarboxilato de dietila com cloro (borbulhado através da solução), ácido hipocloroso, ácido nítrico concentrado ou ácido nítrico fumegante vermelho. A reação é realizada em um banho de gelo, e os reagentes são adicionados gota a gota para que a temperatura não se eleve acima de 20 °C. Hidrazodicarboxilato de dietila é um sólido com uma temperatura de fusão de 131–133 °C o qual é coletado como um resíduo; é significativamente mais estável ao aquecimento que DEAD e é convencionalmente seco a uma temperatura de aproximadamente 80 °C[9][12]
Aplicações[editar | editar código-fonte]
Reação de Mitsunobu[editar | editar código-fonte]
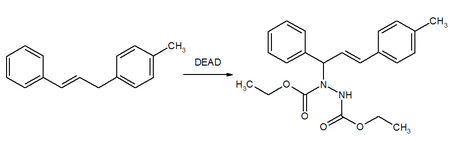
DEAD é um reagente importante na reação de Mitsunobu onde forma um aduto com fosfinas (usualmente trifenilfosfina) e auxilia a síntese de ésters, éteres, aminas e tioéteres de álcoois. Reações normalmente resultam na inversão da simetria molecular.
DEAD foi usado no artigo original de 1967 por Oyo Mitsunobu,[13] e sua revisão de 1981 sobre o uso de azodicarboxilato de dietila é um artigo de química muito citado.[14][15] Reação de Mitsunobu tem várias aplicações na síntese de produtos naturais e farmacêuticos.
Na reação acima, que é assistida por DEAD ou DIAD (azodicarboxilato de di-isopropila), timidina 1 transforma-se no derivado 2. O último facilmente se converte em zidovudina 4 (também conhecido como azidotimidina ou AZT), uma importante droga antiviral, usada junto com outras no tratamento de AIDS.[16][17][18] Outro exemplo de aplicação farmacêutica de reação de Mitsunobu auxiliada por DEAD é a síntese de bis[(pivaloiloxi)metil [PIVz] derivado de 5’-monofosfato de 2’-deoxi-5-fluorouridina (FdUMP), o qual é um potente agente antitumor.[19]
Reação de Michael[editar | editar código-fonte]
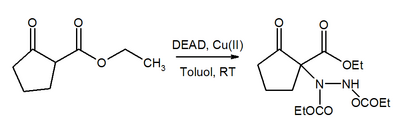
O grupo azo em DEAD é um aceptor de Michael. na presença de um catalisador de cobre(II), DEAD auxilia a conversão de β-ceto ésteres aos correspondentes derivados de hidrazina.[20]
A substituição de ésteres de ácido borônico ocorre similarmente:[21]
Outras reações[editar | editar código-fonte]
DEAD é um componente eficiente nas reações de Diels-Alder e em química click, por exemplo a síntese de biciclo[2.1.0]pentano, o qual origina-se de Otto Diels.[22] Tem sido também usado para gerar adutos aza-Baylis-Hillman com acrilatos.[23]
DEAD pode ser usado para síntese de compostos heterocíclicos. Portanto, derivados pirazolina convertidos por condensação e cetonas α,β-insaturadas:[24]
Outra aplicação é o uso de DEAD como enófilo em reações eno:
DEAD pode ser usado para síntese de compostos heterocíclicos. Portanto, derivados pirazolina convertidos por condensação e cetonas α,β-insaturadas:[24]
Outra aplicação é o uso de DEAD como enófilo em reações eno:
Segurança[editar | editar código-fonte]
DEAD é tóxico, sensível ao choque e à luz; pode explodir violentamente quando a sua forma não diluída é aquecida acima de 100 °C.[2][3][25] Envio por via aérea de azodicarboxilato de dietilo puro é proibido nos Estados Unidos, sendo seu transporte realizado em solução, tipicamente a aproximadamente 40% de DEAD em tolueno.[26] Alternativamente, DEAD é transportado e estocado em partículas de poliestireno de 100–300 mesh em uma concentração de aproximadamente 1 mmol/g.[3] A média ponderada no tempo do valor limite para exposição ao DEAD sobre uma típica semana de trabalho de 40 horas é 50 partes por milhão; isso é, DEAD apresenta metade de toxicidade, e.g., monóxido de carbono.[27] Riscos de segurança resultaram em declínio rápido do uso de DEAD e sua substituição com DIAD e outros compostos similares.
Referências
- ↑ Diethyl azo diformate. Webbook.nist.gov (1972-07-28). Retrieved on 2011-03-15.
- ↑ a b Safety (MSDS) data for diethyl azodicarboxylate. Msds.chem.ox.ac.uk. Retrieved on 2011-03-15.
- ↑ a b c d e W. L. F. Armarego; Christina Li Lin Chai (22 de maio de 2009). Purification of laboratory chemicals. [S.l.]: Butterworth-Heinemann. pp. 124–. ISBN 978-1-85617-567-8. Consultado em 12 de março de 2011
- ↑ Caroline Cooper (23 de julho de 2010). Organic Chemist's Desk Reference. [S.l.]: CRC Press. pp. 109–. ISBN 978-1-4398-1164-1. Consultado em 12 de março de 2011
- ↑ A abreviatura DEAD é algumas vezes usada para outra substância, o acetilenodicarboxilato de dietilo, diethyl acetylenedicarboxylate. P. N. Preston (1980). Benzimidazoles and congeneric tricyclic compounds. [S.l.]: John Wiley and Sons. pp. 475–. ISBN 978-0-471-08189-0. Consultado em 12 de março de 2011
- ↑ Barbara., Czakó, (2009). Strategic applications of named reactions in organic synthesis : background and detailed mechanisms ; 250 named reactions. [S.l.]: Elsevier. ISBN 9780123694836. OCLC 634820219
- ↑ a b Yoneda, Fumio; Suzuki, Kunio; Nitta, Yoshihiro (1967). «A new hydrogen-abstracting reaction with diethyl azodicarboxylate». The Journal of Organic Chemistry. 32 (3): 727–729. ISSN 0022-3263. doi:10.1021/jo01278a049
- ↑ Kelmara K. Kelly (2009) Novel isotope effects and organic reaction mechanisms, PhD thesis, Texas A&M University, p. 81
- ↑ a b Kauer, J. C. «Diethyl azodicarboxylate». Org. Synth.; Coll. Vol., 4
- ↑ Fumio Yoneda; Kunio Suzuki; Yoshihiro Nitta (1966). «A New Hydrogen-Abstracting Reaction with Diethyl Azodicarboxylate». J. Am. Chem. Soc. 88 (10): 2328. doi:10.1021/ja00962a051
- ↑ L. A. Paquette, ed. (1995). Encyclopedia of Reagents for Organic Synthesis. 3. Chichester: Wiley. p. 1790
- ↑ Rabjohn, N. «Diethyl azodicarboxylate». Org. Synth.; Coll. Vol., 3
- ↑ Mitsunobu, O.; Yamada, Y. (1967). «Preparation of Esters of Carboxylic and Phosphoric Acid via Quaternary Phosphonium Salts». Bull. Chem. Soc. Japan. 40 (10): 2380–2382. doi:10.1246/bcsj.40.2380
- ↑ Mitsunobu, Oyo (1981). «The Use of Diethyl Azodicarboxylate and Triphenylphosphine in Synthesis and Transformation of Natural Products». Synthesis: 1–28. doi:10.1055/s-1981-29317
- ↑ More than 4,300 citations by March 2011 according to Web of Science
- ↑ Czernecki, Stanislas and Valery, Jean-marc "Process for preparing AZT (3'-azido-3'-deoxy-thymidine) and related compounds" Patente E.U.A. 5 124 442 issued 23 June 1992
- ↑ Czernecki, Stanislas; Valéry, Jean-Marc (1991). «An Efficient Synthesis of 3′-Azido-3′-deoxythymidine (AZT)». Synthesis. 1991 (03). 239 páginas. doi:10.1055/s-1991-26434
- ↑ Dueholm, Kim L.; Aly, Youssef L.; Jørgensen, Per T.; El-Barbary, Ahmed A.; Pedersen, Erik B.; Nielsen, Claus (1993). «Convergent synthesis of 2′,3′-dideoxy-3′-methylthio and 2′,3′-dideoxy-3′-mercapto nucleosides and their disulfide analogues — Potential anti-HIV agents». Monatshefte für Chemie - Chemical Monthly. 124. 37 páginas. doi:10.1007/BF00808508
- ↑ Farquhar, David; Khan, Saeed; Srivastva, Devendra N.; Saunders, Priscilla P. (1994). «Synthesis and Antitumor Evaluation of Bis[(pivaloyloxy)methyl] 2'-Deoxy-5-fluorouridine 5'-Monophosphate (FdUMP): A Strategy To Introduce Nucleotides into Cells». Journal of Medicinal Chemistry. 37 (23): 3902–9. PMID 7966151. doi:10.1021/jm00049a009
- ↑ Comelles, C.; et al. (2004). «Ionic and Covalent Copper(II)-Based Catalysts for Michael Additions. The Mechanism». J. Org. Chem. 69 (20): 6834. doi:10.1021/jo049373z
- ↑ Takeshi Uemura; Naoto Chatani (2005). «Copper Salt Catalyzed Addition of Arylboronic Acids to Azodicarboxylates». J. Org. Chem. 70 (21): 8631. doi:10.1021/jo051387x
- ↑ Gassman PG, Mansfield KT (1969). «BICYCLO[2.1.0]PENTANE». Organic Syntheses. 49. 1 páginas. ISSN 0078-6209. doi:10.15227/orgsyn.049.0001
- ↑ Shi, Min; Zhao, Gui-Ling (2004). «Aza-Baylis–Hillman reactions of diisopropyl azodicarboxylate or diethyl azodicarboxylate with acrylates and acrylonitrile». Tetrahedron. 60 (9): 2083–2089. doi:10.1016/j.tet.2003.12.059
- ↑ a b Vijay Nair; Smitha C. Mathew; Akkattu T. Biju; Eringathodi Suresh (2007). «A Novel Reaction of the "Huisgen Zwitterion" with Chalcones and Dienones: An Efficient Strategy for the Synthesis of Pyrazoline and Pyrazolopyridazine Derivatives». Angew. Chem. Int. Ed. 46 (12): 2070–2073. PMID 17286329. doi:10.1002/anie.200604025
- ↑ G. C. Barrett (1999). Amino acid derivatives: a practical approach. [S.l.]: Oxford University Press. pp. 119–. ISBN 978-0-19-855853-8. Consultado em 12 de março de 2011
- ↑ Diethyl Azodicarboxylate in Chemical Synthesis. Sigmaaldrich.com. Retrieved on 2011-03-15.
- ↑ Livius Cotarca; Heiner Eckert (2004). Phosgenations—a handbook. [S.l.]: Wiley-VCH. p. 42. ISBN 978-3-527-29823-5. Consultado em 12 de março de 2011