Cianoidrinas
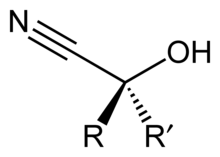
Uma cianoidrina ou hidroxinitrila é uma função orgânica à qual pertencem compostos orgânicos nos quais um grupo cianeto e uma hidroxila estão ligados ao mesmo átomo de carbono. Sua fórmula geral é R2C(OH)CN, em que R pode ser um H, um substituinte alquila ou um substituinte arila. As cianoidrinas são precursores industrialmente importantes dos ácidos carboxílicos e de alguns aminoácidos. Elas podem ser formadas pela reação de uma cetona ou um aldeído com cianeto de hidrogênio (HCN) na presença de cianeto de sódio (NaCN) em excesso como catalisador:[1]
Nessa reação, o íon CN- nucleofílico ataca o carbono carbonílico eletrofílico da cetona ou do aldeído, sucedendo a protonação pelo HCN, a qual regenera o ânion cianeto. As cianoidrinas também podem ser preparadas pelo deslocamento do sulfito por sais cianetos:[2]
As cianoidrinas são intermediários na síntese de aminoácidos de Strecker. Em meio aquoso ácido, eles são hidrolisados ao α-hidroxiácido.
Cianoidrinas de acetona[editar | editar código-fonte]
São geradas como um intermediário na produção industrial de metacrilato de metila.[3] No laboratório, esse líquido serve como fonte de HCN, que é inconvenientemente volátil.[4] Assim, a cianoidrina de acetona pode ser usada para a preparação de outras cianoidrinas, para a transformação de HCN em aceptores de Michael e para a formilação de arenos. O tratamento desta cianoidrina com hidreto de lítio fornece cianeto de lítio anidro:

Métodos de preparo[editar | editar código-fonte]
Inicialmente, as cianoidrinas eram preparadas pela adição de HCN e de um catalisador (base ou enzima) ao carbono carbonílico correspondente.[5] Em escala laboratorial, o uso de HCN — tóxico — é amplamente desaconselhado. Por isso, outros reagentes de cianação menos perigosos são procurados. A formação in situ de HCN pode ser realizada usando precursores como cianoidrina de acetona. Alternativamente, derivados de ciano-silil, como TMS-CN, permitem a cianação e a proteção em uma etapa sem a necessidade de HCN.[6] Procedimentos semelhantes baseados na formação de éster, fosfato e carbonato foram relatados.[7][8][9]

Outras cianoidrinas[editar | editar código-fonte]
A mandelonitrila, com fórmula molecular C6H5CH(OH)CN, ocorre em pequenas quantidades nos caroços de algumas frutas. Glicosídeos cianogênicos relacionados são conhecidos, como amigdalina.[1]
A glicolonitrila, também chamada de hidroxiacetonitrila ou cianoidrina de formaldeído, é o composto orgânico de fórmula molecular HOCH2CN. É a cianoidrina mais simples, sendo derivada do formaldeído.[10]
-
glicolonitrila
-
cianoidrina de acetona
-
mandelonitrila
Referências
- ↑ a b David T. Mowry (1948). «The Preparation of Nitriles». Chem. Rev. 42 (2): 189–283. PMID 18914000. doi:10.1021/cr60132a001
- ↑ Corson, B. B.; Dodge, R. A.; Harris, S. A.; Yeaw, J. S. (1941). «Mandelic Acid». Org. Synth.; Coll. Vol., 1
- ↑ William Bauer, Jr. "Methacrylic Acid and Derivatives" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_441. Article Online Posting Date: June 15, 2000
- ↑ Haroutounian, S. A. "Acetone Cyanohydrin" Encyclopedia of Reagents for Organic Synthesis 2001, John Wiley & Sons. doi:10.1002/047084289X.ra014
- ↑ North, M.; Usanov, D. L.; Young, C. Lewis Acid Catalyzed Asymmetric Cyanohydrin Synthesis. Chem. Rev. 2008, 108 (12), 5146–5226. doi:10.1021/cr800255k.
- ↑ Lidy, W.; Sundermeyer, W. Spaltungsreaktionen Des Trimethylsilylcyanids, Eine Neue Darstellungsmethode Für O-(Trimethylsilyl)Cyanhydrine. Chem. Ber. 1973, 106 (2), 587–593. doi:10.1002/cber.19731060224
- ↑ Scholl, M.; Lim, C. K.; Fu, G. C. Convenient and Efficient Conversion of Aldehydes to Acylated Cyanohydrins Using Tributyltin Cyanide as a Catalyst. J. Org. Chem. 1995, 60 (19), 6229–6231. doi: 10.1021/jo00124a052.
- ↑ Yoneda, R.; Harusawa, S.; Kurihara, T. Cyano Phosphate: An Efficient Intermediate for the Chemoselective Conversion of Carbonyl Compounds to Nitriles. J. Org. Chem. 1991, 56 (5), 1827–1832. doi: 10.1021/jo00005a031.
- ↑ Juhl, M.; Petersen, A. R.; Lee, J.-W. CO2‐Enabled Cyanohydrin Synthesis and Facile Iterative Homologation Reactions. Chem. – A Eur. J. 2020. doi: 10.1002/chem.202003623.
- ↑ Gaudry, R. (1955). «Glycolonitrile». Org. Synth.; Coll. Vol., 3




