Dopamina beta-hidroxilase
| dopamine beta-hydroxylase | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomes alternativos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| IDs externos | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
A dopamina beta-hidroxilase (DBH), também conhecida como dopamina beta-mono-oxigenase, é uma enzima presente em seres humanos, responsável principalmente pela conversão de dopamina em norepinefrina/noradrenalina.

Os três substratos dessa enzima são a dopamina (3,4-di-hidroxifenetilamina), vitamina C (ácido ascórbico) e O 2, enquanto os seus três produtos são a noradrenalina, desidroascorbato e H2O.
A DBH é uma oxigenase que contêm 290 kDa de cobre, consistindo de quatro subunidades idênticas, e a sua atividade requer a vitamina c como cofator.[1]
É a única enzima envolvida na síntese de neurotransmissores de pequenas moléculas que está ligada à membrana, tornando a norepinefrina o único transmissor conhecido sintetizado dentro das vesículas. É expresso em terminais nervosos noradrenérgicos do sistema nervoso central e periférico, bem como em células da medula adrenal.
Mecanismo de catálise[editar | editar código-fonte]
Com base nas observações do que acontece quando não há substrato ou oxigénio, as etapas seguintes parecem constituir a reação de hidroxilação.[2][3]
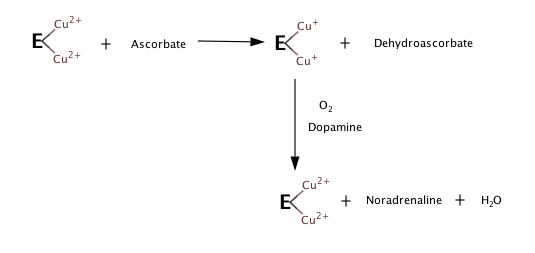
Embora detalhes do mecanismo da DBH ainda não tenham sido confirmados, a DBH é homóloga a outra enzima, α-hidroxilação mono-oxigenase de peptidilglicina (PHM). Como o DBH e o PHM compartilham estruturas semelhantes, é possível modelar o mecanismo DBH com base no que é conhecido sobre o mecanismo PHM.[4]

Especificidade do Substrato[editar | editar código-fonte]
A dopamina beta-hidroxilase catalisa a hidroxilação não só da dopamina mas também de outros derivados da feniletilamina, quando disponíveis. O requisito mínimo parece ser um anel de benzeno com uma cadeia lateral de dois carbonos que termina em um grupo amino.[5]
Significado clínico[editar | editar código-fonte]
A DBH contribui principalmente para a biossíntese de catecolaminase traços de aminas. Também participa no metabolismo de xenobióticosrelacionados com essas substâncias; por exemplo, a enzima DBH humana catalisa a beta-hidroxilação de anfetaminae para-hidroxianfetamina, produzindo norefedrinae para-hidroxinorefedrina,respectivamente.[6][7][8]
A DBH têm sido implicada como um fator nas condições associadas à tomada de decisão e drogas aditivas, por exemplo, alcoolismo[9] e tabagismo,[10]transtorno do déficit de atenção e hiperatividade,[11]esquizofrenia,[12] e doença de Alzheimer.[13] A insuficiência desta enzima é chamada deficiência de dopamina beta hidroxilase.
Referências
- ↑ «Dopamine beta-hydroxylase in health and disease». Critical Reviews in Clinical Laboratory Sciences. 12. PMID 6998654. doi:10.3109/10408368009108731
- ↑ «The Mechanism of Action of Dopamine beta-Hydroxylase.». Advances in Chemistry. 77, chapter 73. doi:10.1021/ba-1968-0077.ch073
- ↑ «An electron paramagnetic resonance study of 3,4-dihydroxyphenylethylamine beta-hydroxylase». The Journal of Biological Chemistry. 241. PMID 4287853
- ↑ «New insights into copper monooxygenases and peptide amidation: structure, mechanism and function». Cellular and Molecular Life Sciences. 57. PMID 11028916. doi:10.1007/pl00000763
- ↑ «The Mechanism of Action of Dopamine beta-Hydroxylase.». Advances in Chemistry. 77, chapter 73. doi:10.1021/ba-1968-0077.ch073
- ↑ Glennon RA (2013). «Phenylisopropylamine stimulants: amphetamine-related agents». Foye's principles of medicinal chemistry. [S.l.: s.n.] ISBN 9781609133450
- ↑ «Dopamine-beta-hydroxylase. Stereochemical course of the reaction» (PDF). J. Biol. Chem. 249. PMID 4809526
- ↑ «Human serum dopamine-β-hydroxylase. Relationship to hypertension and sympathetic activity». Circ. Res. 32. PMID 4713201. doi:10.1161/01.RES.32.5.594
- ↑ «Functional polymorphism of the dopamine β-hydroxylase gene is associated with increased risk of disulfiram-induced adverse effects in alcohol-dependent patients». Journal of Clinical Psychopharmacology. 32. PMID 22760354. doi:10.1097/jcp.0b013e31825ddbe6
- ↑ «Association between dopamine beta hydroxylase rs5320 polymorphism and smoking behaviour in elderly Japanese». Journal of Human Genetics. 57. PMID 22513716. doi:10.1038/jhg.2012.40
- ↑ «Analysis of polymorphisms in the dopamine beta hydroxylase gene: association with attention deficit hyperactivity disorder in Indian children». Indian Pediatrics. 42. PMID 15767706
- ↑ «Linkage analysis of plasma dopamine β-hydroxylase activity in families of patients with schizophrenia». Human Genetics. 130. PMC 3193571
 . PMID 21509519. doi:10.1007/s00439-011-0989-6
. PMID 21509519. doi:10.1007/s00439-011-0989-6
- ↑ «The dopamine β-hydroxylase -1021C/T polymorphism is associated with the risk of Alzheimer's disease in the Epistasis Project». BMC Medical Genetics. 11. PMC 2994840
 . PMID 21070631. doi:10.1186/1471-2350-11-162
. PMID 21070631. doi:10.1186/1471-2350-11-162
Leitura adicional[editar | editar código-fonte]
- Friedman S, Kaufman S (Dezembro de 1965). «3,4-dihydroxyphenylethylamine beta-hydroxylase. Physical properties, copper content, and role of copper in the catalytic activity». The Journal of Biological Chemistry. 240 (12): 4763–73. PMID 5846992
- Levin EY, Levenberg B, Kaufman S (1960). «The enzymatic conversion of 3,4-dihydroxyphenylethylamine to norepinephrine». J. Biol. Chem. 235: 2080–2086

