Processo Leblanc
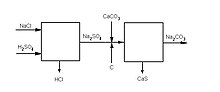
O Processo Leblanc é um processo industrial para a obtenção de carbonato de sódio que caiu em desuso ao fim do século XIX, desenvolvido pelo Químico Francês Nicolas Leblanc. O processo consiste primeiramente da produção de sulfato de sódio a partir de cloreto de sódio e da posterior reação deste com carbonato de cálcio, produzindo assim o carbonato de sódio. Este processo caiu em desuso com o tempo, sendo substituído pelo Processo Solvay, menos poluente e mais barato.
O ácido clorídrico (HCl) produzido pelo processo Leblanc era uma grande fonte de poluição atmosférica, e o subproduto sulfeto de cálcio (CaS) também trazia complicações para descarte. Entretanto, manteve-se como o mais usado método de produção de carbonato de sódio até o fim da década de 1880.[1][2]
Panorama Histórico[editar | editar código-fonte]
Tradicionalmente extraídos a partir de cinzas de diversas plantas, o carbonato de sódio e o carbonato de potássio são produtos químicos de extrema importância, sendo utilizados nas indústrias de vidro, sabão, papel, têxtil, entre outras. Porém, com o forte desmatamento europeu no século 18, este método de obtenção se tornou inviável, obrigando assim a sua importação, principalmente da Espanha, Ilhas Canárias e Egito.
Dadas estas circunstâncias, em 1783 foi oferecido pelo Rei Luís XVI da França e pela Academia Francesa de Ciências um prêmio de 2400 livres para aquele que desenvolvesse um método para a obtenção de carbonato de cálcio a partir de sal marinho. Nicolas Leblanc patenteou uma solução em 1791 e construiu, ainda no mesmo ano, uma usina em Saint-denis com produção de 320 toneladas por ano, mas acabou por nunca receber o prêmio, negado pela Revolução Francesa.
O processo[editar | editar código-fonte]
Quimicamente[editar | editar código-fonte]

O Processo Leblanc é um processo por bateladas, que inicia com cloreto de sódio e, após várias etapas, produz carbonato de sódio.
A primeira etapa consiste na reação do cloreto de sódio com ácido sulfúrico, produzindo sulfato de sódio e liberação de ácido clorídrico.
Esta reação já era conhecida, descoberta pelo químico sueco Carl Wilhelm Scheele. A contribuição de Leblanc se deu na segunda etapa do processo, onde o sulfato de sódio é misturado com carbonato de cálcio e levado a combustão com o auxílio de coque. Nesta reação o carbono proveniente do coque é oxidado a CO2, o que reduz o sulfato a sulfeto e deixa para trás uma mistura negra de carbonato de sódio e sulfeto de cálcio.
Como o carbonato e o sulfeto de cálcio são insolúveis em água e o carbonato de sódio sim, este pode ser facilmente extraído da mistura através de uma lavagem, sendo obtido na forma sólida após a evaporação da água.
Industrialmente[editar | editar código-fonte]
Inicialmente o cloreto de sódio é dissolvido numa solução de ácido sulfúrico e aquecido brandamente. No processo original, neste etapa era perdido praticamente todo o ácido clorídrico produzido, liberado na atmosfera uma vez que tinha escasso valor comercial. Mais tardiamente, devido a valorização do ácido clorídrico e pressões contra a poluição, adaptou-se ao processo uma coluna de carvão vegetal, que absorve o ácido solubilizando-o em água, o que permite o seu aproveitamento.
Na etapa seguinte, da calcinação do sulfato de sódio, devem ser observadas algumas características dos insumos. O coque utilizado deve ter baixa percentagem de nitrogenio, que pode ocasionar a formação de cianetos, e o carbonato de cálcio deve ter pouco magnésio ou silíca. Uma vez misturados na proporção de 2:2:1 de sulfato de sódio, carbonato de cálcio e coque respectivamente, inicia-se a combustão a cerca de 1000 ºC.
A mistura negra resultante deve sofrer o processo de lavagem (lixiviação) imediatamente, para que o sulfeto não seja oxidado novamente a sulfato. São feitas então lavagens sucessivas, visando a máxima obtenção do produto.
A solução final é tratada então com borbulhamento de CO2, que precipita cálcio dissolvido e outras impurezas e volatiliza o sulfeto, liberado na forma de H2S. Por fim, seca-se a solução e se submete o sólido a recristalização, aumentando assim seu grau de pureza.
História Industrial[editar | editar código-fonte]
A primeira planta industrial foi criada por Leblanc em 1791, em Saint-Denis, com produção de 320 tons/ano. Porém, em 1794, com a Revolução Francesa, esta foi estatizada e os estudos de Leblanc tornados de domínio público. Em 1801 Napoleão devolveu-lhe a planta, mas, sem fundos para recuperá-la e competir com as outras indústrias de carbonato de sódio que já haviam se estabelecido, Leblanc acabou por cometer suicídio em 1806.
O processo espalhou-se e foi utilizado em diversos países europeus, mas foi na Inglaterra onde teve maior força, chegando ao ápice na década de 1870, quando a produção inglesa (cerca de 200,000 toneladas) era maior que a produção de todos os outros países somados.
Poluição[editar | editar código-fonte]
O principal problema do processo Leblanc eram os danos ao meio ambiente, para cada 8 toneladas de carbonato de sódio produzido, eram produzidos 7 toneladas de sulfeto de cálcio e liberados 5,5 toneladas de ácido clorídrico. O sulfeto de cálcio vinha na forma de um sólido preto, insolúvel e de forte odor, que era depositado em aterros, onde ia gradualmente liberando gás sulfídrico.
Por causa destas emissões nocivas, o processo Leblanc tornou-se alvo de pressões por parte da população e de legislação específica. Em 1863 foi publicado pelo parlamento inglês o Alkali Act, considerado a primeira legislação moderna sobre poluição do ar, que, entre outras atribuições, limitava a 5% a quantidade do ácido clorídrico produzido que poderia ser liberado na atmosfera. Para atender a esta legislação as indústrias adicionaram a torre de carvão, mas, uma vez que o ácido clorídrio ainda não tinha valor comercial, a solução produzida era simplesmente descartada em corpos d'água, matando as formas de vida aquáticas.
Na década de 1880 ainda foram descobertos métodos para recuperar o enxofre do resíduo de sulfeto de cálcio e para a transformação do ácido clorídrico em gás cloro, mas ainda assim o Processo Leblanc continuou sendo poluente e desvantajoso em relação ao Processo Solvay, já desenvolvido à época, e aos métodos eletrolíticos para a produçao de gás cloro.
Desuso[editar | editar código-fonte]
Com a criação, em 1861, do processo Solvay, que não utilizava ácido sulfúrico e produzia apenas cloreto de cálcio, que podia ser descartado no oceano, este revelou-se tanto economicamente melhor quanto menos poluente, o que levou ao declínio das plantas industriais baseadas no processo Leblanc. Nas últimas décadas do século XIX estas plantas passaram a ser centradas na produção de gás cloro, sendo o já não-lucrativo carbonato de sódio apenas um co-produto. Em 1900, 90% da produção mundial de carbonato de sódio já era feita através de plantas que utilizavam o processo Solvay, a última usina baseada em Leblanc foi a falência em 1920. Porém, sendo o método de Solvay ineficaz para a produção de carbonato de potássio, algumas plantas continuaram em funcionamento limitado produzindo-o por algum tempo.
Referências
- ↑ Clow, Archibald and Clow, Nan L. (1952). Chemical Revolution, (Ayer Co Pub, June 1952), pp. 65–90. ISBN 0-8369-1909-2.
- ↑ Kiefer, David M. (janeiro de 2002). «It was all about alkali». Today's Chemist at Work. 11 (1): 45–6


