Geometria molecular tetraédrica

Em uma geometria molecular tetraédrica, um átomo central está localizado no centro com quatro substituintes que estão localizados nos cantos de um tetraedro. Os ângulos de ligação são cos−1(−⅓) = 109.4712206...° ≈ 109.5° quando todos os quatro substituintes são iguais, como no metano (CH4),[1][2] bem como em seus análogos mais pesados. O metano e outras moléculas tetraédricas perfeitamente simétricas pertencem ao grupo de pontos Td, mas a maioria das moléculas tetraédricas possui menor simetria. Moléculas tetraédricas podem ser quirais.
Exemplos[editar | editar código-fonte]
Química do grupo principal[editar | editar código-fonte]

Além de praticamente todos os compostos orgânicos saturados, a maioria dos compostos de Si, Ge e Sn são tetraédricos. Frequentemente, as moléculas tetraédricas apresentam ligações múltiplas aos ligantes externos, como no tetróxido de xenônio (XeO4), o íon perclorato (ClO4−), o íon sulfato (SO42−) e o íon fosfato (PO43−). O trifluoreto de tiazilo (SNF 3) é tetraédrico, com uma ligação tripla de enxofre e nitrogênio.[3]
Outras moléculas têm um arranjo tetraédrico de pares de elétrons ao redor de um átomo central; por exemplo, amoníaco (NH3) com o átomo de nitrogênio cercado por três átomos de hidrogênio e um par solitário. No entanto, a classificação usual considera apenas os átomos ligados e não o par solitário, de modo que a amônia é realmente considerada piramidal. Os ângulos H–N–H são 107°, contraídos a partir de 109,5. Essa diferença é atribuída à influência do par solitário, que exerce uma influência repulsiva maior do que um átomo ligado.
Química dos metais de transição[editar | editar código-fonte]

Mais uma vez, a geometria é generalizada, principalmente nos complexos em que o metal tem configuração d0 ou d10. Os exemplos ilustrativos incluem tetraquis (trifenilfosfina) paládio (0) (Pd[P(C6H5)3]4), níquel de carbonilo (Ni(CO)4), e tetracloreto de titio (TiCl4). Muitos complexos com invólucros em D incompletos são geralmente tetraédricos, por exemplo, os tetra-halogenetos de ferro (II), cobalto (II) e níquel (II).
Estrutura de água[editar | editar código-fonte]
Na fase gasosa, uma única molécula de água tem um átomo de oxigênio cercado por dois átomos de hidrogênio e dois pares isolados, e a geometria H2O é descrita simplesmente como angular, sem considerar os pares livres não ligantes.
No entanto, na água líquida ou no gelo, os pares solitários formam ligações de hidrogênio com as moléculas de água vizinhas. O arranjo mais comum de átomos de hidrogênio em torno de um oxigênio é tetraédrico, com dois átomos de hidrogênio ligados covalentemente ao oxigênio e dois ligados por ligações de hidrogênio. Como as ligações de hidrogênio variam em comprimento, muitas dessas moléculas de água não são simétricas e formam tetraedros irregulares transitórios entre seus quatro átomos de hidrogênio associados.[4]
Estruturas bitetraédricas[editar | editar código-fonte]
Muitos compostos e complexos adotam estruturas bitetraédricas. Nesse motivo, os dois tetraedros compartilham uma vantagem comum. O dissulfeto de silício polimérico inorgânico apresenta uma cadeia infinita de tetraedros com borda compartilhada.
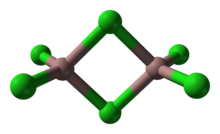
Exceções e distorções[editar | editar código-fonte]
A inversão do tetraédrico ocorre amplamente na química orgânica e dos grupos principais. A chamada inversão de Walden ilustra as conseqüências estereoquímicas da inversão no carbono. A inversão de nitrogênio na amônia também implica a formação transitória de NH3 planar.
Geometria tetraédrica invertida[editar | editar código-fonte]
As restrições geométricas em uma molécula podem causar uma distorção severa da geometria tetraédrica idealizada. Em compostos que apresentam geometria tetraédrica "invertida" em um átomo de carbono, todos os quatro grupos ligados a esse carbono estão em um lado de um avião.[5] O átomo de carbono encontra-se no ápice de uma pirâmide quadrada, com os outros quatro grupos nos cantos.[6][7]
Os exemplos mais simples de moléculas orgânicas que exibem geometria tetraédrica invertida são os menores propelanos, como o [1.1.1]propelano; ou mais geralmente o fenestrano ([3.3.3.3] fenestrano).[6][7] Tais moléculas são tipicamente tensionadas, resultando em maior reatividade.
Planarização[editar | editar código-fonte]
Um tetraedro também pode ser distorcido aumentando o ângulo entre duas das ligações. No caso extremo, achatar resultados. Para o carbono, esse fenômeno pode ser observado em uma classe de compostos chamados fenestranos.[carece de fontes]
Moléculas tetraédricas sem átomo central[editar | editar código-fonte]
Algumas moléculas têm uma geometria tetraédrica sem átomo central. Um exemplo inorgânico é tetrafósforo (P4) que tem quatro átomos de fósforo nos vértices de um tetraedro e cada um ligado a outros três. Um exemplo orgânico é o ciclobutadieno (C4H4), com quatro átomos de carbono ligados a cada um hidrogénio e os outros três átomos de carbono.
Veja também[editar | editar código-fonte]
Referências
- ↑ «Angle Between 2 Legs of a Tetrahedron». Maze5.net
- ↑ Brittin. «Valence Angle of the Tetrahedral Carbon Atom». J. Chem. Educ. 22. Bibcode:1945JChEd..22..145B. doi:10.1021/ed022p145
- ↑ Miessler, G. L.; Tarr, D. A. Inorganic Chemistry. Pearson/Prentice Hall 3rd ed. [S.l.: s.n.] ISBN 0-13-035471-6
- ↑ «"Tetrahedrality" and the Relationship between Collective Structure and Radial Distribution Functions in Liquid Water». J. Phys. Chem. B. 111: 5669–5679. 2007. doi:10.1021/jp068581n
- ↑ «Inverted geometries at carbon». Acc. Chem. Res. 17: 379–386. 1984. doi:10.1021/ar00107a001
- ↑ a b «C5H4: Pyramidane and Its Low-Lying Isomers». J. Phys. Chem. A. 105: 7745–7750. 2001. Bibcode:2001JPCA..105.7745K. doi:10.1021/jp011642r
- ↑ a b Lewars (1998). «Pyramidane: an ab initio study of the C5H4 potential energy surface». Journal of Molecular Structure: THEOCHEM. 423: 173–188. doi:10.1016/S0166-1280(97)00118-8
Ligações externas[editar | editar código-fonte]
- Exemplos de moléculas tetraédricas
- Visual Tetraédrico Animado
- Elmhurst College
- Exemplos moleculares interativos para grupos de pontos
- 3D Chem - Química, Estruturas e Moléculas 3D
- IUMSC - Centro de Estrutura Molecular da Universidade de Indiana]
- [1]
- Modelagem Molecular

