Molibdênio
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aparência | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
cinza metálico Fragmento de cristal de molibdênio de pureza 99,99%, e um cubo monocristal de 1 cm3 de alta pureza (99,999%) para comparação. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Informações gerais | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nome, símbolo, número | Molibdênio, Mo, 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série química | Metal de transição | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloco | 6 (6B), 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidade, dureza | 10280 kg/m3, 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Número CAS | 7439-98-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedade atómicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massa atómica | 95,96 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio atómico (calculado) | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raio covalente | 154±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuração electrónica | [Kr] 5s1 4d5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elétrons (por nível de energia) | 2, 8, 18, 13, 1 (ver imagem) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidação | 6, 5, 4, 3, 2, 1, -1, -2 (óxido ácido forte) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estrutura cristalina | cúbica centrada no corpo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriedades físicas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado da matéria | sólido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de fusão | 2436 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ponto de ebulição | 4912 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusão | 37,48 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporização | 598 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressão de vapor | 1 Pa a 2742 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diversos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Eletronegatividade (Pauling) | 2,16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 250 J/(kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Condutividade térmica | 138 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.º Potencial de ionização | 684,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.º Potencial de ionização | 1560 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.º Potencial de ionização | 2618 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.º Potencial de ionização | 4480 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos mais estáveis | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unidades do SI & CNTP, salvo indicação contrária. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
O molibdênio (português brasileiro) ou molibdénio (português europeu) é um elemento químico de símbolo Mo e número atômico 42. O nome é derivado do neolatim Molybdaenum, do grego antigo Μόλυβδος molybdos que significa chumbo, uma vez que seus minérios eram confundidos com os de chumbo.[1] Minerais de molibdênio são conhecidos ao longo da história, mas o elemento só foi descoberto (no sentido de diferenciação como uma nova entidade a partir dos sais minerais de outros metais) em 1778 por Carl Wilhelm Scheele. O metal foi isolado pela primeira vez em 1781 por Peter Jacob Hjelm.
O molibdênio não é encontrado naturalmente como um metal livre na Terra, mas em vários estados de oxidação em minerais. O elemento livre, que é um metal de cor prateada, tem o sexto maior ponto de fusão de todos os elementos conhecidos. Forma prontamente ligas estáveis e duras com o carbono, e por esta razão a maior parte da produção mundial do elemento (aproximadamente 80%) é na fabricação do aço, incluindo ligas resistentes e superligas.
A maioria dos compostos tem baixa solubilidade em água, porém o íon molibdato
MoO2−
4 e é formado quando minerais contendo molibdênio entram em contato com o oxigênio e água. Industrialmente, compostos químicos de molibdênio (aproximadamente 14% da produção mundial), são usados em aplicações em alta temperatura e pressão, como pigmentos e catalisadores.
Enzimas contendo molibdênio são de longe a forma mais comum de catálise utilizada por algumas bactérias para quebrar a ligação química do nitrogênio molecular atmosférico, permitindo a fixação do nitrogênio. Pelo menos 50 enzimas com molibdênio são conhecidas em bactérias e animais, embora apenas algumas bactérias e cianobactérias estejam envolvidas na fixação do nitrogênio. Estas nitrogenases contém molibdênio em uma forma diferente de outras enzimas, as quais contém molibdênio completamente oxidado incorporado em um cofator de molibdênio. Devido as diversas funções que várias enzimas com cofator de molibdênio, o elemento é requerido na dieta diária para todos os organismos eucariotas superiores, todavia não é requerido por todas as bactérias.
Características
[editar | editar código-fonte]Propriedades físicas
[editar | editar código-fonte]O molibdênio é um metal de transição de coloração branco prateado e com uma dureza de 5,5 na escala de Mohs; além disso, tem um ponto de fusão de 2163ºC, o sexto maior entre os elementos naturais. Tem um dos menores coeficientes de expansão térmica entre os metais utilizados comercialmente,[2] e sua resistência à tração em fios aumenta três vezes, de aproximadamente 10 para 30 GPa, quando o diâmetro é reduzido para ~50–100 nm para 10 nm.[3]
Compostos e química
[editar | editar código-fonte]| Oxidação Estado |
Example[4] |
|---|---|
| −2 |
Na2[Mo2(CO)10] |
| 0 | Mo(CO)6 |
| +1 |
Na[C6H6Mo] |
| +2 | MoCl2 |
| +3 |
Na3[Mo(CN)]6 |
| +4 | MoS2 |
| +5 | MoCl5 |
| +6 | MoF6 |

O molibdênio é um metal de transição com uma eletronegatividade de 2,16 na escala de Pauling e tem uma massa atômica padrão de 95,95 g/mol.[5][6] Não reage de modo visível com o oxigênio ou água a temperatura ambiente, e grande parte da oxidação ocorre em temperaturas superiores a 600 °C, resultando no trióxido de molibdênio:
- 2 Mo + 3
O2 → 2 MoO3
O trióxido é volátil e sublima em altas temperaturas. Isto previne a formação de uma camada protetora de óxido, que poderia impedir a oxidação do metal.[7] O molibdênio possui vários estados de oxidação, sendo o mais estável o +4 e +6 (em negrito na tabela). A química e os compostos demonstram mais similaridade com o tungstênio do que com o cromo. Um exemplo é a instabilidade dos compostos de molibdênio (III) e tungstênio (III) comparados a estabilidade dos compostos de cromo (III). O maior estado de oxidação é comum no óxido de molibdênio (VI), ao passo que o composto sulfurado normal é o dissulfeto de molibdênio MoS2.[8]
O óxido de molibdênio (VI) é solúvel em bases fortes alcalinas aquosas, formando molibdatos (MoO42−), que são oxidantes mais fracos que os cromatos mas demonstram uma tendência similar a formar oxiânions complexos pela condensação em valores de pH baixos, tais como [Mo7O24]6− and [Mo8O26]4−. Polimolibdatos podem incorporar outros íons em suas estruturas, formando polioxometalatos.[9] O heteropolimolibdato que contém fósforo, P[Mo12O40]3− é utilizado na espectroscopia do ultravioleta visível para a detecção do fósforo.[10] A faixa ampla de estados de oxidação do molibdênio é evidente na variedade de cloretos que forma:[8]
- Cloreto de Molibdênio (II) MoCl2 (amarelo)
- Cloreto de Molibdênio (III) MoCl3 (vermelho escuro)
- Tetracloreto de Molibdênio MoCl4 (preto)
- Cloreto de Molibdênio (V) MoCl5 (verde escuro)
- Cloreto de Molibdênio (VI) MoCl6 (marrom)
A estrutura do MoCl2 é composta de aglomerados de Mo6Cl84+ com quatro íons cloreto para compensar a carga.[8]
Assim como o cromo e outros metais de transição, o molibdênio pode formar ligações quádruplas, tais como no Mo2(CH3COO)4. Este composto pode ser transformado no Mo2Cl84−, que também tem uma ligação quádrupla.[8]
O estado de oxidação 0 é possível com o monóxido de carbono como ligante, tal como no molibdênio hexacarbonil, Mo(CO)6.[8]
História
[editar | editar código-fonte]
A Molibdenita - o principal minério do qual o molibdênio é extraído - era antigamente conhecida como Molibdena, que era confundida às vezes utilizada como grafite. A Molibdenita pode ser utilizada para escurecer a superfície ou como um sólido lubrificante, assim como o grafite.[12] Mesmo quando a Molibdenita era distinguível do grafite, era ainda confundida com o minério de chumbo galena; o nome do elemento veio do grego antigo Μόλυβδος molybdos, que significa chumbo.[2] Tem sido proposto que a palavra grega em si é uma palavra emprestada das línguas da região da Anatólia, atual Turquia.[13]
Apesar de uma liga de aço com molibdênio em uma espada japonesa do século XIV ter sido relatada, a técnica não foi amplamente empregada e posteriormente foi perdida.[14][15] Em 1754 no Ocidente, Bengt Andersson Qvist examinou a Molibdenita e constatou que ela não continha chumbo, e portanto não era o mesmo que a galena.[16]
Em 1778 o químico sueco Carl Wilhelm Scheele enunciou firmemente que a molibdenita não era de fato nem galena ou grafite.[11][17] Ao invéis disso, Scheele foi adiante e corretamente propôs que a Molibdenita era um minério de um novo elemento distinto, nomeado molybdenum para o mineral que o contém, e a partir do qual poderia ser isolado. Peter Jacob Hjelm isolou com sucesso o elemento a partir de uma redução com carbono e óleo de linhaça em 1781.[2][18]
Por aproximadamente um século após seu isolamento, o molibdênio não teve uso industrial em função de sua escassez relativa, dificuldade de extração do metal puro e a falta de maturidade das técnicas metalúrgicas apropriadas.[19][20][21] As primeiras ligas de aço com molibdênio demonstraram ser promissoras pelo aumento da dureza, mas esforços para manufaturá-las em larga escala foram travadas pelos resultados inconsistentes e a tendência de fragilidade e recristalização. Em 1906, William D. Coolidge solicitou uma patente para uma forma de molibdênio dúctil, para o seus uso em fornos de alta temperatura e como um suporte para o filamento de tungstênio em lâmpadas de bulbo; a oxidação e degradação requeriu que o molibdênio fosse fisicamente selado ou contido em um gás inerte.[22] Em 1913, Frank E. Elmore desenvolveu um processo de flotação para recuperar a molibdenita de minérios, método que permanece como o processo principal de isolamento do mineral.[23]
Durante a primeira Guerra Mundial, a demanda pelo elemento aumentou severamente; era usado tanto na blindagem de veículos quanto como um substituto para o tungstênio no aço rápido. Alguns tanques britânicos eram protegidos por 75 mm de blindagem de aço Hadfield porém isto se mostrou ineficiente. As blindagens foram substituídas com ligas de aço com molibdênio com 25 mm de espessura para aumento de velocidade dos veículos, maior facilidade de manobra e melhor proteção.[2] Os alemães também utilizaram molibdênio em ligas para a artilharia pesada. Isto foi porque o aço tradicional se fundia com o calor produzido para o lançamento de um projétil de uma tonelada.[24] Após a guerra, a demanda diminuiu até que avanços na metalurgia permitissem o desenvolvimento de aplicações de tempos de paz. Na Segunda Guerra, o molibdênio ganhou novamente importância estratégica como um substituto para o Tungstênio em ligas metálicas.[25]
Ocorrência e produção
[editar | editar código-fonte]
O molibdênio é o 54º elemento mais abundante na crosta terrestre, e o 25º mais abundante nos oceanos, com uma concentração média de 10 partes por bilhão; e é o 42º elemento mais abundante no Universo.[2][26] Parte do molibdênio da Terra se originou no sistema solar externo.[27] A missão russa Luna 24 descobrindo um grão de molibdênio (1 × 0.6 µm) em um fragmento de piroxeno retirado da Mare Crisum na Lua.[28] A raridade relativa do molibdênio na crosta terrestre é compensada pela sua concentração em uma variedade de minérios insolúveis em água, Às vezes combinado com o enxofre, do mesmo modo que o cobre, que também é encontrado. Ainda que o elemento seja encontrado em minerais como a wulfenita (PbMoO4) e a Powellita (CaMoO4), a principal fonte comercial é a molibdenita (MoS2). O molibdênio é extraído com minério principal, e também é recuperado como um subproduto durante a extração do cobre e tungstênio.[1]
Historicamente a mina de Knaben, aberta em 1885 no sul da Noruega, foi a primeira dedicada a extração do molibdênio. Ficou fechada de 1973 a 2007, mas foi reaberta.[29] A produção mundial de molibdênio foi de 250 mil toneladas em 2011, sendo os maiores produtores a China (94.000 t), Estados Unidos (64.000 t), Chile (38.000 t), Peru (18.000 t) e México (12.000 t). As reservas mundiais estão estimadas em 10 milhões de toneladas, e em maior parte estão na China (4.3 Mt), Estados Unidos (2.7 Mt) e Chile (1.2 Mt). Por continente, 93% da produção é dividia em partes quase equivalentes entre América do Norte, América do Sul e China. A Europa e o resto da Ásia (principalmente Armênia, Rússia, Irã e Mongólia) produzem o remanescente.[30]
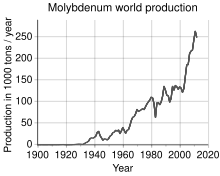
No processamento da molibdenita, ela primeiramente é aquecida até 700°C e o sulfeto é oxidado para o óxido de molibdênio (IV) pelo ar:[8]
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
O minério oxidado é ou aquecido para 1100°C para sublimação, ou lixiviado com Amônia, que reage com o óxido para formar molibdatos solúveis em água:
- MoO3 + 2 NH4OH → (NH4)2(MoO4) + H2O
O cobre, uma impureza da molibdenita, é menos solúvel em amônia. Para a remoção completa da solução, é precipitado com sulfeto de hidrogênio.[8]
O molibdênio puro é produzido pela redução do óxido com hidrogênio, enquanto o molibdênio para a produção do aço é reduzido pela reação aluminotérmica com adição do ferro para produzir o ferromolibdênio, que comumente tem 60% de molibdênio.[8][31]
O molibdênio tem um valor aproximado de $30 mil por tonelada (preço de Agosto de 2009). Manteve um valor próximo de $10 mil por tonelada de 1977 até 2003, e alcançou, devido a um pico de demanda, um preço de $103 mil por tonelada em junho de 2005.[32] Em 2008, a London Metal Exchange anunciou que o elemento seria tratado como um commodity no câmbio.[33]
| 1. | 130.000 | |
| 2. | 56.000 | |
| 3. | 43.600 | |
| 4. | 30.400 | |
| 5. | 16.600 | |
| 6. | 5.000 | |
| 7. | 3.900 | |
| 8. | 3.500 | |
| 9. | 2.800 | |
| 10. | 1.800 |
Fonte: USGS.
Aplicações
[editar | editar código-fonte]Ligas
[editar | editar código-fonte]Aproximadamente 86% da produção de molibdênio é utilizada em aplicações metalúrgicas tais como ligas, com o resto sendo usado como compostos em aplicações químicas, com 35% destinado a indústria de aços estruturais, 25% de aço inoxidável, 9% em aços rápidos e ferramentas, 6% em ferro fundido, 6% na forma do metal e 5% em superligas.[34]
A capacidade do molibdênio de resistir a temperaturas extremas sem expandir significativamente ou amolecer o torna útil em aplicações que envolvem calor intenso, incluindo fabricação de blindagens, partes de aeronaves, contatos elétricos, motores industriais e filamentos.[2][35][36]
A maioria das ligas de aço de alta resistência (por exemplo aços 41xx) contém de 0,25% a 8% de molibdênio.[1] Apesar das pequenas proporções, mais de 43 mil toneladas são usadas como um agente ligante a cada ano em aços inoxidáveis, ferramentas em aço, ferro fundido e superligas para alta temperatura.[26]
O molibdênio também é usado em ligas de aço devido a sua alta resistência à corrosão[37] e soldabilidade.[26][30]
Por causa de sua baixa densidade e preço mais estável, o molibdênio é algumas vezes utilizado no lugar do tungstênio.[26] Um exemplo é a série M de aços rápidos tais como M2, M4 e M42 em substituição a série T de aços rápidos, que contém tungstênio. O molibdênio pode ser implementando como um agente ligante e como uma cobertura de resistência a chama para outros metais. Embora o ponto de fusão seja 2623 ºC, o elemento rapidamente se oxida a temperatura superiores a 760 ºC tornando mais adequado para uso em ambiente com vácuo.[35]
TZM (Mo (~99%), Ti (~0.5%), Zr (~0.08%) e algum C) é uma superliga resistente a corrosão que resiste a sais de fluoretos fundidos a temperaturas superiores a 1300 ºC. Tem aproximadamente duas vezes a resistência do molibdênio puro, e é mais dútil e soldável, ademais em testes resistiu a corrosão de um sal eutético padrão e vapores de sais usados em reatores de sais fundidos por 1100 horas com pouca corrosão de difícil medição.[38][39]
Outras ligas baseadas em molibdênio e que não contém ferro têm aplicações limitadas. Por exemplo, por causa da resistência a corrosão contra o zinco fundido, ambos molibdênio puro e liga molibdênio/tungstênio (70%/30%) são usadas em tubulações, agitadores e bombas que estão em contato com o zinco fundido.[40]
Outras aplicações com o elemento puro
[editar | editar código-fonte]O pó do molibdênio é utilizado como um fertilizante para algumas plantas, tais como a couve-flor.[26] Na forma elemental também é utilizado em analisadores de NO, NO2, NOx para controle da poluição em plantas elétricas. A 350 ºC o elemento age como um catalisador para NO2/NOx para formar somente moléculas NO para leituras no infravermelho.[41] Anodos de molibdênio substituem o tungstênio em certas fontes de raio-X em baixa voltagem, para usos especializados como em mamografias.[42] O isótopo radioativo Molibdênio-99 é utilizado para gerar o Tecnécio-99m, que é utilizado para a imagiografia médica. O isótopo é armazenado e manuseado na forma de molibdatos.[43][44]
Compostos
[editar | editar código-fonte]O dissulfeto de molibdênio (MoS2) é usado como um lubrificante sólido e agente anti-desgastante em altas pressões e temperaturas. Ele forma um filme resistente na superfície metálica e é um aditivo comum para graxas (em alta temperatura e pressão) - no caso de uma falha catastrófica da graxa, uma camada fina de molibdênio previne o contato das partes lubrificadas.[45] Também possui propriedades semicondutoras como vantagens distintas sobre o tradicional silicone ou aplicações eletrônicas com o grafeno.[46] MoS2 também é usado como um cataliSador no hidrocraqueamento de frações do petróleo que contém nitrogênio, enxofre e oxigênio.[47]
Outros compostos, incluem:
- Dissiliceto de molibdênio (MoSi2): cerâmica condutora elétrica com uso principal em elementos aquecedores operando em temperaturas superiores a 1500 °C em ar.[48]
- Trióxido de molibdênio (MoO3): usado como um adesivo entre metais e esmaltes. O Molibdato de Chumbo co-precipitado com cromato de chumbo e sulfato de chumbo é um pigmento laranja brilhante usado em cerâmicas e plásticos.[49] Os catalisadores de óxidos mistos à base de molibdénio são utilizados para reacções de oxidação selectivas. As aplicações típicas são a oxidação de propano, propileno ou acroleína em ácido acrílico.[50][51][52][53]
Papel biológico
[editar | editar código-fonte]Bioquímica
[editar | editar código-fonte]Nitrogenases
[editar | editar código-fonte]O papel mais importante do Molibdênio em seres vivos é como um heteroátomo em sítios atívos de certas enzimas.[54] Na fixação do nitrogênio em certas bactérias,[55][56] a enzima nitrogenase, que é envolvida na etapa final da redução do nitrogênio molecular, normalmente contém o molibdênio no sítio ativo embora a substituição deste por ferro e vanádio também seja conhecida.[57]
A reação que a enzima nitrogenase realiza é:
Com prótons e elétrons da cadeia de transporte de eléltros, o nitrogênio é reduzido a amônia e gás hidrogênio livre. Este é um processo que requer energia, exigindo a hidrólise do ATP no ADP mais um fosfato livre (Pi).
Em 2008, foi evidenciado que a escassez de molibdênio nos oceanos primitivos foi um fator limitante por aproximadamente dois bilhões de anos até a posterior evolução da vida eucariota (que incluem todas as plantas e animais) pois estas não conseguem fixar o nitrogênio, e portanto devem adquirir a maior parte do nitrogênio oxidado adequado para a criação de compostos orgânicos nitrogenados, ou os próprios organismos (como proteínas) a partir de bactérias procariotas.[58][59][60] A escassez de molibdênio resultoru em uma falta relativa de oxigênio nos oceanos primitivos. A maior parte dos compostos de molibdênio tem baixa solubilidade em água, mais o íon molibdato MoO42− é solúvel e é formado quando minerais contendo molibdênio entram em contato com o oxigênio e água. Uma vez que o oxigênio feito pela vida primitiva foi produzido na água do mar, ajudou a dissolver o molibdênio em molibdatos solúveis a partir dos minerais no fundo do oceano, tornando possível pela primeira vez a fixação do nitrogênio por bactérias, e permitindo a elas prover mais compostos de nitrogênio fixado utilizáveis por formas superiores de vida. Em 2013, foi sugerida a possibilidade que o boro e o molibdênio catalisaram a produção do RNA em Marte com a vida sendo transferida para a terra por um meteorito por volta de três bilhões de anos atrás.[61]
Apesar do oxigênio tivesse promovido a fixação do nitrogênio ao tornar o molibdênio solúvel em água, também envenena diretamente as enzimas de nitrogenase. Assim na história antiga da Terra, após o oxigênio ter alcançado largas quantidades na água e no ar, organismos que continuaram a fixar o nitrogênio em condições aeróbicas precisaram isolar e proteger suas enzimas fixadoras de nitrogÊnios em heterocistos, ou estruturas protetoras similares do oxigênio disponível. Esta isolação estrutural nas reações de fixação do nitrogênio em organismos aeróbicos continua até a atualidade.

Enzimas com cofator de molibdênio
[editar | editar código-fonte]Embora o molibdênio forme compostos com várias moléculas orgânicas, incluindo carboidratos e aminoácidos, ele é transportado através do corpo humano como um molibdato MoO42−.[62] Até 2002, pelo menos 50 enzimas contendo molibdênio eram conhecidas, a maior parte em bactérias, e seu número aumenta a cada ano;[63][64] tais enzimas incluem a aldeído oxidase, sulfito oxidase e a xantina oxidase.[2] Em alguns animais, e em humanos, a oxidação da xantina em ácido úrico, um processo do catabolismo da purina, é catalisada pela xantina oxidase. A atividade da xantina oxidase é diretamente proporcional a quantidade de molibdênio no organismo. Entretanto, uma concentração muito alta do elemento pode reverter a tendência e agir como um inibidor tanto no catabolismo da purina quanto em outros processos. A concentração de molibdênio também afeta síntese proteica, o metabolismo e o crescimento.[62]
Em animais e plantas um composto tricíclico chamado molibdopterina (que, apesar do nome, não contém o molibdênio) reage com o molibdato para formar um cofator contendo molibdênio denominado cofator de molibdênio. Protegidas da nitrogenases da filogenética primitiva, que incluem a fixação do nitrogênio em algumas bactérias e cianobactérias, todas as enzimas contendo molibdênio identificadas até a atualidade na natureza utilizam o cofator de molibdênio, no qual o elemento está no estado oxidativo VI, o mesmo que o do molibdato.[65] Enzimas de molibdênio em plantas e animais podem catalisar a oxidação e algumas vezes a redução de certas moléculas pequenas, como parte da regulação do ciclo do nitrogênio, ciclo do enxofre e ciclo do carbono.[66]
Ingestão diária e deficiência
[editar | editar código-fonte]O molibdênio é um elemento químico essencial para a vida dos animais.[67] Quatro enzimas com dependência de molibdênio em mamíferos são conhecidas, todas baseadas na pterina no cofator de molibdênio do sítio ativo: sulfito oxidase, xantina oxidase e aldeído oxidase.[68] Pessoas com deficiência de molibdênio tem um funcionamento deficiente da sulfito oxidase e são propensas a reações tóxicas de sulfitos nos alimentos.[69][70] O corpo humano contém aproximadamente 0,07 mg de molibdênio por quilograma do peso corporal.[71] Ocorrem em concentrações superiores no fígado e rins, e em concentrações menores nas vértebras.[26] O elemento também está presente dentro do esmalte dentário e pode ajudar a prever sua queda.[72]
A ingestão diária de molibdênio varia de 0,12 a 0,24 mg, dependendo do teor de molibdênio no alimento.[73] Carnes de suínos, ovinos e bifes de fígado tem aproximadamente 1,5 partes por milhão de molibdênio. Outras fontes relevantes incluem feijões verdes, ovos, sementes de girassol, farinha de trigo, lentilhas, pepinos e cereais em grãos.[2] A toxicidade aguda não foi observada em humanos e depende fortemente do estado químico do elemento. Estudos com ratos demonstram uma dose letal mediana (LD50) menor que 180 mg/kg para alguns compostos.[74] Embora dados sobre a toxicidade em humanos não estejam disponíveis, estudos com animais têm demonstrado que a ingestão crônica de mais de 10 mg/dia pode causar diarreia, retardo no crescimento, infertilidade, baixo peso de recém-nascidos e gota; também pode afetar os pulmões, rins e o fígado.[73][75] O tungstato de sódio é um inibidor competitivo do molibdênio e dietas com tungstênio reduzem a concentração do molibdênio em tecidos.[26]
A deficiência de molibdênio na dieta a partir baixa concentração no solo tem sido associada com um aumento da taxa de câncer de esôfago em parte do norte da china até o Irão.[76][77] Comparados com os Estados Unidos, onde existe um grande suprimento do elemento no solo, pessoas nestas áreas deficientes têm um risco 16 vezes maior de desenvolver câncer esofágico e carcinoma de células escamosas.[78]
A deficiência no elemento também tem sido relatada como uma consequência da nutrição parenteral total (alimentação intravenosa completa) por longos períodos de tempo. Resulta em altos níveis sanguíneos de sulfitos e ácido úrico, quase do mesmo modo que a deficiência no cofator de molibdênio. Todavia, uma vez que presumivelmente a deficiência em molibdênio a partir deste mecanismo é observada primariamente em adultos, as consequências neurológicas não têm sido sinalizadas como para a deficiência de um fator congênito.[79]
Doenças relacionadas
[editar | editar código-fonte]Uma doença congênita da deficiência do cofator de molibdênio, observada em crianças, resulta na interferência da capacidade do organismo de usar o molibdênio em enzimas. Causa altos níveis de sulfitos e ácido úrico, e danos neurológicos.[80][81]
Antagonismo cobre-molibdênio
[editar | editar código-fonte]Altos níveis de molibdênio podem interferir na captação do cobre, provocando a deficiência de cobre. O molibdênio previne proteínas de se ligar ao cobre, e também aumentam a quantidade de cobre que é excretado na urina. Ruminantes que consumem grandes quantidades de molibdênio desenvolvem sintomas que incluem diarreia, crescimento atrofiado, anemia e perda do pigmento do cabelo. Estes sintomas podem ser aliviados pela administração de mais cobre no organismo, tanto na forma de injeção quanto por uma dieta regulada.[82] A condição, como uma efetiva deficiência de cobre, pode ser agravada por excesso de enxofre.[26][83]
A redução ou deficiência de cobre também pode ser deliberadamente reduzida para propósitos terapêuticos pelo composto tetratiomolibdato de amónio, no qual o ânion vermelho brilhante de tetratiomolibdato é um agente quelante do cobre. O composto foi usado pela primeira vez com este propósito para no tratamento da toxicose de cobre em animais. Foi então introduzido como forma de tratamento para doença de Wilson, uma desordem metabólica do cobre que é hereditária em humanos; o composto age tanto pela competição na absorção do cobre no intestino e no aumento da excreção do elemento. Também foi descoberto que tem efeito inibidor na angiogênese, potencialmente pela inibição do íon cobre do processo de translocação da membrana envolvendo um caminho de secreção não clássico.[84] Isto é um tratamento investigatório interessante para o câncer, degeneração macular relacionada a idade e outras doenças com característica deposição no sangue.[85][86]
Isótopos
[editar | editar código-fonte]O molibdênio tem 6 isótopos estáveis e cerca de duas dezenas de radioisótopos, a maior parte com tempos de vida média da ordem de segundos. O 99Mo se usa em geradores de 99Mo / 99mTc para a indústria de isótopos nucleares. Estima-se que este mercado de produtos de 99Tc mova aproximadamente 100 milhões de euros ao ano.
Referências
- ↑ a b c Lide, David R., ed. (1994). CRC Handbook of Chemistry and Physics. Molybdenum. 4. [S.l.]: Chemical Rubber Publishing Company. p. 18. ISBN 0-8493-0474-1
- ↑ a b c d e f g h Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 262–266. ISBN 0-19-850341-5
- ↑ Shpak, Anatoly P.; Kotrechko, Sergiy O.; Mazilova, Tatjana I; Mikhailovskij, Igor M (2009). «Inherent tensile strength of molybdenum nanocrystals». Science and Technology of Advanced Materials. 10 (4): 045004. Bibcode:2009STAdM..10d5004S. doi:10.1088/1468-6996/10/4/045004
- ↑ Schmidt, Max (1968). «VI. Nebengruppe». Anorganische Chemie II. (em alemão). [S.l.]: Wissenschaftsverlag. pp. 119–127
- ↑ M. E. Wieser; M. Berglund (2009). «Atomic weights of the elements 2007 (IUPAC Technical Report)» (PDF). Pure and Applied Chemistry. 81 (11): 2131–2156. doi:10.1351/PAC-REP-09-08-03
- ↑ Meija, J.; et al. (2013). «Current Table of Standard Atomic Weights in Alphabetical Order: Standard Atomic weights of the elements». Consultado em 13 de março de 2015. Arquivado do original em 29 de abril de 2014
- ↑ Davis, Joseph R. (1997). Heat-resistant materials. Molybdenum. [S.l.]: ASM International. p. 365. ISBN 0-87170-596-6
- ↑ a b c d e f g h Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie 91–100 ed. [S.l.]: Walter de Gruyter. pp. 1096–1104. ISBN 3-11-007511-3
- ↑ Pope, Michael T.; Müller, Achim (1997). «Polyoxometalate Chemistry: An Old Field with New Dimensions in Several Disciplines». Angewandte Chemie International Edition. 30: 34. doi:10.1002/anie.199100341
- ↑ Nollet, Leo M. L., ed. (2000). Handbook of water analysis. New York, NY: Marcel Dekker. pp. 280–288. ISBN 978-0-8247-8433-1
- ↑ a b Gagnon, Steve. «Molybdenum». Jefferson Science Associates, LLC. Consultado em 6 de maio de 2007
- ↑ Lansdown, A. R. (1999). Molybdenum disulphide lubrication. Tribology and Interface Engineering. 35. [S.l.]: Elsevier. ISBN 978-0-444-50032-8
- ↑ Melchert, Craig. «Greek mólybdos as a Loanword from Lydian» (PDF). University of North Carolina at Chapel Hill. Consultado em 23 de abril de 2011
- ↑ International Molybdenum Association, "Molybdenum History" Arquivado em 22 de julho de 2013, no Wayback Machine.
- ↑ Institute, American Iron and Steel (1948). Accidental use of molybdenum in old sword led to new alloy. [S.l.: s.n.]
- ↑ Van der Krogt, Peter (10 de janeiro de 2006). «Molybdenum». Elementymology & Elements Multidict. Consultado em 20 de maio de 2007
- ↑ Scheele, C. W. K. (1779). «Versuche mit Wasserbley;Molybdaena». Svenska vetensk. Academ. Handlingar. 40: 238
- ↑ Hjelm, P. J. (1788). «Versuche mit Molybdäna, und Reduction der selben Erde». Svenska vetensk. Academ. Handlingar. 49: 268
- ↑ Hoyt, Samuel Leslie (1921). Metallography, Volume 2. [S.l.]: McGraw-Hill
- ↑ Krupp, Alfred; Wildberger, Andreas (1888). The metallic alloys: A practical guide for the manufacture of all kinds of alloys, amalgams, and solders, used by metal-workers ... with an appendix on the coloring of alloys. [S.l.]: H.C. Baird & Co. p. 60
- ↑ Gupta, C.K. (1992). Extractive Metallurgy of Molybdenum. [S.l.]: CRC Press. ISBN 978-0-8493-4758-0
- ↑ Reich, Leonard S (22 de agosto de 2002). The Making of American Industrial Research: Science and Business at Ge and Bell, 1876–1926. [S.l.: s.n.] p. 117. ISBN 9780521522373
- ↑ Vokes, Frank Marcus (1963). Molybdenum deposits of Canada. [S.l.: s.n.] p. 3
- ↑ Sam Kean. The Disappearing Spoon. Page 88–89
- ↑ Millholland, Ray (agosto de 1941). «Battle of the Billions: American industry mobilizes machines, materials, and men for a job as big as digging 40 Panama Canals in one year». Popular Science: 61
- ↑ a b c d e f g h Considine, Glenn D., ed. (2005). Van Nostrand's Encyclopedia of Chemistry. Molybdenum. New York: Wiley-Interscience. pp. 1038–1040. ISBN 978-0-471-61525-5
- ↑ Moon formation brought water to the Earth How the Earth became a habitable planet? por Amit Malewar (2019)
- ↑ Jambor, J.L.; et al. (2002). «New mineral names» (PDF). American Mineralogist. 87: 181
- ↑ Langedal, M (1997). «Dispersion of tailings in the Knabena—Kvina drainage basin, Norway, 1: Evaluation of overbank sediments as sampling medium for regional geochemical mapping». Journal of Geochemical Exploration. 58 (2–3): 157. doi:10.1016/S0375-6742(96)00069-6
- ↑ a b «Molybdenum Statistics and Information». U.S. Geological Survey. 10 de maio de 2007. Consultado em 10 de maio de 2007
- ↑ Gupta, C. K. (1992). Extractive Metallurgy of Molybdenum. [S.l.]: CRC Press. pp. 1–2. ISBN 978-0-8493-4758-0
- ↑ «Dynamic Prices and Charts for Molybdenum». InfoMine Inc. 2007. Consultado em 7 de maio de 2007
- ↑ «LME to launch minor metals contracts in H2 2009». London Metal Exchange. 4 de setembro de 2008. Consultado em 28 de julho de 2009. Arquivado do original em 6 de maio de 2009
- ↑ Pie chart of world Mo uses Arquivado em 10 de março de 2012, no Wayback Machine.. London Metal Exchange.
- ↑ a b «Molybdenum». AZoM.com Pty. Limited. 2007. Consultado em 6 de maio de 2007
- ↑ «Espacenet - Bibliographic data». worldwide.espacenet.com (em inglês). Consultado em 26 de março de 2017
- ↑ Neto, Pereira; Olímpio, Joaquim; Silva, Raphael Oliveira da; Silva, Edilaine Honório da; Moreto, Jeferson Aparecido; Bandeira, Rafael Marinho; Manfrinato, Marcos Dorigão; Rossino, Luciana Sgarbi; Neto, Pereira (1 de dezembro de 2016). «Wear and Corrosion Study of Plasma Nitriding F53 Super duplex Stainless Steel». Materials Research. 19 (6): 1241–1252. ISSN 1516-1439. doi:10.1590/1980-5373-mr-2015-0656
- ↑ Smallwood, Robert E. (1984). «TZM Moly Alloy». ASTM special technical publication 849: Refractory metals and their industrial applications: a symposium. [S.l.]: ASTM International. p. 9. ISBN 9780803102033
- ↑ «Compatibility of Molybdenum-Base Alloy TZM, with LiF-BeF2-ThF4-UF4». Oak Ridge National Laboratory Report. Dezembro de 1969. Consultado em 2 de setembro de 2010
- ↑ Cubberly, W. H.; Bakerjian, Ramon (1989). Tool and manufacturing engineers handbook. [S.l.]: Society of Manufacturing Engineers. p. 421. ISBN 978-0-87263-351-3
- ↑ Lal, S.; Patil, R. S. (2001). «Monitoring of atmospheric behaviour of NOx from vehicular traffic». Environmental Monitoring and Assessment. 68 (1): 37–50. PMID 11336410. doi:10.1023/A:1010730821844
- ↑ Lancaster, Jack L. «Ch. 4: Physical determinants of contrast». Physics of Medical X-Ray Imaging (PDF). [S.l.]: University of Texas Health Science Center. Consultado em 27 de fevereiro de 2015. Arquivado do original (PDF) em 10 de outubro de 2015
- ↑ Theodore Gray. The Elements. pp. 105–107
- ↑ Gottschalk, A (1969). «Technetium-99m in clinical nuclear medicine». Annual review of medicine. 20 (1): 131–40. PMID 4894500. doi:10.1146/annurev.me.20.020169.001023
- ↑ Winer, W. (1967). «Molybdenum disulfide as a lubricant: A review of the fundamental knowledge». Wear. 10 (6): 422. doi:10.1016/0043-1648(67)90187-1
- ↑ «New transistors: An alternative to silicon and better than graphene». Physorg.com. 30 de janeiro de 2011. Consultado em 30 de janeiro de 2011
- ↑ Topsøe, H.; Clausen, B. S.; Massoth, F. E. (1996). Hydrotreating Catalysis, Science and Technology. Berlin: Springer-Verlag
- ↑ Moulson, A. J.; Herbert, J. M. (2003). Electroceramics: materials, properties, applications. [S.l.]: John Wiley and Sons. p. 141. ISBN 0-471-49748-7
- ↑ International Molybdenum Association. imoa.info.
- ↑ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF). Tese de doutorado. [S.l.: s.n.] 2011
- ↑ «Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid» (PDF). Journal of Catalysis. 285: 48-60. 2012. doi:10.1016/j.jcat.2011.09.012. Arquivado do original (PDF) em 30 de outubro de 2016
- ↑ «Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol». ACS Catalysis. doi:10.1021/cs400010q
- ↑ «The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts» (PDF). Journal of Catalysis. 311: 369-385. 2014. doi:10.1016/j.jcat.2013.12.008. Arquivado do original (PDF) em 15 de fevereiro de 2016
- ↑ Mendel, Ralf R. (2013). «Chapter 15 Metabolism of Molybdenum». In: Banci, Lucia (Ed.). Metallomics and the Cell. Col: Metal Ions in Life Sciences. 12. [S.l.]: Springer. ISBN 978-94-007-5560-4. ISSN 1559-0836. doi:10.1007/978-94-007-5561-10_15 electronic-book ISBN 978-94-007-5561-1 electronic-issn 1868-0402
- ↑ Silva, Alinne da; Franzini, Vinícius I.; Piccolla, Cristiano D.; Muraoka, Takashi; Silva, Alinne da; Franzini, Vinícius I.; Piccolla, Cristiano D.; Muraoka, Takashi (1 de fevereiro de 2017). «Molybdenum supply and biological fixation of nitrogen by two Brazilian common bean cultivars». Revista Brasileira de Engenharia Agrícola e Ambiental. 21 (2): 100–105. ISSN 1415-4366. doi:10.1590/1807-1929/agriambi.v21n2p100-105
- ↑ Vieira, Rogerio Faria; Lima, Renan Cardoso; Prado, Adalgisa Leles do; Júnior, Trazilbo José de Paula; Soares, Bruno de Almeida (2 de setembro de 2016). «Split application of molybdic fertilizer at the reproductive stage of common bean increases the molybdenum content in seed». Acta Scientiarum. Agronomy (em inglês). 38 (4): 529–533. ISSN 1807-8621. doi:10.4025/actasciagron.v38i4.30536
- ↑ Dos Santos, Patricia C.; Dean, Dennis R. (2008). «A newly discovered role for iron-sulfur clusters». PNAS. 105 (33): 11589–11590. Bibcode:2008PNAS..10511589D. PMC 2575256
 . PMID 18697949. doi:10.1073/pnas.0805713105
. PMID 18697949. doi:10.1073/pnas.0805713105
- ↑ Scott, C.; Lyons, T. W.; Bekker, A.; Shen, Y.; Poulton, S. W.; Chu, X.; Anbar, A. D. (2008). «Tracing the stepwise oxygenation of the Proterozoic ocean». Nature. 452 (7186): 456–460. Bibcode:2008Natur.452..456S. PMID 18368114. doi:10.1038/nature06811
- ↑ «International team of scientists discover clue to delay of life on Earth». Eurekalert.org. Consultado em 25 de outubro de 2008
- ↑ «Scientists uncover the source of an almost 2 billion year delay in animal evolution». Eurekalert.org. Consultado em 25 de outubro de 2008
- ↑ «Primordial broth of life was a dry Martian cup-a-soup». New Scientist. 29 de agosto de 2013. Consultado em 29 de agosto de 2013
- ↑ a b Mitchell, Phillip C. H. (2003). «Overview of Environment Database». International Molybdenum Association. Consultado em 5 de maio de 2007. Arquivado do original em 18 de outubro de 2007
- ↑ Enemark, John H.; Cooney, J. Jon A.; Wang, Jun-Jieh; Holm, R. H. (2004). «Synthetic Analogues and Reaction Systems Relevant to the Molybdenum and Tungsten Oxotransferases». Chem. Rev. 104 (2): 1175–1200. PMID 14871153. doi:10.1021/cr020609d
- ↑ Mendel, Ralf R.; Bittner, Florian (2006). «Cell biology of molybdenum». Biochimica et Biophysica Acta. 1763 (7): 621–635. PMID 16784786. doi:10.1016/j.bbamcr.2006.03.013
- ↑ Fischer, B; Enemark, JH; Basu, P (1998). «A chemical approach to systematically designate the pyranopterin centers of molybdenum and tungsten enzymes and synthetic models». Journal of Inorganic Biochemistry. 72 (1–2): 13–21. PMID 9861725. doi:10.1016/S0162-0134(98)10054-5. Summarized in MetaCyc Compound: molybdopterin. Accessed Nov. 16, 2009.
- ↑ Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, R.U; Kroneck, P.M.H (1999). «A structural comparison of molybdenum cofactor-containing enzymes». FEMS Microbiol. Rev. 22 (5): 503–521. PMID 9990727. doi:10.1111/j.1574-6976.1998.tb00384.x
- ↑ Schwarz, Guenter; Belaidi, Abdel A. (2013). «Chapter 13. Molybdenum in Human Health and Disease». In: Astrid Sigel; Helmut Sigel; Roland K. O. Sigel. Interrelations between Essential Metal Ions and Human Diseases. Col: Metal Ions in Life Sciences. 13. [S.l.]: Springer. pp. 415–450. doi:10.1007/978-94-007-7500-8_13
- ↑ Mendel, Ralf R. (2009). «Cell biology of molybdenum». BioFactors. 35 (5): 429–34. PMID 19623604. doi:10.1002/biof.55
- ↑ Blaylock Wellness Report, February 2010, page 3.
- ↑ Cohen, HJ; Drew, RT; Johnson, JL; Rajagopalan, KV (1973). «Molecular Basis of the Biological Function of Molybdenum. The Relationship between Sulfite Oxidase and the Acute Toxicity of Bisulfite and SO2». Proceedings of the National Academy of Sciences of the United States of America. 70 (12 Pt 1–2): 3655–3659. Bibcode:1973PNAS...70.3655C. PMC 427300
 . PMID 4519654. doi:10.1073/pnas.70.12.3655
. PMID 4519654. doi:10.1073/pnas.70.12.3655
- ↑ Holleman, Arnold F.; Wiberg, Egon (2001). Inorganic chemistry. [S.l.]: Academic Press. p. 1384. ISBN 0-12-352651-5
- ↑ Curzon, M. E. J.; Kubota, J.; Bibby, B. G. (1971). «Environmental Effects of Molybdenum on Caries» (PDF). Journal of Dental Research. 50 (1): 74–77. doi:10.1177/00220345710500013401
- ↑ a b Coughlan, M. P. (1983). «The role of molybdenum in human biology». Journal of Inherited Metabolic Disease. 6 (S1): 70–77. PMID 6312191. doi:10.1007/BF01811327
- ↑ «Risk Assessment Information System: Toxicity Summary for Molybdenum». Oak Ridge National Laboratory. Consultado em 23 de abril de 2008. Arquivado do original em 19 de setembro de 2007
- ↑ Barceloux, Donald G.; Barceloux, Donald (1999). «Molybdenum». Clinical Toxicology. 37 (2): 231–237. PMID 10382558. doi:10.1081/CLT-100102422
- ↑ Yang, Chung S. (1980). «Research on Esophageal Cancer in China: a Review» (PDF). Cancer Research. 40 (8 Pt 1): 2633–44. PMID 6992989
- ↑ Nouri, Mohsen; Chalian, Hamid; Bahman, Atiyeh; Mollahajian, Hamid; et al. (2008). «Nail Molybdenum and Zinc Contents in Populations with Low and Moderate Incidence of Esophageal Cancer» (PDF). Archives of Iranian Medicine. 11: 392
- ↑ Taylor, Philip R.; Li, Bing; Dawsey, Sanford M.; Li, Jun-Yao; Yang, Chung S.; Guo, Wande; Blot, William J. (1994). «Prevention of Esophageal Cancer: The Nutrition Intervention Trials in Linxian, China» (PDF). Cancer Research. 54 (7 Suppl): 2029s–2031s. PMID 8137333. Consultado em 6 de março de 2015. Arquivado do original (PDF) em 4 de junho de 2016
- ↑ Abumrad, NN (1984). «Molybdenum—is it an essential trace metal?». Bulletin of the New York Academy of Medicine. 60 (2): 163–71. PMC 1911702
 . PMID 6426561
. PMID 6426561
- ↑ Smolinsky, B.; Eichler, S. A.; Buchmeier, S.; Meier, J. C.; Schwarz, G.; et al. (2008). «Splice-specific Functions of Gephyrin in Molybdenum Cofactor Biosynthesis». Journal of Biological Chemistry. 283 (25): 17370–9. PMID 18411266. doi:10.1074/jbc.M800985200
- ↑ Reiss, J. (2000). «Genetics of molybdenum cofactor deficiency». Human Genetics. 106 (2): 157–63. PMID 10746556. doi:10.1007/s004390051023
- ↑ Suttle, N. F. (1974). «Recent studies of the copper-molybdenum antagonism». CABI Publishing. Proceedings of the Nutrition Society. 33 (3): 299–305. PMID 4617883. doi:10.1079/PNS19740053
- ↑ Hauer, Gerald Copper deficiency in cattle. Bison Producers of Alberta. Accessed Dec. 16, 2010.
- ↑ Nickel, W (2003). «The Mystery of nonclassical protein secretion, a current view on cargo proteins and potential export routes». Eur. J. Biochem. 270 (10): 2109–2119. PMID 12752430. doi:10.1046/j.1432-1033.2003.03577.x
- ↑ Brewer GJ; Hedera, P; Kluin, KJ; Carlson, M; Askari, F; Dick, RB; Sitterly, J; Fink, JK; et al. (2003). «Treatment of Wilson disease with ammonium tetrathiomolybdate: III. Initial therapy in a total of 55 neurologically affected patients and follow-up with zinc therapy». Arch Neurol. 60 (3): 379–85. PMID 12633149. doi:10.1001/archneur.60.3.379
- ↑ Brewer, GJ; Dick, RD; Grover, DK; Leclaire, V; Tseng, M; Wicha, M; Pienta, K; Redman, BG; Jahan, T; Sondak, VK; Strawderman, M; LeCarpentier, G; Merajver, SD (2000). «Treatment of metastatic cancer with tetrathiomolybdate, an anticopper, antiangiogenic agent: Phase I study». Clinical cancer research : an official journal of the American Association for Cancer Research. 6 (1): 1–10. PMID 10656425
Ligações externas
[editar | editar código-fonte]- «WebElements.com - Molybdenum» (em inglês)
- «EnvironmentalChemistry.com - Molybdenum» (em inglês)
- «The International Molybdenum Association» (em inglês)
- «Molibdênio - vídeos e imagens»


