Neurociência molecular
A Neurociência molecular é um ramo da neurociência que utiliza conceitos da biologia molecular aplicada ao sistema nervoso dos animais. O âmbito desta área se refere principalmente a uma visão reducionista da neurociência, considerando temas como neuroanatomia molecular, mecanismos de sinalização molecular no sistema nervoso, os efeitos da genética no desenvolvimento neuronal e as bases moleculares da neuroplasticidade e doenças neurodegenerativas.[1] Assim como a biologia molecular, a neurociência molecular é um campo relativamente novo e consideravelmente dinâmico.
Localização de neurotransmissores[editar | editar código-fonte]
Na biologia molecular, a comunicação entre neurônios ocorre tipicamente através de transmissões químicas entre os espaços celulares chamados Sinapses. Os transmissores químicos, chamados de neurotransmissores, regulam uma fração significativa das funções vitais do corpo.[2] É possível localizar anatomicamente neurotransmissores através de técnicas de marcação. É possível identificar quimicamente certos neurotransmissores como as catecolaminas is possible to anatomically locate neurotransmitters by labeling techniques. It is possible to chemically identify certain neurotransmitters such as catecholamines através da fixação de secções de tecido neuronal com formaldeído. Isto pode dar origem a uma fluorescência induzida por forlamdeído, quando exposto a luz ultravioleta. A Dopamina, uma catecolamina, foi identificada no nemátodo C. elegans utilizando-se esta técnica [3] A imunocitoquímica, que envolve criar anticorpos contra alvos químicos ou biológicos, inclui algumas outras técnicas de interesse. Um neurotransmissor alvo poderia ser especificamente marcado por anticorpos primários ou secundários, com marcação radioativa, a fim de identificar o neurotransmissor por autoradiografia. A presença de neurotransmissores (embora não necessariamente a localização), pode ser observada em imuno-histoquímicas ou ELISA (The presence of neurotransmitters (though not necessarily the location) can be observed in enzyme-linked immunocytochemistry or enzyme--linked immunosorbent assays (ELISA) em que nos ensaios enzimáticos de ligação ao substrato podem induzir precipitados, fluoróforos, ou quimioluminescência. Caso os neurotransmissores não possam ser identificados histoquimicamente,um método alternativo é localizá-los pelos mecanismos de captação neuronal.[1]
Canais iônicos dependentes de voltagem[editar | editar código-fonte]

As células excitáveis em organismos vivos têm canais iônicos dependentes de voltagem. Estes podem ser observadas em todo o sistema nervoso de neurônios. Os primeiros canais iônicos a serem caracterizados foram os canais de íons de sódio e potássio por Alan Hodgkin e Andrew Huxley nos anos 1950, quando estudavam o axônio gigante da Loligo, um gênero de lula. Suas pesquisas demonstraram a permeabilidade seletiva das membranas celulares, dependente das condições fisiológicas, e os efeitos elétricos que resultam dessas permeabilidades para produzir potenciais de ação.[4]
Canais iônicos de sódio[editar | editar código-fonte]
Os canais iônicos de sódio foram os primeiros canais iônicos dependentes de voltagem a serem isolados em 1984 da enguia Electrophorus electricus por Shosaku Numa. A tetrodotoxina (TTX),toxina do peixe fugu japonês ou baiacu, um bloqueador dos canais de sódio, foi utilizada para isolar a proteína do canal de sódio ligando-os através da técnica de cromatografia em coluna para a separação química. A sequência de aminoácidos foi analisada pela degradação de Edman e usada para construir uma biblioteca de DNAc, que pode ser utilizada para clonar a proteína do canal. A clonagem do próprio canal permitiu aplicações tais como a identificação dos mesmos canais em outros animais.[1]Os canais de sódio são conhecidos por trabalharem em conjunto com os canais de potássio durante o desenvolvimento de potenciais graduados e potenciais de ação. Os canais de sódio permitem um influxo de íons Na+ resultando em uma despolarização do potencial de membrana em repouso de um neurônio levando a um potencial graduado ou potencial de ação, dependendo do grau de despolarização.[5]
Canais iônicos de potássio[editar | editar código-fonte]
Os canais de potássio vêm em uma variedade de formas, estão presentes na maioria das células eucariotas, e normalmente tendem a estabilizar a membrana da célula no potencial de equilíbrio de potássio. Tal como acontece com íons de sódio, os potenciais graduados e potenciais de ação também são dependentes de canais de potássio. Enquanto o influxo de íons sódio em um neurônio induz uma despolarização celular, o efluxo de íons de potássio para fora de um neurônio resulta na repolarização para o potencial de repouso. A ativação dos próprios canais de potássio são dependentes da despolarização, resultante do influxo de sódio durante um potencial de ação. [1] Tal como acontece com os canais de sódio, os canais de potássio têm as suas próprias toxinas que bloqueiam a ação de proteínas de canais. Um exemplo de toxina é o tetraetilamónio (TEA), mas deve-se lembrar que a toxina não tem o mesmo mecanismo de ação em todos os canais de potássio, levando-se em conta a variedade de tipos de canais entre as espécies. A presença de canais de potássio foi identificado pela primeira vez em moscas mutantes Drosophila melanogaster , que tremiam incontrolavelmente após anestesia devido a problemas na repolarização celular que levaram a uma eletrofisiologia anormal em neurônios e músculos. Os canais de potássio foram primeiro identificados através da manipulação genética molecular (das moscas) em vez de efetuar a purificação de proteínas de canal, porque não eram conhecidos ligantes de afinidade elevada para os canais de potássio (tal como TEA), no momento da descoberta.[1][6]
canais iônicos de cálcio[editar | editar código-fonte]
Os canais de cálcio são importantes para determinadas cascatas de sinalização celular, bem como a liberação de neurotransmissores em terminais axônicos. Uma variedade de diferentes tipos de canais de iônicos de cálcio são encontrados nas células excitáveis. Tal como acontece com os canais de sódio, canais iônicos de cálcio têm sido isolados e clonados por técnicas de purificação cromatograficas. É notável, como no caso de liberação de neurotransmissor, que os canais de cálcio podem interagir com proteínas intracelulares e desempenhar um papel importante na sinalização, especialmente em locais tais como o retículo sarcoplasmático de células musculares.[1]
Receptores[editar | editar código-fonte]
Vários tipos de receptores podem ser usados para a sinalização e comunicação celular, incluindo receptores ionotrópicos e receptores metabotrópicos. Estes tipos de receptores de superfície das células são diferenciados pelo mecanismo e duração de ação com os receptores ionotrópicos sendo associados com os receptores de transmissão de sinais rápida e metabotrópicos sendo associados à transmissão de sinais lenta. Os receptores metabotrópicos englobam uma grande variedade de receptores de superfície celular com diferentes cascatas de sinalização.[1][5]
Receptores ionotrópicos[editar | editar código-fonte]
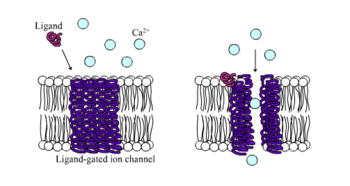
Receptores ionotrópicos, também conhecidos como canais iônicos dependentes de ligantes, são receptores de ação rápida que controlam as funções neuronais e fisiológicas pelo fluxo de íons através da ligação do ligante com o receptor. Receptores nicotínicos, GABA e glutamato estão entre alguns dos receptores de superfície de células reguladas pelo fluxo de canal iônico dependentes de ligantes. O GABA é o principal neurotransmissor inibitório do cérebro e o glutamato é o principal neurotransmissor excitatório do cérebro.[1]
Receptores GABA[editar | editar código-fonte]
Os receptores GABAA e GABAC são conhecidos por serem ionotrópicos, enquanto o receptor GABAB é metabotrópico. Os receptores GABAA controlam as respostas inibitórias rápidas no sistema nervoso central e são encontrados em neurônios, células da glia e da medula adrenal. É responsável pelo influxo de íons Cl- para dentro das células, reduzindo a probabilidade de que ocorra a despolarização da membrana com a chegada de um potencial graduado ou um potencial de ação. Os receptores GABA podem também interagir com ligantes não endógenos influenciando a atividade. Por exemplo, o composto diazepam (comercializado como Valium) é um agonista alostérico que aumenta a afinidade do receptor para o GABA. O aumento dos efeitos fisiológicos inibitórios resultantes do aumento de ligação GABA faz com que o diazepam seja útil como tranquilizante ou anticonvulsivante (antiepilépticos). Por outro lado, os receptores GABA também podem ser alvo através da diminuição do influxo celular de Cl- sob o efeito de convulsivantes como a picrotoxina. O mecanismo de ação antagônica para este composto não é diretamente sobre o receptor GABA, mas existem outros compostos que são capazes de produzir uma inativação alostérica , incluindo o T-butilbicicloforotionato (TBPS) e o pentilenetetrazol (PZT). Comparado com o GABA do tipo A, os receptores GABA do tipo C tem uma maior afinidade para o GABA, que são susceptíveis de possuir maior duração de atividade, e as respostas são susceptíveis de serem geradas por concentrações de GABA inferiores.[1]
Receptores de glutamato[editar | editar código-fonte]
Receptores de glutamato do tipo ionotrópicos podem incluir NMDA, AMPA e receptores cainato. Estes receptores foram nomeados após a utilização de agonistas que facilitam a atividade glutamatérgica. receptores NMDA são conhecidos pelos seus mecanismos excitatórios que afetam a plasticidade neuronal na aprendizagem e memória, bem como neuropatologias como acidente cerebral vascular (AVC) e epilepsia. Receptores NMDA possuem diversos sítios de ligação como os receptores GABA e podem ser influenciados por co-agonistas como o neurotransmissor glicina e a fenciclidina(PCP). Os receptores NMDA permitem o fluxo de íons Ca2+ e podem ser bloqueados por íons Mg2+ extracelulares, dependendo das condições de voltagem e potencial de membrana. Este influxo de Ca2+ é aumentado por potenciais pós-sinápticos excitatórios (PPSE) produzidos pelos receptores NMDA, ativando cascatas de sinalização dependentes de Ca2+. Receptores AMPA produzem menores e maiores correntes pós sinápticas excitatórias em comparação a outros receptores ionotrópicos de glutamato.[5]
Receptores nicotínicos (ACh)[editar | editar código-fonte]
Receptores nicotínicos se une ao neurotransmissor acetilcolina (ACh) para produzir um fluxo de cátions não-seletivo pelo canal, que gera respostas pós-sinápticas excitatórias. A atividade deste receptor, que pode ser influenciada pela nicotina, produz sensação de euforia e relaxamento, caracterizando um alto índice de dependência química.[5]
Receptores metabotrópicos[editar | editar código-fonte]

Receptores metabotrópicos são receptores pós-sinápticos de resposta lenta. Estas respostas mais lentas são caracterizadas por mudanças mais elaboradas na bioquímica intracelular. Respostas da captação de neurotransmissores por receptores metabotrópicos podem resultar na ativação de enzimas intracelulares e cascatas envolvendo segundo mensageiros, como é o caso da receptores acoplados à proteína G. Vários receptores metabotrópicos podem incluir alguns tipos de receptores do glutamato, muscarínicos, GABAB e receptores datirosina quinase.
Receptores acoplados à proteína G [editar | editar código-fonte]
A cascata de sinalização da proteína G pode ampliar significativamente o sinal de determinado neurotransmissor para produzir centenas a milhares de segundos mensageiros dentro da célula. Os mecanismos pelos quais isto acontece estão descritos a seguir:
- O neurotransmissor se liga ao receptor
- O receptor sofre uma alteração conformacional para permitir a ligação do complexo da proteína G
- O GDP é trocado pelo GTP sobre o complexo ligação receptor-proteína
- A subunidade-α do complexo da proteína G ligada ao GTP separa-se e se liga à uma proteína alvo como por exemplo a adenilato ciclase
- A ligação com a proteína alvo aumenta ou diminui a taxa de produção de segundos mensageiros ( como por exemplo o AMP cíclico)
- A GTPase hidroliza a subunidade α, de modo que está ligada ao GDP e a subunidade α retorna ao complexo da proteína G inativo.
Liberação de neurotransmissores[editar | editar código-fonte]

Neurotransmissores são liberados de pequenas vesículas do terminal axônico de um neurônio para os dendritos de outro neurônio através da sinapse. estas vesículas foram identificadas através da miscroscopia eletrônica e chamadas de vesículas sinápticas. Estas podem ser de dois diferentes tipos, pequenas (aproximadamente 40-60nm de diâmetro e grandes com aproximadamente 120-200nm de diâmetro.[1] As primeiras são derivadas de endossomos e abrigam neurotransmissores como acetilcolina, glutamato, GABA e glicina. As segundas são derivadas do complexo de golgi e abrigam neurotransmissores maiores como as catecolaminas e outros neurotransmissores peptídicos.[7] Os neurotransmissores são liberados do terminal axônico e se ligam a dendritos pós-sinápticos na seguinte ordem:[5]
- Recrutamento da vesícula sináptica do citoesqueleto
- A vesícula é ancorada à membrana pré-sináptica
- Engatilhamento da vesícula pelo ATP (processo relativamente lento)
- Fusão da vesícula engatilhada com a membrana pré-sináptica e exocitose do neurotransmissor
- captação dos neurotransmissores pelos receptores da célula pós-sináptica
- Ativação ou inibição do potencial de ação na célula pós-sináptica dependendo se os neurotransmissores são excitatórios ou inibitórios.(excitatórios vão resultar em despolarização da membrana pós-sináptica)
Liberação de neurotransmissores é cálcio-dependente[editar | editar código-fonte]
A liberação de neurotransmissores é dependente de um suprimento externo de íons Ca2+ que entram nos terminais axônicos através de canais de cálcio dependentes de voltagem.Uma fusão com a membrana do terminal e a liberação do neurotransmissor é causado pela geração de gradientes de Ca2+ induzidos pela chegada de potenciais de ação. Os íons Ca2+ causam uma mobilização de vesículas recentemente sintetizadas oriundas de uma lista de reserva para promover esta fusão de membrana. Este mecanismo de ação foi descoberto através do estudo de axônios gigantes de lulas.[8] Diminuindo íons Ca2+ intracelulares resulta em um efeito inibitório direto na liberação de neurotransmissores.[1] Após a liberação do neurotransmissor, as vesículas da membrana são recicladas para as suas origens de produção. Canais de íons cálcio podem variar dependendo do local de incidência. Por exemplo, os canais situados no terminal axônico diferem dos canais de cálcio típicos das células do corpo. Mesmo nos terminais axônicos, os tipos podem variar, como no caso de canais de cálcio do tipo P localizados na junção neuromuscular.[1]
Expressão gênica neuronal[editar | editar código-fonte]
Diferenças de sexo[editar | editar código-fonte]
Diferenças na determinação do sexo são controladas pelos cromossomos sexuais. Liberação de hormônios sexuais têm um efeito significativo em dimorfismos sexuais (diferenciação fenotípica das características sexuais) do cérebro. Estudos recentes sugerem que a regulação destes dimorfismos tem implicações no entendimento de funções cerebrais normais e anormais. Dimorfismos sexuais podem ser influenciados pela expressão gênica cerebral relacionada ao sexo, variando entre espécies.
Modelos animais como roedores, Drosophila melanogaster, e Caenorhabditis elegans, tem sido usados para observar as origens e /ou extensão do viés sexual no cérebro contra as gônadas sexuais produtoras de hormônios em determinado animal. Em roedores, estudos de manipulação genética dos cromossomos sexuais resultaram em efeitos em um sexo que era completamente diferente do efeito no outro sexo. Por exemplo, a eliminação (knockout) de um gene específico resultou em efeitos ansiogênicos (efeitos de ansiedade) apenas em machos . Estudos em D. menlanogaster relataram que um grande viés cerebral relacionado ao sexo e à expressão gênica ocorreu após a remoção das gônadas sexuais, sugerindo que o viés sexual pode ser independente do controle hormonal em certos aspectos.[9]
A observação dos genes relacionados ao viés em relação ao sexo tem significância clínica importante na fisiologia cerebral e a potencial relação (diretamente ou indiretamente) em doenças neurológicas. Exemplos de doenças neurológicas com viés relacionado ao sexo incluem a doença de Huntington, isquemia cerebral e doença de alzheimer.[9]
Epigenética do cérebro[editar | editar código-fonte]
Várias funcões cerebrais podem ser influenciadas em nível celular e molecular por variações e mudanças na expressão dos genes sem alterações na sequência do DNA em um organismo. Isto também é conhecido como regulação epigenética. Exemplos de mecanismos epigenéticos incluem modificações das histonas e metilação do DNA. Estas mudanças influenciam significativamente a incidência de doenças cerebrais como doenças mentais e abuso de drogas.[10] O controle epigenético tem demonstrado estar envolvido em altos níveis de plasticidade no desenvolvimento inicial, mostrando sua importância neste período crítico de um organismo.[11] Abaixo alguns exemplos de como mudanças epigenéticas podem influenciar o cérebro humano:
- Níveis elevados de metilação de genes rRNA no hipocampo resultam em uma menor produção de proteínas e consequentemente uma função hipocampal limitada, que pode levar a prejuízos na aprendizagem e memória e/ou resultar em tendências suicidas.[12]
- Em um estudo comparando as diferenças genéticas entre pessoas normais e pacientes psiquiátricos, foram encontrados 60 marcadores epigenéticos associados com a sinalização cerebral.[12]
- Fatores ambientais como abuso na infância parecem causar uma modificação epigenética em receptores de glucocorticóides (associados a respostas ao estresse) que não foram encontrados em em vítimas de suicídio.[12] Este é um exemplo de plasticidade relacionada à experiências.
- Enriquecimento ambiental em indivíduos esta associado com um aumento d a acetilação de histonas no hipocampo, melhorando a consolidação da memória (especialmente a memória espacial).[11]
Mecanismos moleculares das doenças neurodegenerativas[editar | editar código-fonte]
Excitotoxicidade e receptores glutamatérgicos[editar | editar código-fonte]
Excitotoxicidade é um fenômeno no qual receptores de glutamato são ativados inadequadamente. Pode ser causada por uma transmissão sináptica excitatória prolongada , na qual níveis elevados de neurotransmissão glutamatérgica causam uma ativação excessiva no neurônio pós -sináptico, a qual pode resultar na morte do neurônio pós-sináptico. Foi descoberto que após um dano cerebral ( por exemplo isquemia), a excitotoxicidade é responsável por uma significativa parcela do dano neuronal. Isto pode ser compreensível no caso em que a perfusão de sangue após súbita redução do fluxo sanguíneo para o cérebro resulta em uma atividade sináptica excessiva causada pela presença elevada do glutamato e aspartato durante o período de isquemia.[5][13]
Doença de Alzheimer[editar | editar código-fonte]
A doença de Alzheimer é a doença neurodegenerativa mais comum e a forma mais comum de demência em idosos. Ela é caracterizada por uma progressiva perda da memória e várias funções cognitivas. Uma hipótese é o acúmulo de proteínas beta amilóides no cérebro, supostamente bloqueando o potencial de longa duração no hipocampo. Também é possível que um receptor para oligomeros da beta amilóide possa ser uma proteína prion.[14]
Doença de Parkinson [editar | editar código-fonte]
A Doença de Parkinson é a segunda mais comum doença neurodegenerativa após a Doença de Alzheimer. É uma desordem dos gânglios basais causada pela perda de neurônios dopaminérgicos na substância negra do cérebro. O fluxo de saída inibitório originário dos gânglios basais não são diminuídos, desta forma, neurônios motores superiores, controlados pelo tálamo, não são ativados no seu devido tempo. Sintomas específicos incluem rigidez, problemas de postura, movimentos lentificados e tremores. O bloqueio de sinais originados dos neurônios espinhosos médios (medium spiny neurons) para as células da reticulata, causam a inibição dos neurônios motores superiores, similares ao que ocorre na Doença de Parkinson.[5]
Doença de Huntington[editar | editar código-fonte]
A Doença de Huntington é uma doença dos gânglios basais, caracterizada por hipercinesia, falta de estímulos inibitórios vindos dos neurônios espinhosos médios dos gânglios basais. Esta doença apresenta efeitos opostos aqueles associados com a doença de Parkinson, incluindo a ativação inadequada de neurônios motores superiores. Tal como acontece com os mecanismos GABAérgicos observados em relação à doença de Parkinson, um agonista de GABA injetado na substância negra pars reticulata diminuiu a inibição de neurônios motores superiores, resultando em movimentos motores involuntários balísticos, semelhantes aos sintomas da doença de Huntington.[5]
Referências[editar | editar código-fonte]
- ↑ a b c d e f g h i j k l Molecular Neuroscience.
- ↑ "What are Neurotransmitters?"
- ↑ Riddle, Donald (1998).
- ↑ Hodgkin, Allan L.; Andrew F. Huxley (1952).
- ↑ a b c d e f g h Purves, Dale (2012).
- ↑ Kamb, Alexander; Linda E. Iverson; Mark A. Tanouye (31 July 1987).
- ↑ Davies, R. Wayne; Brian J. Morris (1997).
- ↑ Dipolo, R.; C. Caputo; F. Bezanilla (March 1983).
- ↑ a b Jazin, E.; Cahill, L. (January 2010).
- ↑ "Epigenetics and the Human Brain".
- ↑ a b Fagiolini, Michela; Catherin L. Jensen; Frances A. Champagne (2009).
- ↑ a b c Tsankova, N.; W. Renthal, A. Kumar, E.J. Nextler (2007).
- ↑ Lau, A.; M. Tymianski (2010).
- ↑ Laren, Juha; David A. Gimbel; Haakon B. Nygaard; John W. Gilbert (February 2009).
