Pirazina
| Pirazina Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | Pyrazine |
| Outros nomes | 1,4-Diazabenzeno, p-Diazina, 1,4-Diazina, Paradiazina, Piazina, UN 1325 |
| Identificadores | |
| Número CAS | |
| PubChem | |
| Número EINECS | |
| ChEBI | |
| SMILES |
|
| InChI | 1/C4H4N2/c1-2-6-4-3-5-1/h1-4H
|
| Propriedades | |
| Fórmula molecular | C4H4N2 |
| Massa molar | 80,09 g/mol |
| Aparência | cristais brancos |
| Densidade | 1,031 g/cm3 |
| Ponto de fusão |
52 °C |
| Ponto de ebulição |
115 °C |
| Solubilidade em água | Solúvel |
| Riscos associados | |
| NFPA 704 | |
| Frases R | R11, R36/37/38 |
| Frases S | S16, S26, S36 |
| Ponto de fulgor | 55 °C c.c. |
| Compostos relacionados | |
| Compostos heterocíclicos relacionados | Piridina (apenas um N no anel) Pirimidina (1,3-diazina) Piridazina (1,2-diazina) Tetrazina (quatro Nsn no anel, instável) Piperazina (saturado) |
| Compostos relacionados | Pteridina (fusão com pirimidina) Fenazina (dibenzo-p-diazina) Ácido pirazinoico |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
Pirazina é um composto orgânico heterocíclico e aromático com a fórmula C4H4N2. Pirazina é uma molécula simétrica com grupo pontual de simetria D2h. É encontrada no ácido fólico na forma de pterina. Derivados tais como fenazina são bem conhecidas pelas suas atividades antitumores, antibióticas e diuréticas. Pirazina é menos básica em natureza que a piridina, piridazina e pirimidina. Tetrametilpirazina (também conhecida como ligustrazina) é descrita como eliminando o ânion superóxido e diminuindo a produção de óxido nítrico em leucócitos polimorfonucleares em humanos,[1] e é um componente de algumas ervas na medicina tradicional chinesa.[2]
Síntese[editar | editar código-fonte]
Existem numerosos métodos para o síntese orgânica da pirazina e de seus derivados. Algumas delas estão entre as mais antigas reações de síntese ainda em uso.
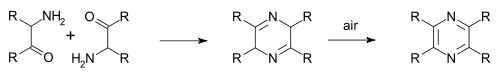
Na síntese da pirazina de Staedel–Rugheimer (1876) 2-cloroacetofenona reage com amônia à aminocetona, então condensada e oxidada à pirazina.[3] Uma variação é a síntese de pirazina de Gutknecht (1879) também baseada sobre esta autocondensação, mas diferindo na rota pela qual a alfa-cetoamina é sintetizada. [4][5]
A síntese de Gastaldi (1921) é outra variação:[6][7]
Referências
- ↑ Life Sciences, 2003, 72, 2465–2472, DOI: http://dx.doi.org/10.1016/S0024-3205(03)00139-5
- ↑ [1] - www.itmonline.org
- ↑ Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol (pp. 563–564) W. Staedel, L. Rügheimer doi:10.1002/cber.187600901174 Berichte der deutschen chemischen Gesellschaft Volume 9, Issue 1, pp. 563–564, 1876
- ↑ Mittheilungen Ueber Nitrosoäthylmethylketon H. Gutknecht Berichte der deutschen chemischen Gesellschaft Volume 12, Issue 2 , pp. 2290–2292, 1879 doi:10.1002/cber.187901202284
- ↑ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- ↑ G. Gastaldi, Gazz. Chim. Ital. 51, (1921) 233
- ↑ Amines: Synthesis, Properties and Applications Stephen A. Lawrence 2004 Cambridge University Press ISBN 0-521-78284-8