Reação aldólica de Mukaiyama
| eductos |
|---|
 aldeído (R1 = Alquil, Aril) or formato (R1 = OR) |
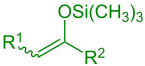 éter silílico de enol (R1 = Alquil, Aril, H; R2 = Alquil, Aril, H, OR, SR) |
A reação aldólica de Mukaiyama é uma reação orgânica e um tipo de reação aldólica entre um éter silílico de enol e um aldeído ou formato.[1] A reação foi descoberta por Teruaki Mukaiyama (nascido em 1927) em 1973.[2] Sua escolha de reagentes permite uma reação aldólica cruzada entre um aldeído e uma cetona ou um aldeído diferente sem auto-condensação do aldeído. Por esta razão, a reação é amplamente utilizada em síntese orgânica.
Esquema geral de reação[editar | editar código-fonte]
A reação aldólica de Mukaiyama é uma adição de enol silanos a compostos carbonilo mediada por ácido de Lewis. Nesta reação compostos com vários grupos orgânicos podem ser usados (ver eductos).[3]
Uma versão básica (R2 = H) sem a presença de catalisadores quirais é mostrado abaixo.

Uma mistura racêmica de enantiômeros é produzida. Se Z- ou E-enol silanos são usados nesta reação uma mistura de quatro produtos ocorre, rendendo dois racematos.

Se o anti-diastereômero ou o sin-diastereômero é produzido depende em grande parte das condições de reação, substratos e ácidos de Lewis.
A reação arquetípica é a do éter silílico de enol de cicloexanona com benzaldeído. Em temperatura ambiente produz uma mistura diastereomérica de treo (63%) e eritro (19%) β-hidroxicetona assim como 6% do produto de condensação enona exocíclico. No seu escopo original o ácido de Lewis (cloreto de titânio) foi usado em quantidades estequiométricas mas também existem sistemas catalíticos verdadeiros.. A reação é também otimizada por síntese assimétrica.
Nos seus experimentos iniciais, Mukaiyama e colaboradores trabalharam com cloreto de estanho (IV) como sendo um promissor ácido de Lewis, o qual provou ser um ácido de Lewis ativo suave com boas qualidades quelantes.[4][5][6][7][8] Estudos sistemáticos envolvendo estereosseletividades foram conduzidas por Heathcock [9][10][11] e Reetz.[12][13][14][15][16] Revisão extensa sobre o tema foi realizada por Shiima e Fukui.[17][16] Em contraste com os outros métodos descritos as estereosseletividades foram fortemente influenciadas pelas funcionalidades contendo oxigênio dos aldeídos usados.[16]
Gennari e colaboradores investigaram extensivamente a reação de Mukaiyama mediada por cloreto de estanho IV de éteres sililo enol de ésteres assim como também tioésteres. Quando usados com aldeídos alifáticos aquirais diastereosseletividades pobres foram observadas independentemente da configuração dos enolatos de partida. Em contraste a isso, altas diastereosseletividades foram detectadas em reações com aldeídos α-alcóxido quirais.[18][16]
Mecanismo[editar | editar código-fonte]
Abaixo, o mecanismo é mostrado com R2 = H:
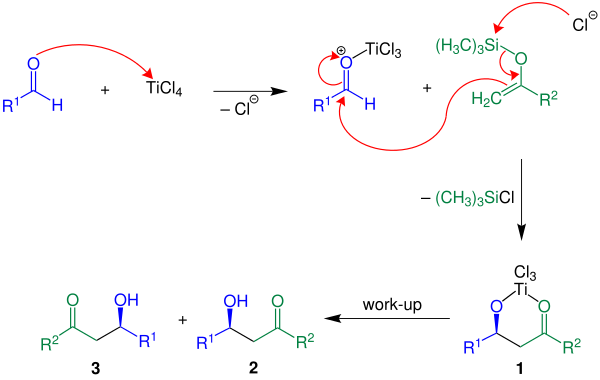
No exemplo citado o ácido de Lewis TiCl4 é usado. Primeiro, o ácido de Lewis ativa o componente aldeído seguido por formação de ligação carbono-carbono entre o enol silano e o aldeído ativado.
Com a perda de um clorosilano o composto 1 é produzido. O produto desejado, um racemato de 2 e 3, é obtido por realizar-se a reação em meio aquoso.[3]
Escopo[editar | editar código-fonte]
Uma reação típica envolvendo duas cetonas é aquela entre acetofenona como o enol e acetona:[19]

Reações de cetona deste tipo requerem altas temperaturas de reação. Neste trabalho, Mukaiyama inspirou-se pelo trabalho anterior feito por Georg Wittig em 1966 em reações aldólicas cruzadas com iminas contendo lítio.[20][21] Trabalho concorrente com reações aldólicas de enolato de aldol foi publicado também em 1973 por Herbert O. House.[22]
Mukaiyama empregou nesta sua abordagem da síntese total de taxol (1999) por duas adições aldólicas,[23][nota 1] uma com um acetal silílico de ceteno e excesso de brometo de magnésio:

e uma segunda com uma amina ligando quiral e um catalisador sal triflato:

Utilização de complexos de ácido Lewis e bases de Lewis quirais em processos catalíticos assimétricos é a área de crescimento mais rápido no uso da reação aldólica de Mukaiyama.[3]
Notas
- ↑ TBS = t-butildimetilsililo, Bn = benzil, PMB = éter p-metoxibenzílico
Referências
- ↑ Mukaiyama, T.; Kobayashi, S. Org. React. 1994, 46, 1. doi:10.1002/0471264180.or046.01
- ↑ New aldol type reaction Teruaki Mukaiyama, Koichi Narasaka and Kazuo Banno Chemistry Letters Vol.2 (1973) , No.9 pp.1011–1014 doi:10.1246/cl.1973.1011
- ↑ a b c László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, S. 298–299, ISBN 978-0-12-429785-2.
- ↑ Mukaiyama T, Narasaka K, Banno K (1973) Chem Lett 1011.
- ↑ Mukaiyama T, Banno K, Narasaka K (1974) J Am Chem Soc 96:7503.
- ↑ Saigo K, Osagi M, Mukaiyama T (1975) Chem Lett 989.
- ↑ Mukaiyama T (1982) Org React 28.203
- ↑ Mukaiyama T, Narasaka K (1987) Org Synth 65:6
- ↑ Heathcock CH, Hug KT, Filippin LA (1984) Tetrahedron Lett 25:5973
- ↑ Heathcock CH, Davidsen K, Hug KT, Filippin LA (1986) J Am Chem Soc 51:3027.
- ↑ Heathcock CH, montgomery SH (1985) Tetrahedron Lett 26:1001
- ↑ Reetz MT, Kesseler K, Jung A (1984) Tetrahedron Lett 25:729
- ↑ Reetz MT, Kesseler K, Jung A (1984) Tetrahedron 40:4327
- ↑ Reetz MT, Kesseler K, Schmidberger BW, Steinbach R (1983) Angew Chem Int Ed Engl 22:989
- ↑ Reetz MT, Kesseler K (1985) J Org Chem 50:5434
- ↑ a b c d Rainer Mahrwald; Aldol Reactions; Springer Science & Business Media, 2009. pg 84
- ↑ 13.Shiima I, Fukui H (2008) In: Acid Ctalysis in Modern Organic Synthesis, Yamamoto H, Ishihara K (eds) Wiley, Weinheim, vol 1. p 937
- ↑ Gennari C, Bernardi A, Poli G, Scolastico C (1985) Tetrahedron Lett 26:2373
- ↑ Organic Syntheses, Coll. Vol. 8, p.323 (1993); Vol. 65, p. 6 (1987). [PDF http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf]
- ↑ Über gezielte Aldolkondensationen—II G. Wittig and P. Suchanek Tetrahedron Volume 22, Supplement 8, 1966, Pages 347–358 doi:10.1016/S0040-4020(01)82193-1
- ↑ DIRECTED ALDOL CONDENSATIONS: β-PHENYLCINNAMALDEHYDE Organic Syntheses, Coll. Vol. 6, p.901 (1988); Vol. 50, p.66 (1970). G. Wittig, A. Hesse, Allan Y. Teranishi and Herbert O. House http://www.orgsynth.org/orgsyn/prep.asp?prep=cv6p0901
- ↑ Chemistry of carbanions. XXIII. Use of metal complexes to control the aldol condensation Herbert O. House, David S. Crumrine, Allan Y. Teranishi, Hugh D. Olmstead J. Am. Chem. Soc.; 1973; 95(10); 3310–24. doi:10.1021/ja00791a039
- ↑ Asymmetric Total Synthesis of Taxol Teruaki Mukaiyama , Isamu Shiina, Hayato Iwadare, Masahiro Saitoh, Toshihiro Nishimura, Naoto Ohkawa, Hiroki Sakoh, Koji Nishimura, Yu-ichirou Tani, Masatoshi Hasegawa, Koji Yamada , Katsuyuki Saitoh Chem. Eur. J. 1999, 5, No. 1 doi:10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O
