Reação de Negishi
O acoplamento de Negishi é uma reação de acoplamento amplamente empregada catalisada por metal de transição. A reação acopla haletos orgânicos ou triflatos a compostos organozinco, formando ligações carbono-carbono (C–C) no processo. Uma espécie de paládio (0) ou, com menor frequência, de níquel é geralmente utilizada como catalisador metálico.[1][2] Uma variedade de catalisadores de níquel com estados de oxidação Ni0 ou NiII pode ser empregada em acoplamentos de Negishi, como Ni(PPh3)4, Ni(acac)2, Ni(COD)2 etc.[3][4][5]

- O grupo de saída X é, geralmente, cloreto, brometo ou iodeto, podendo, também, ser um grupo triflato ou acetóxi. Comumente, reações com cloreto como grupo de saída são mais lentas.
- O resíduo orgânico R pode ser alquenil, aril, alil, alquinil ou propargil.
- O haleto X' no composto organozinco pode ser cloro, bromo ou iodo e o resíduo orgânico R' é alquenil, aril, alil, alquil, benzil, homoalil ou homopropargil.
- O metal M no catalisador é níquel ou paládio.
- O ligante L no catalisador pode ser trifenilfosfina, DPPE, BINAP ou chiraphos.
Catalisadores de paládio têm, em geral, maiores rendimentos e maior tolerância a grupos funcionais.
O acoplamento de Negishi é comumente utilizado no campo da síntese total como um método para formar ligações C–C seletivamente entre intermediários sintéticos complexos. A reação permite o acoplamento de átomos de carbono sp3, sp2 e sp (ver hibridização de orbitais), o que o torna um tanto incomum entre as reações de acoplamento catalisadas por paládio. Os organozinco são sensíveis à umidade e ao ar. Por isso, o acoplamento de Negishi deve ser realizado em um ambiente seco e desprovido de oxigênio, fato que tem dificultado seu uso em relação a outras reações de acoplamento que requerem condições menos robustas (por exemplo, a reação de Suzuki). No entanto, os organozinco são mais reativos do que os organoestanho (usados no acoplamento de Stille) e os organoboro (usados no acoplamento de Suzuki), o que leva a reações mais rápidas.
A reação recebeu o nome de Ei-ichi Negishi, co-receptor do Prêmio Nobel de Química de 2010 pela descoberta e o desenvolvimento dessa reação.
Negishi e seus colaboradores investigaram, originalmente, o acoplamento de reagentes de organoalumínio em 1976, empregando, inicialmente, Ni e Pd como catalisadores metálicos. Entretanto, notaram que o níquel resultava na redução da estereoespecifidade, diferentemente do paládio.[6] Substituindo compostos organoalumínio por espécies organozinco, Negishi e seus colaboradores relataram o uso de complexos de Pd em reações de acoplamento de organozinco e realizaram estudos de métodos, eventualmente desenvolvendo as condições reacionais frequentemente utilizadas hoje.[7] Ao lado de Richard F. Heck e Akira Suzuki, El-ichi Negishi foi co-receptor do Prêmio Nobel de Química em 2010, por seu trabalho sobre "acoplamentos catalisados por paládio em síntese orgânica".
Mecanismo reacional[editar | editar código-fonte]
Acredita-se que a reação ocorra via acoplamento padrão catalisado por Pd, começando com uma espécie de Pd(0), que é oxidada a Pd(II) em uma etapa de adição oxidativa envolvendo as espécies organo-haleto.[8] Essa etapa prossegue com haletos de arila, vinila, alquinila ou acila, acetatos ou triflatos, com substratos seguindo taxas relativas de adição oxidativa padrão (I>OTf>Br>>Cl).[9]
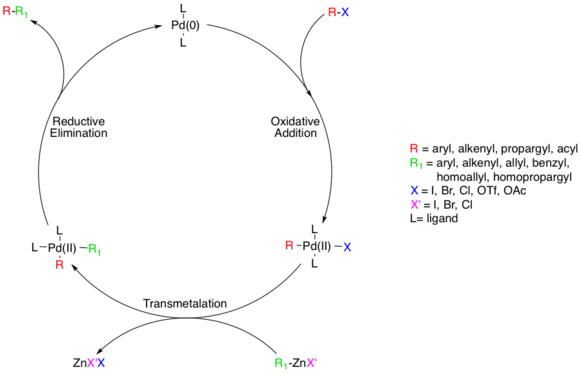
O mecanismo real da adição oxidativa é desconhecido, embora existam duas vias prováveis. Acredita-se que uma delas prossegue através de um mecanismo semelhante a uma SN2 resultando em estereoquímica invertida. A outra possibilidade prossegue via adição concertada e retém a estereoquímica.

Embora as adições sejam cis, o complexo de Pd(II) isomeriza-se rapidamente na estrutura trans.[10]

Em seguida, ocorre a etapa de transmetalação, na qual o reagente organozinco troca seu substituinte orgânico com o haleto do complexo de Pd(II), gerando o complexo de Pd(II) trans e um sal haleto de zinco. O substrato do organozinco pode ser aril, vinil, alil, benzil, homoalil ou homopropargil.[8] A transmetalação geralmente é a etapa determinante da velocidade reacional, e uma compreensão mecanística completa dessa etapa ainda não foi alcançada, embora vários estudos tenham esclarecido o processo. Foi recentemente determinado que as espécies de alquilzinco devem formar uma espécie de zinco de ordem superior antes da transmetalação, enquanto as espécies de arilzinco não o fazem.[11] ZnXR e ZnR2 podem ser utilizados como reagentes reativos, e o Zn é conhecido por favorecer complexos tetracoordenados, o que significa que complexos de Zn coordenados por solvente da forma ZnXR(solvente)2 não podem ser descartados a princípio.[12] Estudos indicam que existem equilíbrios competitivos entre complexos cis- e trans-bisalquilorganopaládio, mas que o único intermediário produtivo é o complexo cis.[13][14]

O último passo na via catalítica do acoplamento de Negishi é a eliminação redutiva, que se acredita proceder através de um estado de transição tricoordenado, resultando no produto orgânico acoplado e regenerando o catalisador de Pd(0). Para que essa etapa ocorra, o complexo cis-alquilorganopaládio supracitado deve ser formado.[15]

Tanto os haletos de organozinco quanto os compostos diorganozinco podem ser utilizados como material de partida. Por meio de um sistema modelo, foi descoberto que, na etapa de transmetalação, o primeiro fornece o aduto cis R-Pd-R' resultando em eliminação redutiva rápida do produto, enquanto o último fornece o aduto trans que, antes, tem que passar por uma lenta isomerização trans-cis.[13]
Uma reação lateral comum é o homoacoplamento. Em um sistema modelo de Negishi, descobriu-se que o homoacoplamento é resultado de uma segunda reação de transmetalação entre o intermediário diarilmetal e o haleto de arilmetal:[16]
- Ar–Pd–Ar' + Ar'–Zn–X → Ar'–Pd–Ar' + Ar–Zn–X
- Ar'–Pd–Ar' → Ar'–Ar' + Pd(0) (homoacoplamento)
- Ar–Zn–X + H2O → Ar–H + HO–Zn–X (reação acompanhada por desalogenação)
Os sistemas catalisados por níquel podem operar por diferentes mecanismos, dependendo dos reagentes de acoplamento. Ao contrário dos sistemas de paládio que envolvem apenas Pd0 ou PdII, os sistemas catalisados por níquel podem envolver diferentes estados de oxidação deste metal.[17] Tais sistemas são semelhantes, pois envolvem etapas elementares semelhantes: adição oxidativa, transmetalação e eliminação redutiva. Ambos os sistemas também precisam abordar questões de eliminação de β-hidreto e difícil adição oxidativa de eletrófilos de alquila.[3]
Para eletrófilos de alquila não ativados, um mecanismo possível é um de transmetalação. Nele, as espécies de alquilzinco transmetalariam primeiramente com o catalisador de níquel. Então, o níquel abstrairia o haleto do haleto de alquila, resultando no radical alquila e no níquel oxidado após a adição do radical.[18]

Um fator importante ao contemplar o mecanismo de um acoplamento catalisado por níquel é que a eliminação redutiva é facilitada com espécies de NiIII, mas muito difícil com espécies de NiII. Kochi e Morrell forneceram evidências disso isolando o complexo NiIINi(PEt3)2(Me)(o-tolil), que não sofreu eliminação redutiva com rapidez suficiente para ser envolvido nessa etapa elementar.[19]
Aplicações[editar | editar código-fonte]
A reação de Negishi foi aplicado nas seguintes sínteses ilustrativas:
- 2,2'-bipiridinas assimétricas a partir de 2-bromopiridina e tetraquis(trifenilfosfina)paládio(0),[20]
- bifenil a partir de cloreto de o-tolilzinco e o-iodotolueno e tetraquis(trifenilfosfina)paládio(0),[21]
- hexadeca-5,7-dieno a partir de dec-1-ino e iodeto de (Z)-1-hexenil.[22]

O acoplamento foi aplicado na síntese de hexaferrocenilbenzeno:[23]

com hexaiodobenzeno, diferrocenilzinco e tris(dibenzilidenoacetona)dipaládio(0) em tetraidrofurano. O rendimento é de apenas 4%, o que evidencia aglomeração substancial em torno do núcleo arila.
Em uma nova modificação, o paládio é, primeiramente, oxidado pela halocetona 2-cloro-2-fenilacetofenona (1) e o complexo de paládio OPdCl resultante recebe, então, tanto o organozinco (2) quanto o organoestanho (3) em uma transmetalação dupla:[24]

Condições recentes para a reação de Negishi demonstraram utilidade extremamente ampla e tolerância a uma vasta gama de grupos funcionais e núcleos heteroaromáticos, prosseguindo à temperatura ambiente ou próxima a ela.[25]
Exemplos de acoplamentos de Negishi catalisados por níquel incluem sistemas sp2-sp2, sp2-sp3 e sp3-sp3. No sistema estudado pela primeira vez por Negishi, o acoplamento cruzado aril-aril foi catalisado por Ni(PPh3)4 gerado in situ através da redução de Ni(acac)2 com PPh3 e (i-Bu)2AlH.[4]

Variações também foram desenvolvidas para permitir o acoplamento de grupos aril e alquenil. Na variação desenvolvida por Knochel et al., brometos de aril-zinco reagiram com triflatos de vinila e haletos de vinila.[5]

As reações entre os centros sp3-sp3 são frequentemente mais difíceis; no entanto, a adição de um ligante insaturado com um grupo retirador de elétrons como cocatalisador melhorou o rendimento em alguns sistemas. Acredita-se que a coordenação adicional do ligante insaturado favorece a eliminação redutiva em detrimento da eliminação de β-hidreto.[26][27] Isso também funciona em alguns sistemas alquil-aril.[28]
Existem diversas variantes assimétricas e muitas utilizam ligantes Pybox.[29][30][31]
Aplicações industriais[editar | editar código-fonte]
O acoplamento de Negishi não é empregado industrialmente com tanta frequência como outras reações de acoplamento (a reação de Suzuki e a reação de Heck), principalmente devido à sensibilidade à água e ao ar dos reagentes aril ou alquilzinco necessários.[32][33] Em 2003, a Novartis empregou um acoplamento de Negishi na fabricação do PDE472, um inibidor da fosfodiesterase tipo 4D, que estava sendo investigado como uma droga utilizável no tratamento da asma.[34] A reação foi utilizada como alternativa à reação de Suzuki proporcionando rendimentos melhores — 73% em uma escala de 4,5 kg — do intermediário sintético de benzodioxazol desejado.[35]

Aplicações em síntese total[editar | editar código-fonte]
Enquanto o acoplamento de Negishi é raramente usado na química industrial, resultado da já mencionada sensibilidade à água e ao oxigênio, ele é amplamente utilizado no campo da síntese total de produtos naturais. Sua maior reatividade em relação a outras reações de acoplamento torna a reação de Negishi ideal para unir intermediários complexos na síntese de produtos naturais.[8] Além disso, o Zn é mais ecológico do que outros metais, como o estanho usado no acoplamento de Stille. Embora o acoplamento de Negishi não tenha sido historicamente tão utilizado quanto os acoplamentos de Stille ou de Suzuki, ele tem sido mais presente no campo da química sintética nos últimos anos, tanto que se tornou o método de acoplamento escolhido para selecionar tarefas sintéticas. Quando se trata de processos de acoplamento de fragmentos, o acoplamento de Negishi é particularmente útil, especialmente quando comparado às reações de acoplamento de Stille e de Suzuki já mencionadas.[36] A principal desvantagem do acoplamento de Negishi, além de sua sensibilidade à água e ao oxigênio, é sua relativa intolerância a grupos funcionais em comparação a outras reações de acoplamento.[37]
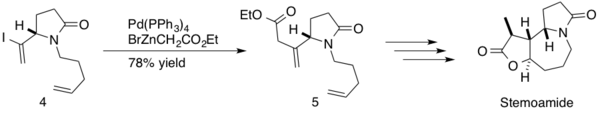
A (−)-estemoamida é um produto natural encontrado nos extratos da raiz de Stemona tuberosa. Esses extratos têm sido utilizados nas medicinas tradicionais japonesa e chinesa para tratar distúrbios respiratórios, e a (−)-estemoamida também atua como anti-helmíntico. Somfai e seus colaboradores empregaram um acoplamento de Negishi em sua síntese de (−)-estemoamida.[38] A reação foi implementada no meio da síntese, formando uma ligação C–C sp3-sp2 entre um éster β,γ-insaturado e um dieno intermediário (4) com um rendimento de 78% do produto (5). Somfai completou a síntese total estereosseletiva de (−)-estemoamida em 12 etapas com um rendimento total de 20%.
Kibayashi e seus colaboradores utilizaram o acoplamento de Negishi na síntese total da Pumiliotoxina B. Essa é um dos principais alcaloides tóxicos isolados de Dendrobates pumilio, um sapo venenoso do Panamá. Esses alcaloides tóxicos exibem efeitos modulatórios nos canais de sódio dependentes de voltagem, resultando em atividade cardiotônica e miotônica.[39] Kibayashi empregou o estágio final do acoplamento de Negishi na síntese da Pumiliotoxina B, acoplando um carbono sp3 homoalílico na zinco alquilideno indolizidina (6) com o iodeto de (E)-vinila (7) com um rendimento de 51%. O produto foi, então, obtido após a desproteção.[40]

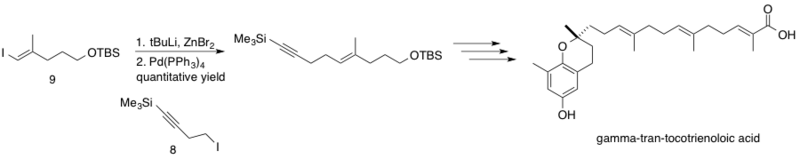
O ácido δ-trans-tocotrienoloico, isolado da planta Chrysochlamys ulei, é um produto natural que inibe a DNA polimerase β (pol β), a qual repara o DNA via excisão de bases. A inibição da pol β em conjunto com outras drogas quimioterápicas pode aumentar a citotoxicidade desses quimioterápicos, levando a dosagens efetivas mais baixas. O acoplamento de Negishi foi implementado na síntese do ácido δ-trans-tocotrienoloico por Hecht e Maloney acoplando o reagente sp3 homopropargil zinco (8) com o sp2 iodeto de vinila (9).[41] A reação prosseguiu com rendimento quantitativo, acoplando fragmentos no decorrer da síntese até a obtenção do produto sintetizado estereosseletivamente.
Smith e Fu demonstraram que seu método para acoplar nucleófilos secundários e eletrófilos alquila secundários poderia ser aplicado à síntese formal de α-cembra-2,7,11-trieno-4,6-diol, um alvo com atividade antitumoral. Eles alcançaram um rendimento de 61% em uma escala de gramas usando seu método para acoplar um grupo iso-propil. Tal método seria altamente adaptável nessa aplicação para a diversificação e instalação de outros grupos alquila, propiciando estudos de relação estrutura-atividade (ou SAR, do termo em inglês structure-activity ratio).[42]
Kirschning e Schmidt aplicaram o acoplamento de Negishi catalisado por níquel para a primeira síntese total de carolactona. Nessa aplicação, obtiveram 82% de rendimento e razão diastereoisomérica de 10:1.[43]

Preparo de precursores organozinco[editar | editar código-fonte]
Os reagentes alquilzinco podem ser adquiridos a partir dos brometos de alquila correspondentes usando iodo em dimetilacetamida (DMAC).[44] O I2 catalítico ativa o zinco para a adição nucleofílica.
Compostos arilzinco podem ser sintetizados em condições reacionais brandas por meio de um intermediário do tipo Grignard.[45]
Compostos organozinco também podem ser gerados in situ e usados em um procedimento one-pot como demonstrado por Knochel et al.[46]

Ver também[editar | editar código-fonte]
Ligações externas[editar | editar código-fonte]
- O acoplamento Negishi em www.organic-chemistry.org
Referências
- ↑ King, Anthony O.; Okukado, Nobuhisa; Negishi, Ei-ichi (1977). «Highly general stereo-, regio-, and chemo-selective synthesis of terminal and internal conjugated enynes by the Pd-catalysed reaction of alkynylzinc reagents with alkenyl halides». Journal of the Chemical Society, Chemical Communications (19). 683 páginas. doi:10.1039/C39770000683
- ↑ Kürti, László; Czakó, Barbara (2007). Strategic applications of named reactions in organic synthesis : background and detailed mechanisms ; 250 named reactions. Amsterdam: Elsevier Academic Press. ISBN 978-0-12-429785-2
- ↑ a b Zhou, Jianrong (Steve); Fu, Gregory C. (dezembro de 2003). «Cross-Couplings of Unactivated Secondary Alkyl Halides: Room-Temperature Nickel-Catalyzed Negishi Reactions of Alkyl Bromides and Iodides». Journal of the American Chemical Society (em inglês). 125 (48): 14726–14727. ISSN 0002-7863. PMID 14640646. doi:10.1021/ja0389366
- ↑ a b Negishi, Eiichi; King, Anthony O.; Okukado, Nobuhisa (1 de maio de 1977). «Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides». The Journal of Organic Chemistry. 42 (10): 1821–1823. ISSN 0022-3263. doi:10.1021/jo00430a041
- ↑ a b Gavryushin, Andrei; Kofink, Christiane; Manolikakes, Georg; Knochel, Paul (1 de outubro de 2005). «Efficient Cross-Coupling of Functionalized Arylzinc Halides Catalyzed by a Nickel Chloride−Diethyl Phosphite System». Organic Letters. 7 (22): 4871–4874. ISSN 1523-7060. PMID 16235910. doi:10.1021/ol051615+
- ↑ Baba S, Negishi E (1976). «A novel stereospecific alkenyl-alkenyl cross-coupling by a palladium- or nickel-catalyzed reaction of alkenylalanes with alkenyl halides». Journal of the American Chemical Society. 98 (21): 6729–6731. doi:10.1021/ja00437a067
- ↑ Negishi E, King AO, Okukado N (1977). «Selective carbon-carbon bond formation via transition metal catalysis. 3. A highly selective synthesis of unsymmetrical biaryls and diarylmethanes by the nickel- or palladium-catalyzed reaction of aryl- and benzylzinc derivatives with aryl halides». The Journal of Organic Chemistry. 42 (10): 1821–1823. doi:10.1021/jo00430a041
- ↑ a b c Strategic Applications of Named Reactions in Organic Synthesis. New York: Elsevier Academic Press. 2005
- ↑ Andrew G Myers Research Group. «Chemistry 115 Handouts». Boston, Massachusetts: Harvard University Department of Chemistry
- ↑ Casado AL, Espinet P (1998). «On the Configuration Resulting from Oxidative Addition of RX to Pd(PPh3)4 and the Mechanism of the cis-to-trans Isomerization of [PdRX(PPh3)2] Complexes (R = Aryl, X = Halide)». Organometallics. 17 (5): 954–959. doi:10.1021/om9709502
- ↑ McCann LC, Hunter HN, Clyburne JA, Organ MG (julho de 2012). «Higher-order zincates as transmetalators in alkyl-alkyl negishi cross-coupling». Angewandte Chemie. 51 (28): 7024–7. PMID 22685029. doi:10.1002/anie.201203547
- ↑ García-Melchor M, Braga AA, Lledós A, Ujaque G, Maseras F (novembro de 2013). «Computational perspective on Pd-catalyzed C-C cross-coupling reaction mechanisms». Accounts of Chemical Research. 46 (11): 2626–34. PMID 23848308. doi:10.1021/ar400080r
- ↑ a b Casares JA, Espinet P, Fuentes B, Salas G (março de 2007). «Insights into the mechanism of the Negishi reaction: ZnRX versus ZnR2 reagents». Journal of the American Chemical Society. 129 (12): 3508–9. PMID 17328551. doi:10.1021/ja070235b
- ↑ Fuentes B, García-Melchor M, Lledós A, Maseras F, Casares JA, Ujaque G, Espinet P (agosto de 2010). «Palladium round trip in the Negishi coupling of trans-[PdMeCl(PMePh2)2] with ZnMeCl: an experimental and DFT study of the transmetalation step». Chemistry. 16 (29): 8596–9. PMID 20623568. doi:10.1002/chem.201001332
- ↑ The Organometallic Chemistry of the Transition Metals. 4. Hoboken, NJ: John Wiley and Sons Inc. 2005
- ↑ Liu Q, Lan Y, Liu J, Li G, Wu YD, Lei A (julho de 2009). «Revealing a second transmetalation step in the Negishi coupling and its competition with reductive elimination: improvement in the interpretation of the mechanism of biaryl syntheses». Journal of the American Chemical Society. 131 (29): 10201–10. PMID 19572717. doi:10.1021/ja903277d
- ↑ Phapale, Vilas B.; Cárdenas, Diego J. (27 de maio de 2009). «Nickel-catalysed Negishi cross-coupling reactions: scope and mechanisms». Chemical Society Reviews (em inglês). 38 (6): 1598–1607. ISSN 1460-4744. PMID 19587955. doi:10.1039/B805648J
- ↑ Schley, Nathan D.; Fu, Gregory C. (26 de novembro de 2014). «Nickel-Catalyzed Negishi Arylations of Propargylic Bromides: A Mechanistic Investigation». Journal of the American Chemical Society. 136 (47): 16588–16593. ISSN 0002-7863. PMC 4277758
 . PMID 25402209. doi:10.1021/ja508718m
. PMID 25402209. doi:10.1021/ja508718m
- ↑ Morrell, Dennis G.; Kochi, Jay K. (1 de dezembro de 1975). «Mechanistic studies of nickel catalysis in the cross coupling of aryl halides with alkylmetals. Role of arylalkylnickel(II) species as intermediates». Journal of the American Chemical Society. 97 (25): 7262–7270. ISSN 0002-7863. doi:10.1021/ja00858a011
- ↑ Adam P. Smith, Scott A. Savage, J. Christopher Love, and Cassandra L. Fraser (2004). «Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi cross-coupling strategy: 5-methyl-2,2'-bipyridine». Org. Synth.; Coll. Vol., 10
- ↑ Ei-ichi Negishi, Tamotsu Takahashi, and Anthony O. King (1993). «Synthesis of biaryls via palladium-catalyzed cross-coupling: 2-methyl-4'-nitrobiphenyl». Org. Synth.; Coll. Vol., 8
- ↑ Ei-ichi Negishi, Tamotsu Takahashi, and Shigeru Baba (1993). «Palladium-catalyzed synthesis of conjugated dienes». Org. Synth.; Coll. Vol., 8
- ↑ Yu Y, Bond AD, Leonard PW, Lorenz UJ, Timofeeva TV, Vollhardt KP, Whitener GD, Yakovenko AA (junho de 2006). «Hexaferrocenylbenzene». Chemical Communications (24): 2572–4. PMID 16779481. doi:10.1039/b604844g
- ↑ Zhao Y, Wang H, Hou X, Hu Y, Lei A, Zhang H, Zhu L (novembro de 2006). «Oxidative cross-coupling through double transmetallation: surprisingly high selectivity for palladium-catalyzed cross-coupling of alkylzinc and alkynylstannanes». Journal of the American Chemical Society. 128 (47): 15048–9. PMID 17117830. doi:10.1021/ja0647351
- ↑ Yang Y, Oldenhuis NJ, Buchwald SL (janeiro de 2013). «Mild and general conditions for negishi cross-coupling enabled by the use of palladacycle precatalysts». Angewandte Chemie. 52 (2): 615–9. PMC 3697109
 . PMID 23172689. doi:10.1002/anie.201207750
. PMID 23172689. doi:10.1002/anie.201207750
- ↑ Giovannini, Riccardo; Stüdemann, Thomas; Dussin, Gaelle; Knochel, Paul (1998). «An Efficient Nickel-Catalyzed Cross-Coupling Between sp3 Carbon Centers». Angewandte Chemie International Edition (em inglês). 37 (17): 2387–2390. ISSN 1521-3773. PMID 29710957. doi:10.1002/(SICI)1521-3773(19980918)37:17<2387::AID-ANIE2387>3.0.CO;2-M
- ↑ Jensen, Anne Eeg; Knochel, Paul (1 de janeiro de 2002). «Nickel-Catalyzed Cross-Coupling between Functionalized Primary or Secondary Alkylzinc Halides and Primary Alkyl Halides». The Journal of Organic Chemistry. 67 (1): 79–85. ISSN 0022-3263. PMID 11777442. doi:10.1021/jo0105787
- ↑ Giovannini, Riccardo; Knochel, Paul (1 de novembro de 1998). «Ni(II)-Catalyzed Cross-Coupling between Polyfunctional Arylzinc Derivatives and Primary Alkyl Iodides». Journal of the American Chemical Society. 120 (43): 11186–11187. ISSN 0002-7863. doi:10.1021/ja982520o
- ↑ Fischer, Christian; Fu, Gregory C. (abril de 2005). «Asymmetric Nickel-Catalyzed Negishi Cross-Couplings of Secondary α-Bromo Amides with Organozinc Reagents». Journal of the American Chemical Society (em inglês). 127 (13): 4594–4595. ISSN 0002-7863. PMID 15796523. doi:10.1021/ja0506509
- ↑ Son, Sunghee; Fu, Gregory C. (1 de março de 2008). «Nickel-Catalyzed Asymmetric Negishi Cross-Couplings of Secondary Allylic Chlorides with Alkylzincs». Journal of the American Chemical Society (em inglês). 130 (9): 2756–2757. ISSN 0002-7863. PMID 18257579. doi:10.1021/ja800103z
- ↑ Phapale, Vilas B.; Buñuel, Elena; García-Iglesias, Miguel; Cárdenas, Diego J. (2007). «Ni-Catalyzed Cascade Formation of C(sp3)C(sp3) Bonds by Cyclization and Cross-Coupling Reactions of Iodoalkanes with Alkyl Zinc Halides». Angewandte Chemie International Edition. 46 (46): 8790–8795. ISSN 1521-3773. PMID 17918274. doi:10.1002/anie.200702528
- ↑ Johansson Seechurn CC, Kitching MO, Colacot TJ, Snieckus V (maio de 2012). «Palladium-catalyzed cross-coupling: a historical contextual perspective to the 2010 Nobel Prize». Angewandte Chemie. 51 (21): 5062–85. PMID 22573393. doi:10.1002/anie.201107017
- ↑ Sase S, Jaric M, Metzger A, Malakhov V, Knochel P (setembro de 2008). «One-pot Negishi cross-coupling reactions of in situ generated zinc reagents with aryl chlorides, bromides, and triflates». The Journal of Organic Chemistry. 73 (18): 7380–2. PMID 18693766. doi:10.1021/jo801063c
- ↑ Manley PW, Acemoglu M, Marterer W, Pachinger W (2003). «Large-Scale Negishi Coupling as Applied to the Synthesis of PDE472, an Inhibitor of Phosphodiesterase Type 4D». Organic Process Research & Development. 7 (3): 436–445. doi:10.1021/op025615q
- ↑ Torborg C, Beller M (2009). «Recent Applications of Palladium-Catalyzed Coupling Reactions in the Pharmaceutical, Agrochemical, and Fine Chemical Industries». Advanced Synthesis & Catalysis. 351 (18): 3027–3043. doi:10.1002/adsc.200900587
- ↑ Nicolaou KC, Bulger PG, Sarlah D (julho de 2005). «Palladium-catalyzed cross-coupling reactions in total synthesis». Angewandte Chemie. 44 (29): 4442–89. PMID 15991198. doi:10.1002/anie.200500368
- ↑ Lessene G (2004). «Advances in the Negishi coupling». Aust. J. Chem. 57 (1). 107 páginas. doi:10.1071/ch03225
- ↑ Torssell S, Wanngren E, Somfai P (maio de 2007). «Total synthesis of (-)-stemoamide». The Journal of Organic Chemistry. 72 (11): 4246–9. PMID 17451274. doi:10.1021/jo070498o
- ↑ Gusovsky F, Padgett WL, Creveling CR, Daly JW (dezembro de 1992). «Interaction of pumiliotoxin B with an "alkaloid-binding domain" on the voltage-dependent sodium channel». Molecular Pharmacology. 42 (6): 1104–8. PMID 1336116
- ↑ Aoyagi S, Hirashima S, Saito K, Kibayashi C (2002). «Convergent Approach to Pumiliotoxin Alkaloids. Asymmetric Total Synthesis of (+)-Pumiliotoxins A, B, and 225F». The Journal of Organic Chemistry. 67 (16): 5517–5526. PMID 12153249. doi:10.1021/jo0200466
- ↑ Maloney DJ, Hecht SM (setembro de 2005). «A stereocontrolled synthesis of delta-trans-tocotrienoloic acid». Organic Letters. 7 (19): 4297–300. PMID 16146411. doi:10.1021/ol051849t
- ↑ Smith, Sean W.; Fu, Gregory C. (2008). «Nickel-Catalyzed Negishi Cross-Couplings of Secondary Nucleophiles with Secondary Propargylic Electrophiles at Room Temperature». Angewandte Chemie International Edition. 47 (48): 9334–9336. ISSN 1521-3773. PMC 2790060
 . PMID 18972493. doi:10.1002/anie.200802784
. PMID 18972493. doi:10.1002/anie.200802784
- ↑ Schmidt, Thomas; Kirschning, Andreas (2012). «Total Synthesis of Carolacton, a Highly Potent Biofilm Inhibitor». Angewandte Chemie International Edition. 51 (4): 1063–1066. ISSN 1521-3773. PMID 22162345. doi:10.1002/anie.201106762
- ↑ Huo S (fevereiro de 2003). «Highly efficient, general procedure for the preparation of alkylzinc reagents from unactivated alkyl bromides and chlorides». Organic Letters. 5 (4): 423–5. PMID 12583734. doi:10.1021/ol0272693
- ↑ Giovannini R, Knochel P (1998). «Ni(II)-Catalyzed Cross-Coupling between Polyfunctional Arylzinc Derivatives and Primary Alkyl Iodides». Journal of the American Chemical Society. 120 (43): 11186–11187. doi:10.1021/ja982520o
- ↑ Sase, Shohei; Jaric, Milica; Metzger, Albrecht; Malakhov, Vladimir; Knochel, Paul (19 de setembro de 2008). «One-Pot Negishi Cross-Coupling Reactions of In Situ Generated Zinc Reagents with Aryl Chlorides, Bromides, and Triflates». The Journal of Organic Chemistry (em inglês). 73 (18): 7380–7382. ISSN 0022-3263. PMID 18693766. doi:10.1021/jo801063c

![{\displaystyle {\begin{matrix}{}\\{\ce {Ar-I->[{\begin{matrix}{\ce {iPrMgCl}}\\{\text{THF}}\end{matrix}}][{\ce {ZnBr2}}]Ar-ZnBr}}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/207cdded6086749bdb7e5dd64cf22c29306ff367)