Síntese de Kiliani-Fischer
Este artigo ou secção contém uma lista de referências no fim do texto, mas as suas fontes não são claras porque não são citadas no corpo do artigo, o que compromete a confiabilidade das informações. (Dezembro de 2021) |
A síntese de Kiliani-Fischer, em homenagem aos químicos alemães Heinrich Kiliani e Hermann Emil Fischer, é um método usado para sintetizar monossacarídeos. Ele consiste nas síntese e hidrólise de uma cianoidrina, levando ao alongamento da cadeia carbônica de uma aldose em um átomo de carbono e preservando a configuração estereoquímica de todos os carbonos quirais previamente presentes. O novo carbono quiral é produzido com ambas as configurações, sendo o produto final da síntese uma mistura de dois açúcares diastereoisoméricos diferindo na configuração de apenas um carbono (por isso chamados epímeros). A título de exemplo, D-arabinose é convertida em uma mistura de D-glicose e D-manose.
Síntese clássica de Kiliani-Fischer[editar | editar código-fonte]
A versão original da síntese de Kiliani-Fischer ocorre através dos intermediários cianoidrina, ácido aldônico e lactona. O primeiro passo é promover a reação entre o açúcar inicial e um cianeto aquoso (tipicamente NaCN); o cianeto passa por adição nucleofílica ao grupo carbonila do açúcar (enquanto os açúcares tendem a existir principalmente como hemiacetal cíclico, eles estão sempre em equilíbrio químico com suas formas de aldeído ou cetona de cadeia aberta, sendo, no caso de tais aldoses, essa forma de aldeído que reage na síntese). A cianoidrina resultante dessa adição é aquecida em água, a qual hidrolisa o cianeto a uma carboxila que reage rapidamente consigo mesma para formar uma lactona mais estável. Nessa etapa, existem duas lactonas diastereoisoméricas na mistura reacional. Elas são separados (por cromatografia, partição em diferentes solventes ou outro método de separação) e, em seguida, a lactona desejada é reduzida com uma amálgama de sódio. Conforme ilustrado abaixo, a D-arabinose é convertida em uma mistura de D-glucononitrila e D-manononitrila, a qua é então convertida em D-gluconolactona e D-manonolactona, substâncias separadas e reduzidas a D-glicose ou a D-manose. O rendimento químico desde método é estimado em cerca de 30%.
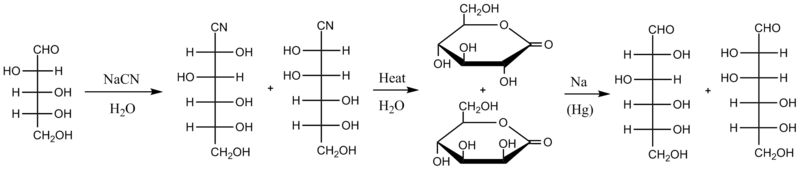
Versão otimizada[editar | editar código-fonte]
Mais recentemente, foi desenvolvido um método de redução aprimorado que produz rendimentos um pouco melhores dos açúcares maiores. Nesse processo, em vez de ser convertida em lactona, a cianoidrina é reduzida com hidrogênio, usando paládio sobre sulfato de bário como catalisador e água como solvente, para formar uma imina. Devido à presença de água, a imina é rapidamente hidrolisada para formar um aldeído. Desse modo, os açúcares resultantes são produzidos em apenas duas etapas em vez de três. A separação dos isômeros é, então, realizada entre os próprios açúcares produzidos, não entre as lactonas intermediárias. O catalisador especial é necessário para evitar a redução adicional do grupo aldeído a um grupo hidroxila, o que produziria um alditol. Esses catalisadores que limitam a hidrogenação a uma etapa são chamados de catalisadores envenenados; O paládio de Lindlar é outro exemplo. As reações abaixo ilustram esse método otimizado para a conversão de L-treose em L-lixose e L-xilose.

Usos e limitações[editar | editar código-fonte]
mbos os enantiômeros do gliceraldeído estão disponíveis comercialmente. Portanto, pode-se acessar quaisquer estereoisômeros de aldoses com cadeias de quaisquer tamanho por um número apropriado de aplicações repetidas da síntese de Kiliani-Fischer. A triose D-gliceraldeído (1) leva às tetroses D-eritrose (2a) e D-treose (2b). Essas levam,respectivamente, às pentoses: D-ribose (3a) e D-arabinose (3b); e D-xilose (3c) e D-lixose (3d). A iteração seguinte leva às hexoses: D-alose (4a) e D-altrose (4b); D-glicose (4c) e D-manose (4d); D-gulose (4e) e D-idose (4f); e D-galactose (4g) e D-talose (4h). As D-heptoses e assim por diante são obteníveis continuando a sequência, e a série enantiomérica L é produzida iniciando-se a sequência com L-gliceraldeído.

Na prática, a síntese de Kiliani-Fischer é geralmente usada para a produção de açúcares de difícil ou impossível obtenção a partir de fontes naturais. Embora proporcione acesso a todos os estereoisômeros possíveis de qualquer aldose desejada, o processo é limitado por seu baixo rendimento e pelo uso de reagentes tóxicos. Além disso, ele exige um suprimento do açúcar inicial da série, o que pode exigir um trabalho sintético dispendioso se tal substância não estiver prontamente disponível. Outrossim, a realização de sucessivas iterações da síntese de Kiliani-Fischer reduz o rendimento global de modo aproximadamente exponencial para cada iteração adicional.
O processo fornece acesso direto apenas às aldoses, enquanto alguns açúcares de interesse podem ser cetoses. Algumas cetoses podem ser acessíveis a partir de aldoses semelhantes por isomerização via um intermediário enediol; por exemplo, glicose, frutose e manose interconvertem-se lentamente ao serem postas em repouso em base aquosa, uma vez que compartilham uma forma enediol. Alguns açúcares incomuns também são acessíveis por meio da adição de aldol.
Referências[editar | editar código-fonte]
- Carey, Francis A. (2006). Organic Chemistry, Sixth Edition, New York, NY: McGraw-Hill.ISBN 0-07-111562-5 .
