Baleia-de-minke
| Baleia-anã | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Comparação entre os tamanhos de uma baleia-anã e de um mergulhador
| |||||||||||||||||||
| Estado de conservação | |||||||||||||||||||
 Pouco preocupante (IUCN 3.1) [1] | |||||||||||||||||||
| Classificação científica | |||||||||||||||||||
| |||||||||||||||||||
| Nome binomial | |||||||||||||||||||
| Balaenoptera acutorostrata Lacépède, 1804 | |||||||||||||||||||
| Distribuição geográfica | |||||||||||||||||||
 | |||||||||||||||||||
 Distribuição de B. a. acutorostrata e B. a. scammoni
| |||||||||||||||||||
 Distribuição de B. bonaerensis
| |||||||||||||||||||
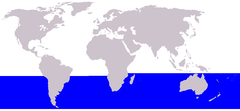 Distribuição da baleia-minke-antártica-anã ou pigmea
| |||||||||||||||||||
Balaenoptera acutorostrata (Lacépède, 1804), popularmente conhecida como baleia-anã, baleote, baleia-de-minke e finbeque (na região dos Açores), é o balenopterídeo (Balaenopteridae) ou rorqual de menor porte pertencente à subordem dos misticetos (Mysticeti). Sendo membros da família dos balaenopterídeos,[3] estes mamíferos marinhos caracterizam-se por possuírem barbas em vez de dentes (230-360 barbas por cada lado da maxila superior), uma forma corporal elegante e uma série de pregas (50-70) que se localizam na zona ventral da cabeça.[4]
Etimologia e vernáculos[editar | editar código-fonte]

Balaenoptera se origina da junção do termo latino ballaena, "baleia"[5] e do termo grego pterón, "asa".[6] É uma referência às suas longas barbatanas, que lhe permitem dar grandes saltos para fora da água. "Baleote" é o diminutivo irregular de "baleia".[5]
As origens do vernáculo baleia-de-minke são obscuras. Uma das primeiras referências ao nome veio no relato de Henrik Johan Bull de sua viagem de 1893 a 1895 à Antártica, quando mencionou a captura de uma pequena baleia "chamada na língua ártica de baleia Mencke, em homenagem a um alemão que acompanhou o Sr. Foyn em algumas de suas viagens."[7] De acordo com o escritor britânico John Guille Millais (The mammals of Great Britain and Ireland, 1906, vol. 3, p. 279), "Minkie era um marinheiro norueguês que sempre chamava 'Hval' qualquer barbatana traseira que viu. Agora é considerado o típico 'novato' no mar. Os noruegueses costumam se referir a qualquer pequena baleia com algum desprezo ou diversão como um 'Minkie' ou 'hval de Minkie'."[8] O biólogo marinho e pintor americano Richard Ellis, citando o cientista norueguês Age Jonsgård, afirmou "que Meincke era um operário alemão que trabalhava para Svend Foyn, inventor do arpão-granada. Um dia Meincke confundiu um cardume desta espécie de baleia com baleias-azuis (...) provavelmente cometeu este erro durante as operações baleeiras de Foyn no e fiorde de Varanger entre 1868 e 1885. "[9]
Antigamente, era conhecida como a pequena baleia picada (little piked whale), rorqual menor (lesser rorqual) e a de cabeça pontuda (sharp-headed finner). Os baleeiros americanos do século XIX simplesmente pensavam nelas como "jovens nadadeiras" ou um "filhote de baleia-comum", aparentemente sob a impressão de que eram juvenis de seu parente maior, a baleia-comum.[10] Também eram chamados de zwergwal (alemão: "baleia anã") ou vågehval (norueguês: "baleia da baía").[8] No Japão, são chamadas de koiwashi-kujira ("pequena baleia sardinha") ou minku-kujira ("baleia-de-minke").[11] Na Groenlândia, são conhecidas pelo nome dinamarquês sildepisker ("debulhadora de arenque").[12]
Taxonomia[editar | editar código-fonte]
Otto Fabricius, em seu Fauna Groenlandica (1780), foi o primeiro a descrevê-la, observando seu pequeno tamanho e barbatana branca - mas a descreveu erroneamente sob o nome de Balaena rostrata (a designação taxonômica para a baleia-bicuda). Em 1804, o Barão de Lacepede nomeou-o Balaenoptera acuto-rostrata, baseando sua descrição parcialmente no encalhe de uma fêmea juvenil de 4,26 metros perto de Cherburgo, França, em 1791.[8][13]
Em 1872, o baleeiro e naturalista americano Charles Melville Scammon a descreveu e chamou Balaenoptera davidsoni, em homenagem a uma fêmea grávida de 8,3 metros (27 pés) que foi encontrada morta na costa norte de Admiralty Inlet em outubro de 1870 no então Território de Washington (atual estado de Washington) e rebocado para Port Townsend Bay pelo pescador italiano, que a destruiu na praia. Scammon mencionou seu "tamanho de anão", "cabeça pontiaguda", "barbatana dorsal falcada" e a "faixa branca" em seus "peitorais excessivamente pequenos e pontiagudos". Em 1877, o geólogo e paleontólogo italiano Giovanni Capellini descreveu e nomeou Sibbaldius mondini um espécime jovem que foi capturado ao largo da Itália em 1771. Ambos foram posteriormente sinonimizados com B. acutorostrata.[10][14]
Uma forma menor de baleia-de-minke no hemisfério sul com nadadeiras brancas foi descrita pela primeira vez em estudos separados por Peter Best (1985) e Peter Arnold, Helene Marsh e George Heinsohn (1987), embora uma forma de nadadeiras brancas no hemisfério sul tinha sido notado anteriormente. O primeiro descreveu uma "forma diminuta" baseada em espécimes capturados em Durbã, África do Sul, enquanto o último nomeou uma "forma anã" com base em espécimes e avistamentos da Austrália. Esta subespécie não nomeada tem uma nadadeira branca proeminente e uma mancha escura na garganta, enquanto o que foi chamado de forma "de ombros escuros" ou "comum" de baleia-de-minke (agora conhecida como uma espécie separada, a baleia-de-minke-antártica, B. bonaerensis) não tinha essas marcações contrastantes.[15][16]
Até recentemente, todas as baleias-de-minke eram consideradas uma única espécie. No entanto, a baleia-de-minke comum foi reconhecida como uma espécie separada da baleia-de-minke-antártica com base em testes de DNA mitocondrial. Este teste também confirmou que a baleia-de-minke-antártica é o parente mais próximo da baleia-de-minke comum, confirmando assim a validade do clado.[17]
Divergência[editar | editar código-fonte]
As baleias-de-minke comuns e da Antártica divergiram umas das outras no hemisfério sul 4,7 milhões de anos atrás, durante um período prolongado de aquecimento global no início do Plioceno, que interrompeu a Corrente Circumpolar Antártica e criou bolsões locais de ressurgência, facilitando a especiação por fragmentar as populações. A radiação das baleias-de-minke comuns no hemisfério norte ocorreu rapidamente cerca de 1,5 milhão de anos atrás, durante um período de resfriamento no Pleistoceno.[18]
Híbridos[editar | editar código-fonte]
Houve dois híbridos confirmados entre baleias-de-minke comuns e antárticas. Ambos foram capturados no nordeste do Atlântico Norte por navios baleeiros noruegueses. O primeiro, uma fêmea de 8,25 metros (27,1 pés) retirada do oeste de Spitsbergen (78 ° 02′N 11 ° 43′E) em 20 de junho de 2007, foi o resultado de um emparelhamento entre uma minke antártica fêmea e um minke comum macho. A segunda, uma fêmea grávida retirada do noroeste de Spitsbergen (79 ° 45′N 9 ° 32′E) em 1 de julho de 2010, por outro lado, tinha uma mãe minke comum e um pai minke antártico. Seu feto feminino, por sua vez, foi gerado por uma minke comum do Atlântico Norte, demonstrando que o retrocruzamento é possível entre híbridos das duas espécies.[19][20]
Descrição[editar | editar código-fonte]
Tamanho[editar | editar código-fonte]


A baleia-de-minke é a menor dos rorquais e uma das menores baleias de barbatanas (a segunda menor apenas para a baleia-franca-pigmeia). No Atlântico Norte, os navios baleeiros noruegueses em 1940 supostamente capturaram indivíduos de até 10,7 metros (35 pés) de comprimento, mas provavelmente só foram medidos visualmente em comparação com objetos de dimensões conhecidas a bordo dos próprios navios - os mais longos capturados nos anos subsequentes tinham tipicamente até 9,4–10,05 metros (30,8–33,0 pés) de comprimento.[21] No Pacífico Norte, os navios soviéticos operando nas ilhas Curilas alegaram ter capturado dois machos de 12,2 (40 pés) e 12 metros (39 pés) e uma fêmea de 10,7 metros (35 pés) - os dois primeiros desembarcaram em 1951, o terceiro em 1960.[22]
Os mais longos medidos por cientistas islandeses foram um macho de 8,7 metros (29 pés) e uma fêmea de 9 metros (30 pés), enquanto os mais longos capturados pelos japoneses no oeste do Pacífico Norte foram machos de 8,5 metros (28 pés) e uma fêmea de 9,1 metros ( 30 pés) - a última capturada no leste de Hocaido em 1977.[23][24] Para a forma anã, o mais longo relatado é um macho de 7,62 metros (25,0 pés) capturado em maio de 1973 e uma fêmea de 7,77 (25,5 pés) capturada em maio de 1970, ambos retirados da África do Sul.[15]
Os machos capturados no oeste do Pacífico Norte e pesados inteiros em uma balança de caminhão tiveram em média entre 2,85 e 4,23 toneladas métricas (3,14 e 4,66 toneladas curtas) (faixa: 0,86 a 6,36 toneladas métricas; 0,95 a 7,01 toneladas curtas), enquanto as fêmeas tiveram uma média de 1,93 e 3,63 toneladas métricas (2,13 e 4,00 toneladas curtas) (faixa: 0,84 a 8,35 toneladas métricas; 0,93 a 9,20 toneladas curtas).[25][26][27][28][29][30][31][32][33]
Na maturidade sexual, os machos e as fêmeas no Atlântico Norte têm em média entre 6,16-6,75 metros (20,2-22,1 pés) e 6,03-7,15 metros (19,8-23,5 pés), enquanto no Pacífico Norte a média é entre 6,3-6,8 metros (21- 22 pés) e 7,1–7,3 metros (23–24 pés). Na maturidade física, machos e fêmeas no Atlântico Norte são em média entre 7,9-8,17 metros (25,9-26,8 pés) e 8,42-8,5 metros (27,6-27,9 pés), enquanto no Pacífico Norte são ligeiramente menores, com média de apenas 7,5 e 8 metros (25 e 26 pés), respectivamente. Ao nascer, são estimados em 2,5–2,8 metros (8,2–9,2 pés) de comprimento e pesando 150–300 quilos (330–660 libras). Acredita-se que sejam desmamados em cerca de 4,57 metros (15,0 pés) de comprimento.[11][23][24][34] Para a forma anã, acredita-se que atinjam a maturidade sexual em torno de 6,2 metros (20 pés) para as fêmeas e 6 metros (20 pés) para os machos e estima-se que tenham cerca de 2 metros (6,6 pés) ao nascer.[15][35] Quando adultos, em média, estes animais apresentam um peso máximo de cerca de 9200 quilos.[36]
Aparência[editar | editar código-fonte]
Forma do norte[editar | editar código-fonte]


As baleias-de-minke-comuns estão entre os membros mais robustos de seu gênero, sendo a maior altura de seu corpo um quinto do comprimento total. Têm um rostro estreito, pontiagudo e triangular com um resguardo de respingos baixo. Sua barbatana dorsal proeminente, ereta e falcada tem em média cerca de 30 centímetros (12 polegadas) de altura - variando de 7 a 77 centímetros (2,8 a 30,3 polegadas) - e é inserida cerca de dois terços ao longo do dorso. São cinza escuro dorsalmente e branco limpo ventralmente. A mandíbula inferior se projeta além da mandíbula superior[37] e é cinza escuro em ambos os lados - embora, como a forma anã, possa ter uma mandíbula branca no canto posterior da mandíbula inferior direita. Uma sela rostral cinza clara indistinta pode estar presente, e alguns indivíduos podem ter estrias claras e finas saindo do espiráculo. Uma divisa fina, cinza claro, direcionada para a frente, chamada de faixa do ombro, encontra-se entre as nadadeiras peitorais. Duas faixas cinza claro a esbranquiçadas, chamadas de tórax e manchas de flanco, unem-se ventralmente na região médio-lateral, sendo a primeira a mais brilhante das duas. As barbatanas peitorais são relativamente pequenas, com média de cerca de 73 centímetros (cerca de 2,4 pés) de comprimento (máximo: 1,38 metros, ou cerca de 4,5 pés). Possuem uma faixa transversal branca nas margens externas, que é a característica mais marcante da espécie. Na maioria dos indivíduos (cerca de 94% no oeste do Pacífico Norte) é uma faixa branca clara, mas em uma minoria dos casos (cerca de 6%), apenas forma uma faixa branca obscura - cerca de 29% dos indivíduos amostrados no Mar do Japão tinha esse tipo de faixa. Sua cauda tem em média cerca de 2 metros (6,6 pés) de largura, podendo alcançar quase 3 metros (cerca de 9,8 pés). É cinza clara ou branco ventralmente e delimitada por cinza escuro. Suas barbas, que totalizam cerca de 230 a 360 pares e uma média de cerca de 20 por 10 centímetros (7,9 por 3,9 polegadas), são brancas cremosas com uma fina franja branca - uma pequena porcentagem no oeste do Pacífico Norte (principalmente indivíduos maiores) têm uma fina faixa preta ao longo da margem externa. Possuem de 50 a 70 finas pregas ventrais, que se estendem apenas cerca de 47 por cento do comprimento do corpo - entre os mais curtos em relação ao comprimento do corpo entre os rorquais, perdendo apenas para a baleia-sei.[38][39][40]
Forma anã[editar | editar código-fonte]

A baleia-de-minke-anã tem proporções semelhantes à forma do norte, com uma barbatana dorsal ereta e em forma de gancho inserida em cerca de dois terços do caminho ao longo do dorso que tem até 32 a 34 centímetros (13 a 13 polegadas) de altura. Possui 55 a 67 sulcos ventrais. Sua barbatana - 18 a 20 centímetros (7,1 a 7,9 polegadas) de comprimento - é principalmente branca, com até 45 por cento das placas posteriores sombreadas de preto a cinza escuro ao longo de suas margens externas.[15][16][41][42]
A forma anã tem a coloração mais complexa de barba. Campos e capas cinza-escuros alternam com chamas, manchas e listras cinza claras e brancas. O campo espinhal cinza escuro fica acima de um campo ventral branco-marfim. Este campo espinhal se estende para baixo em um campo da nuca, que separa uma sela rostral cinza claro e uma placa de tórax cinza claro, triangular, geralmente pontiaguda para a frente. O campo da nuca, por sua vez, se estende ainda mais para baixo em uma mancha escura na garganta, que desce até as pregas ventrais e se estende de volta à frente das nadadeiras peitorais. Mais para trás, o campo espinhal se estende em um campo torácico escuro, que geralmente forma um triângulo invertido entre a placa do tórax e a placa lateral cinza claro. Este remendo pode ser separado em um remendo anterior e posterior por um preenchimento de flanco triangular escuro ou mesmo ondulado. Finalmente, o campo do pedúnculo escuro cobre a porção posterior do pedúnculo caudal até as pontas do lado dorsal da cauda, que são brancas ventralmente e finamente delimitadas por cinza escuro.[43]
As características mais proeminentes na forma anã são a nadadeira branca e as ombreiras. O primeiro cobre os dois terços proximais da barbatana peitoral e continua ao longo de sua dianteira, enquanto o último se conecta à parte superior do tórax. Uma mancha auxiliar oval escura de tamanho variável (anteriormente chamada de "oval de nadadeira") fica atrás da barbatana peitoral, muitas vezes parecendo fundir-se com a mancha de nadadeira distal cinza escuro, que ocupa o terço distal da nadadeira peitoral. Este remendo auxiliar geralmente é completamente separado do remendo do tórax pelo branco da linha do ombro e uma extensão vertical do campo ventral, mas também pode se anexar a ele de maneira estreita ou ampla. Uma mancha na mandíbula geralmente cobre o terço posterior da mandíbula inferior direita, enquanto o lado esquerdo é normalmente cinza escuro. Da mesma forma, um olho esbranquiçado geralmente está presente no lado direito, mas raramente no esquerdo. A sela rostral também apresenta coloração assimétrica, estendendo-se mais à direita do que à esquerda e tendo a margem posterior direita mais bem definida; a esquerda, entretanto, frequentemente tem uma margem posterior difusa. Um pedúnculo branco se estende do campo ventral, sendo delimitado em cada lado por divisas duplas caudais cinza claro, que se estendem para baixo a partir do campo do pedúnculo e do flanco, respectivamente.[16][43]
Uma linha cinza claro, fina e de formato variável, chamada de faixa na nuca (análoga à "faixa do ombro" ou "divisa" da forma do norte), se estende lateralmente para baixo nas costas entre as nadadeiras peitorais. Pode apontar para frente, para trás ou formar uma linha reta; esta variabilidade pode ajudar na identificação. Um par de listras cinza claro do respidadouro se estendem posteriormente atrás do espiráculo, geralmente curvando-se para a esquerda - a esquerda com mais força do que a direita. Ocasionalmente, listras finas nas orelhas podem estar presentes atrás da abertura do meato auditivo, enquanto manchas ou estrias claras ou escuras podem ocorrer ao longo dos flancos, bem como as chamadas listras de tigre - "listras paralelas, escuras, geralmente verticais". Como a baleia-de-bryde (e ocasionalmente as baleias-azuis e comuns), as minkes anões podem exibir cristas auxiliares em ambos os lados da crista central do rostro.[43]
Distribuição[editar | editar código-fonte]
Faixa[editar | editar código-fonte]
Têm uma distribuição desconexa. No Atlântico Norte, ocorrem ao norte como baía de Baffin, Esvalbarda, terra de Francisco José e Nova Zembla e ao sul até 40° N (Nova Jérsei) e nas Hébridas e no centro do mar do Norte durante o verão. Existem alguns registros da baía de Hudson (baía de James em 1986 e baía de Button em 1990), e também foram observadas ocasionalmente no estreito de Hudson e na baía de Ungava.[44][45][46] Foram registados ao largo da Madeira[47] e ocorrem durante todo o ano ao largo das ilhas Canárias. Ocorrem avistamentos ocasionais e encalhes na costa de Espanha e Portugal, Saara Ocidental, Mauritânia e Senegal. É rara perto dos Açores e perambula no golfo do México e no mar Mediterrâneo, com alguns registros do mar Negro (1880 e 1926).[14][48][49] Durante o inverno, foi registrado ao largo das Bermudas, Baamas, Antilhas, costa leste dos Estados Unidos ao sul de 40° N e no sudeste do Atlântico Norte entre 10° 40'N e 19° 35'N e 22° W e 20° 05' W.[50][51] No oeste e centro do Pacífico Norte, variam do Havaí,[52] as ilhas Marianas,[53] o mar da China Oriental, o mar Amarelo e o mar do Japão no sul até o mar de Ocótsqui e os mares de Bering e Chukchi em o norte.[54] No norte do Pacífico Oriental, ocorrem no golfo do Alasca ao sul ao longo de toda a costa oeste da América do Norte (incluindo os estados americanos do Alasca, Washington, Oregão[55] e Califórnia[56] e a província canadense da Colúmbia Britânica) até a Baixa Califórnia e o golfo da Califórnia.[57] Durante o inverno, foram registrados acusticamente principalmente entre 15° e 35° N no leste e centro do Pacífico Norte.[58]
A forma anã foi registrada no Brasil (junho a fevereiro, incluindo os estados do Maranhão, Paraíba, Bahia, Espírito Santo, Rio de Janeiro, São Paulo, Paraná, Santa Catarina e Rio Grande do Sul) de 2° 44'S a 33° 35'S,[35][59] Uruguai, Argentina,[60] no canal de Beagle e na passagem de Goree do sul do Chile (fevereiro a abril),[41] ao largo da África do Sul (maio a agosto),[15] Austrália (março a dezembro, incluindo Austrália Ocidental, Vitória, Nova Gales do Sul e Queenslândia),[16][61] Nova Zelândia (março a agosto),[42] Nova Caledônia,[16] Vanuatu, Fiji,[43] e até agora tão ao sul como as ilhas Xetlândia do Sul, o estreito de Gerlache e o mar de Bellingshausen (69 ° 25'S).[62]
População[editar | editar código-fonte]
Norte do Atlântico[editar | editar código-fonte]
Estima-se que haja mais de 180 000 espécimes no Atlântico Norte.[1] As pesquisas de avistamento realizadas no Atlântico Nordeste entre 1996 e 2001 resultaram em uma abundância estimada de 107 205 baleias, com 43 835 na região do mar de Barents, 26 718 em torno de Jan Mayen, 18 174 no mar da Groenlândia e ao redor do arquipélago de Esvalbarda e 17 895 no norte do mar do Norte.[63] Existem cerca de 67 225 baleias ao largo da Islândia.[1] Com base em um levantamento aéreo realizado nas águas entre o norte da ilha Disko (70° 45'N) e o cabo Farvel (60° N) durante agosto e setembro de 2005, estima-se que haja 4 856 indivíduos (intervalo de confiança de 95% (CV): 1.910 -12.348) ao largo da Groenlândia Ocidental; uma pesquisa com base em navios feita durante setembro e outubro do mesmo ano apresentou uma estimativa semelhante de 4 479 (IC de 95%: 1.760-11.394).[64][65] No golfo de São Lourenço, levantamentos aéreos de transecto linear feitos em agosto-setembro de 1995 e julho-agosto de 1996 estimaram que havia 1 020 indivíduos, com cerca de 75% deles na plataforma da Costa Norte.[66]
Norte do Pacífico[editar | editar código-fonte]
Pesquisas de avistamento baseadas em navios que cobriram o mar de Ocótsqui durante agosto de 1989 e agosto-setembro de 1990 e áreas adjacentes do noroeste do Pacífico durante julho e agosto de 1990 estimaram que havia 25 049 (IC de 95%: 13 700-45 800) espécimes lá, com 19 209 ( IC de 95%: 10 100-36 600) no Mar de Ocótsqui e 5 841 (IC de 95%: 2 800-12 000) no Noroeste do Pacífico.[67] Uma pesquisa de avistamento conduzida no Mar de Bering central entre julho e agosto de 1999 estimou que havia 936 (IC 95%: 473-1 852) indivíduos nessas águas, enquanto pesquisas de avistamento de transecto linear que cruzaram das ilhas Aleutas centrais a leste da península de Quenai de julho a agosto de 2001 a 2003, estimou-se que havia 1 232 (IC 95%: 646-2 346) baleias naquela área, com a maioria dos avistamentos ao redor das ilhas Aleutas orientais, particularmente em e ao redor do passo de Seguam e as ilhas das Quatro Montanhas; alguns avistamentos também foram feitos ao longo da península do Alasca e perto da ilha Kodiak.[68][69] Nas águas costeiras da Colúmbia Britânica, estima-se que existam 475 (95% CI: 221-1 020) baleias com base em avistamentos de transectos lineares realizados em navios durante os verões de 2004 e 2005.[70]
Hemisfério Sul[editar | editar código-fonte]
Não há estimativas populacionais da baleias-de-minke-anãs devido aos levantamentos de avistamentos que não foram capazes de distingui-las da baleia-de-minke-antárticas, que são muito mais comuns.[1]
Ocorrência[editar | editar código-fonte]
Fidelidade ao local[editar | editar código-fonte]
As baleias-de-minke foram identificadas individualmente usando a forma da nadadeira dorsal e cortes ao longo de suas bordas, variações na pigmentação lateral do corpo e pequenas cicatrizes ovais em três locais de estudo separados na costa oeste da América do Norte. Esses indivíduos mostraram forte fidelidade local em pequena escala. Um total de 55 baleias foram identificadas, 30 nas ilhas de São João do estado de Washington de 1980 a 1984, 17 na área da baía de Monterey, na Califórnia central de 1984 a 1987, e oito na área do estreito de Johnstone na Colúmbia Britânica de 1981 a 1987 - embora na última região a maioria só tenha sido fotografada incidentalmente para o estudo das orcas. O número de avistamentos por indivíduo variou de apenas um em um ano a 37 em nove anos, com 31 baleias (56,4%) sendo avistadas em pelo menos dois anos e 12 (21,8%) sendo vistas em pelo menos cinco anos. A maioria foi vista exclusiva ou quase exclusivamente em uma das três sub-regiões nas ilhas de San Juan e uma das duas sub-regiões na área da Baía de Monterey.[40]
Nas ilhas de São João, 14 de 18 baleias estavam dentro de seu alcance primário em pelo menos 94 por cento dos avistamentos. Das três sub-regiões, Faixa A, a noroeste da ilha das Orcas, teve o constituinte mais estável, com cinco indivíduos vistos repetidamente durante o período de estudo, respondendo por todos, exceto um dos 88 avistamentos. A Faixa B, a leste das ilhas de São João, teve o constituinte menos estável, bem como o menor número de avistamentos por ano, enquanto a Faixa C, ao sul e a oeste das ilhas de São João, teve o maior número de avistamentos e o maior número de indivíduos identificados todo ano. Uma baleia, S4, foi repetidamente e consistentemente encontrada na Faixa B por três anos, mas nunca foi vista lá novamente depois de 1982; poucos avistamentos foram feitos desde então e todos ocorreram em 1984, a maioria deles envolvendo três baleias que eram normalmente encontradas na Faixa A (S8, S10 e S13). Na Faixa C, cinco baleias foram vistas lá todos os anos, enquanto sete foram vistas apenas em um único ano - a maioria dos últimos indivíduos nunca foi encontrada em qualquer outra parte do local de estudo. Também houve baleias que não mostraram nenhuma fidelidade local, movendo-se livremente entre as sub-regiões. Por exemplo, a baleia S9, embora tenha sido avistada apenas cinco vezes em quatro anos, teve avistamentos igualmente divididos entre as faixas B e C; a baleia S5, por outro lado, encontrada 27 vezes ao longo de oito anos, foi vista em mais de uma área na maioria dos anos e se moveu pelas três sub-regiões mais do que qualquer outra baleia.[40]
Na área da baía de Monterey, a Faixa A fica ao norte do desfiladeiro submarino que desagua na baía de Carmel, enquanto a Faixa B fica ao sul desse cânion. Os indivíduos foram avistados dentro de uma das duas faixas em pelo menos 88 por cento dos avistamentos, com baleias mesmo sendo observadas se virando ao se aproximarem da fronteira de sua faixa principal e voltando em direção ao meio de sua faixa - isso aconteceu cinco vezes na fronteira norte e duas vezes na fronteira sul da Faixa A, e seis vezes na fronteira norte da Faixa B. As baleias foram avistadas a 3 quilômetros (1,9 milhas) da costa, ocasionalmente fora das algas, na maioria das vezes movendo-se em uma linha mais ou menos reta.[40]
Durante um estudo realizado em torno da ilha de Mull, no noroeste da Escócia, entre 1990 e 1999 durante os meses de maio a outubro, 66 baleias-de-minke foram fotoidentificadas com base na forma da nadadeira dorsal e entalhes e marcas distintas nela, cicatrizes no corpo e cicatrizes ovais brancas - a pigmentação lateral do corpo frequentemente não era visível. Destes, 30 foram vistos pelo menos duas vezes, sendo 21 avistados há mais de um ano; um indivíduo foi identificado 27 vezes ao longo de dez anos. Durante um estudo semelhante realizado durante os cruzeiros de observação de baleias no exterior ao sul do estuário de Moray, no nordeste da Escócia, entre 2001 e 2007, de maio a outubro, 34 indivíduos foram identificados por foto. Quatorze deles (41%) foram avistados uma ou mais vezes, enquanto sete indivíduos (20%) foram vistos em um ou mais anos. Uma baleia foi vista três vezes entre 2002 e 2006; outras quatro vezes entre 2001 e 2006; e um terceiro, um total de oito vezes entre 2001 e 2006.[71][72]
Em um estudo de identificação por foto de baleias-de-minke ao largo da Islândia realizado entre 2001 e 2010, um total de 353 baleias foram identificadas individualmente: 292 na baía de Faxa, na costa sudoeste, e 61 na baía de Skjálfandi, na costa nordeste. Na baía de Faxa, 68 (23,3%) foram revistas pelo menos uma vez, sendo 53 (18,2%) revistas em dois anos, nove (3,1%) em três anos e seis (2,1%) em quatro anos. A maioria em Skjálfandi foi avistada apenas em um ano, enquanto dez (16,4%) foram avistadas pelo menos uma vez, quatro (6,6%) em dois anos e seis (9,8%) em três anos ou mais. Uma baleia, fotografada pela primeira vez na Baía de Skjálfandi em julho de 2002, mudou-se repetidamente entre os dois locais de estudo durante um período de quase dez anos, às vezes sendo avistada em ambas as áreas na mesma temporada.[73]
No estuário de São Lourenço, usando o formato da nadadeira dorsal e cicatrizes e pigmentação corporal lateral e cicatrizes, um total de 209 baleias foram identificadas individualmente durante os meses de verão entre 1999 e 2004. Trinta e cinco eram as chamadas "visitantes regulares", sendo avistadas em pelo menos 40 dias diferentes em quatro a seis anos diferentes. Vinte e cinco mostraram forte fidelidade local em pequena escala para a cabeça do canal Laurentian ou o fiorde de Saguenay, com mais de três quartos de seus avistamentos ocorrendo em uma dessas duas áreas.[74][75] Ao largo da Nova Escócia, quarenta indivíduos foram identificados de forma confiável usando entalhes da nadadeira dorsal durante os meses de verão (principalmente julho e agosto) entre 1997 e 2008. Destes, quatorze (35%) foram avistados em mais de um dia, enquanto apenas cinco (12,5%) foram observados em mais de um ano.[76]
Migrações e movimentos[editar | editar código-fonte]
Três baleias marcadas na Islândia mostraram movimentos em grande escala. Uma delas, marcada ao largo da costa norte em 20 de agosto de 2002, mudou-se pela primeira vez a nordeste da Islândia em 31 de outubro antes de seguir para o sul, atingindo 56° N 27° W em 8 de novembro. Outra, marcada na baía de Faxa em 14 de setembro de 2004, virou para o sul ao longo da dorsal Mesoatlântica cerca de duas semanas depois; seu último sinal foi recebido em 8 de outubro a cerca de 50° N 34° W. A terceira percorreu a maior distância. Depois de ser marcado na baía de Faxa em 27 de agosto de 2004, seu primeiro sinal não foi recebido até 17 de novembro, quando estava sobre a dorsal Mesoatlântica, 900 quilômetros (560 milhas) a oeste do norte da Espanha. A sua posição seguinte foi transmitida seis dias depois, cerca de 700 quilômetros (430 milhas) para sul, em torno dos Açores, enquanto o seu último sinal foi recebido a 5 de dezembro ao longo da corrente das Canárias, 1 000 quilômetros (620 milhas) a noroeste das ilhas de Cabo Verde. Ao todo, viajou 3 700 quilômetros (2 300 milhas) de seu local de marcação em pouco mais de 100 dias.[77]
No norte do Pacífico Oriental, baleias individualmente identificadas foram encontradas fazendo movimentos intra-anuais entre as áreas de alimentação. Duas viajaram do sul (abril) para o norte da ilha de Vancouver (julho), enquanto outra se mudou da costa sudoeste da ilha de Vancouver (junho) para a costa norte (julho-setembro) e outra da costa central da Colúmbia Britânica (julho) do sul ao norte da ilha de Vancouver (agosto a setembro). Duas baleias, incluindo uma das duas que viajaram do sul para o norte da ilha de Vancouver, mudaram-se do norte (junho e julho, respectivamente) para o sul da ilha de Vancouver (setembro).[78]
Quatro baleias-de-minke-anãs foram fixadas com etiquetas de satélite na ilha Lizard, na Grande Barreira de Corais, em julho de 2013. Todas as quatro seguiram a costa ao sul. Duas pararam de transmitir ao longo do sul de Queenslândia, enquanto as outras duas viajaram para o oeste através do estreito de Bass. A terceira logo parou de transmitir também. A quarta deixou de enviar sinais em 11 de outubro, momento em que atingiu 54° 23'S, viajando cerca de 6 000 quilômetros (3.700 milhas) de seu local de marcação original.[79]
Biologia[editar | editar código-fonte]
Reprodução[editar | editar código-fonte]

Essas baleias são sexualmente maduras por volta dos seis a oito anos de idade para as fêmeas e cerca de seis a sete anos para os machos.[34][80] Fêmeas são promíscuas.[81] Após um período de gestação de 10 meses, nasce um único filhote de 2,6 metros (8,5 pés) - apenas uma em 79 fêmeas maduras durante um estudo com baleias-de-minke na Islândia tinha fetos gêmeos, uma fêmea de 8,7 metros (29 pés) capturada em julho 2006, que teve um macho de 34 centímetros (13 polegadas) e uma fêmea de 32 centímetros (13 polegadas).[23] O filhote é desmamado após um período de seis meses. A pico de concepção é fevereiro no Atlântico Norte, final de fevereiro a meados de março para o "estoque O" (que migra ao longo da costa oriental do Japão para o mar de Ocótsqui) e entre outubro e novembro para o "estoque J" (que ocorre no mar Amarelo, mar da China Oriental e mar do Japão, e migra para o sul do mar de Ocótsqui na primavera, onde se mistura com o estoque O).[1][24] O pico de parto é dezembro no Atlântico Norte, dezembro a janeiro no Pacífico Norte e maio a julho para o estoque J.[82] O intervalo entre partos é de apenas um ano, então as fêmeas geralmente estão simultaneamente grávidas e amamentando. As fêmeas atingem a maturidade física talvez já aos 13 anos de idade; outro estudo sugeriu que o crescimento cessa para ambos os sexos quando têm 15 a 20 camadas de crescimento em suas bulas timpânicas, o que pode corresponder a cerca de 15 a 20 anos de idade.[34][80] Ambos os sexos podem viver até cerca de 50 anos de idade - o mais velho em um estudo de baleias-de-minke islandesas tinha 42 anos para fêmeas e 47 anos para machos, respectivamente.[23]
Alimentação[editar | editar código-fonte]
Tais baleias foram descritas como ictiófagas, mas sua dieta também inclui crustáceos pelágicos e cefalópodes e varia por região, estação e ano.
Atlântico Norte[editar | editar código-fonte]
No Atlântico Norte, comem principalmente peixes pequenos de cardume, peixes demersais e krill. Um estudo de 2007 mostrou que fora de Spitsbergen se alimentavam quase exclusivamente de eufausiídeos do gênero Thysanoessa (principalmente T. inermis), mas quase um quinto também se alimentava de pequenas quantidades de capelim (Mallotus villosus). Uma pequena percentagem de indivíduos, por frequência decrescente, também se alimentou de bacalhau polar (Boreogadus saida), bacalhau-do-atlântico (Gadus morhua), eglefim (Melanogrammus aeglefinus) e copépodes. Capelim dominava a ilha do Urso e no sul do mar de Barents, respondendo por cerca de três quartos de sua dieta em ambas as regiões. Quase metade (quase 46 por cento) também consumia eufausiídeos (Thysanoessa spp.) Na primeira área - eglefim (12,5%), verdinho (Micromesistius poutassou; 8,3%), bacalhau polar, bacalhau-do-atlântico, arenque-do-atlântico (Clupea harengus) e copépodes constituíam o resto. Arenque e eglefim também foram capturados no sul do mar de Barents (representando 41,5 e 28,7 por cento pela frequência de ocorrência, respectivamente), enquanto a galeota (Ammodytes spp.), bacalhau-do-atlântico, copépodes, eufausiídeos, escamudo (Pollachius virens) e verdinho compunham o resto da dieta. No mar da Noruega, o arenque foi encontrado em todos os indivíduos amostrados (n = 10), com alguns (20 por cento cada) também se alimentando de uma pequena quantidade de capelim e verdinho - um estudo anterior, baseado em dados obtidos principalmente entre 1943-1945, mostrou que se alimentavam exclusivamente de arenque de Vesterålen, enquanto a dieta em Lofoten era mais variada, incluindo arenque (34 por cento por ocorrência), crustáceos pelágicos (23%), bacalhau-do-atlântico (22%), eglefim (6%) e uma mistura de badejo (Pollachius virens) e pleuronectiformes para um indivíduo (1,5%).[83][84]
No mar do Norte, se alimentaram principalmente de galeota (62%) e cavala (Scomber scombrus; quase 30%), com alguns se alimentando de arenque (16,2%), pequenas quantidades de Maurolicus muelleri (10,8%), copépodes, eglefim, capelim e badejo-do-mar-negro (Merlangius merlangus). Descobriu-se que se alimentavam quase exclusivamente de cavala no norte do mar do Norte, enquanto o mesmo acontecia com a galeota no leste do mar do Norte.[83] Ao largo da Islândia, alimentavam-se principalmente de galeota (quase 58 por cento dos indivíduos amostrados), eglefim (22,6%), arenque (20%), capelim (19,4%) e bacalhau-do-atlântico (14,7%), com o resto da dieta consistindo em eufausiídeos, várias espécies maiores de gadíodes e Trisopterus esmarkii. A galeota foi mais importante no sul da Islândia (constituindo 78 por cento dos indivíduos amostrados), enquanto o capelim (35,1%), a eglefim (28,7%) e o bacalhau (22,3%) foram mais importantes no norte. Os eufausiídeos eram consumidos apenas no norte. Embora o eglefim tenha sido apenas uma pequena parte da dieta nos primeiros anos do estudo (0 e 4% em 2003 e 2004, respectivamente), posteriormente constituiu um componente principal dela (31-35% em 2005-2007), enquanto a importância da galeota no sul diminuiu consideravelmente (95,2 para 77,7% de 2003-2006, mas apenas 18,1% em 2007).[85] No sudeste da Groenlândia, só se alimentavam de capelim, enquanto a galeota dominava o sudoeste da ilha.[84] Em uma amostra de 172 baleias capturadas em Terra Nova e Labrador entre 1966 e 1972, a grande maioria (85%) se alimentou apenas de peixes, principalmente capelim. Alguns se alimentaram de uma mistura de capelim e bacalhau, enquanto outros consumiram apenas bacalhau. Outros gadíodes, arenque, krill e lula formavam o resto da dieta.[86]
Pacífico Norte[editar | editar código-fonte]
No Pacífico Norte, os peixes pequenos de cardume e o krill são os principais alimentos. Se alimentam exclusivamente de arenque-do-pacífico (Clupea pallasii) no mar de Ocótsqui do norte e apenas de Gadus chalcogrammus a leste da ilha de Sacalina. Scomber australasicus (encontrada em 61 por cento dos estômagos amostrados) e Cololabis saira (18%) são consumidos a leste das ilhas Curilas do sul, com apenas a primeira espécie sendo encontrada em baleias amostradas em setembro e a última espécie também sendo encontrada apenas em baleias em outubro. Os eufausiídeos constituem quase dois terços da dieta (62%) ao redor das ilhas Aleutas ocidentais, com peixes não identificados (19%) constituindo a maior parte do restante. No mar de Ocótsqui, em Hocaido, se alimentam principalmente de eufausiídeos (55%), mas também comem sardinha (24%) e amoditídeos (13%); no lado do pacífico de Hocaido, se alimentam quase exclusivamente de sardinha (99%). Em Sanricu, a sardinha constitui a maior parte da dieta (54%), mas os eufausiídeos também desempenham um papel importante (32%) - apenas uma pequena porcentagem (9%) alimentada com amoditídeos. Os eufausiídeos eram um importante item alimentar no lado do mar de Ocótsqui de Hocaido e ao largo de Sanricu na primavera (71, 72 e 62% de abril a junho na primeira área e 83% em abril na última área), enquanto a sardinha dominava o dieta no verão em ambas as áreas (71% em setembro para a primeira região e 70, 92 e 93% de maio a julho na última região).[87] Dados mais recentes de capturas científicas japonesas no oeste do Pacífico Norte mostram que a anchova-japonesa (Engraulis japonicus) é um componente importante da dieta em duas das três subáreas (60 por cento em peso na subárea 7 e 37,4% na subárea 8), enquanto Cololabis saira era o principal item alimentar na subárea 9 (64,6%) e desempenhava uma parte importante da dieta na subárea 8 (36,4%). Eufausiídeos (9,2% em todas as áreas combinadas), Gadus chalcogrammus (7,8% na subárea 7), Berryteuthis anonychus (4,9% na subárea 9) e cavala também foram consumidas.[88] Acredita-se que se alimentem de arenques juvenis e provavelmente de amoditídeos (Ammodytes hexapterus) ao redor das ilhas de São João, enquanto na região da baía de Monterey foram observados se alimentando de isca - provavelmente anchova-californiana (Engraulis mordax), que é abundante ali.[40]
Hemisfério Sul[editar | editar código-fonte]
No Oceano Antártico, as baleias-de-minke-anãs se alimentam principalmente de peixes mictofídeos.[89] Uma fêmea imatura capturada na região subantártica tinha eufausiídeos em seu estômago, enquanto duas fêmeas grávidas da mesma área haviam consumido peixe e um macho maduro tinha apenas mictofídeos.[90][91] Um macho imaturo pego em uma rede de emalhar no sul do Brasil tinha o estômago quase cheio com a eufausiídeo Euphausia similis.[92]
Predação[editar | editar código-fonte]
Houve numerosos casos registrados de orcas predando ou atacando baleias-de-minke em lugares como a península de Camchaca, Alasca, Colúmbia Britânica, estado de Washington, Califórnia, Golfo de São Lourenço, Groenlândia e Esvalbarda.[93][94][95] Normalmente são capazes de perseguir orcas em mar aberto ou ficam presas em uma baía, onde são abalroadas e afogadas ou encalham e morrem - em um caso, uma baleia-de-minke foi capaz de refluir na maré alta e nadar para longe. As perseguições geralmente duram cerca de 30 minutos a uma hora e podem atingir velocidades de até 30 quilômetros por hora, geralmente com as duas espécies saindo da água em saltos de baixo ângulo. Normalmente, duas a quatro orcas e uma minke solitária estão envolvidas. Se as orcas perseguidoras alcançam a minke, a última não se defende, o que é típico dos membros velozes de seu gênero. Em duas ocasiões, minkes em fuga buscaram abrigo sob um barco, uma vez ao largo de Yakutat, no Alasca, em 1977, e novamente na baía dos Glaciares, Alasca, em 1996 - em ambos os casos, foram atacadas e mortas. As orcas normalmente comem apenas a língua, a pele e um pouco da gordura das presas.[96]
Necrofagia[editar | editar código-fonte]
Tubarões-da-groenlândia (Somniosus microcephalus) foram encontrados limpando a gordura lançada ao mar durante as operações de caça à baleia-de-minke norueguesa ao largo de Esvalbarda.[97] Tubarões-brancos e azuis (Prionace glauca) também foram observados se alimentando de uma carcaça de baleia-de-minke na Califórnia.[98]
Quedas de baleias[editar | editar código-fonte]
Uma nova espécie de verme anelídeo siboglinídeo, Osedax mucofloris, foi descoberta na carcaça de uma baleia-de-minke fêmea de 5,3 metros experimentalmente colocada a uma profundidade de 125 metros (410 pés) no mar do Norte. Este gênero de verme usa bactérias endossimbióticas para se alimentar dos ossos das baleias que caem no fundo do mar.[99]
Parasitas e epibióticos[editar | editar código-fonte]
Essas baleias são hospedeiras de uma série de parasitas internos e externos, bem como comensais e outra fauna epibiótica. Ao largo da Islândia, 45,2 por cento (85 de 188) das amostradas apresentavam cicatrizes antigas de ataques da lampreia Petromyzon marinus, enquanto outros 10,6 por cento tinham cicatrizes recentes na parte posterior de seus flancos; cinco foram encontrados com lampreias vivas ainda agarradas à carne. O copépode Caligus elongatus foi encontrado em 11,9 por cento dos indivíduos, com uma intensidade média (M.I.) de 95,5 por baleia - o hiperparasita monogenético Udonella caligorum também foi encontrado ligado a 22 (6,6%) de uma subamostra de 332 C. elongatus. Outro copépode, Pennella balaenopterae, foi encontrado ancorado na carne de 10,3 por cento das baleias (M.I. 1.6, com um máximo de cinco). O piolho da baleia Cyamus balaenopterae foi encontrado na pele de 6,5 por cento das baleias (M.I. 37), enquanto a o cirripídeo Xenobalanus globicipitis foi encontrada na pata de três baleias (M.I. 5.3). Um único indivíduo de percebe Conchoderma auritum foi encontrado preso a uma placa de barbatana que pertencia a um macho de 7,9 metros (26 pés) capturado na costa noroeste em 2005, enquanto quatro C. virgatum foram encontrados presos a um espécime de P. balaenopterae em uma fêmea de 5,3 metros (17 pés) capturada na costa norte em 2003.[100]
No estuário de São Lourenço, no leste do Canadá, lampreias (P. marinus) foram vistas em 47 baleias individualmente identificadas em mais de 100 ocasiões entre 1999 e 2004. Foram vistas nas baleias de junho a outubro, com pico de avistamentos em julho e agosto. Entre uma e quatro lampreias foram encontradas por baleia; a maioria foi inserida abaixo ou atrás da barbatana dorsal. Em dezoito ocasiões, a mesma baleia foi vista várias vezes com uma ou mais lampreias presas ao mesmo local em seu corpo de dois a 87 dias, com uma média de quinze dias. Duas vezes baleias foram vistas logo depois que uma lampreia se desprendeu delas, revelando uma lesão sangrenta que mostrava que as lampreias estavam se alimentando de seu sangue. Em várias ocasiões, arranhões foram vistos nas baleias por lampreias movendo-se sobre seus corpos, provavelmente "procurando ativamente áreas de maior acesso ao sangue ou diminuição do fluxo de água".[101]
Entre uma amostra de 100 baleias capturadas no oeste do Pacífico Norte em 1995, 78% tinham o copépode P. balaenopterae ancorado em sua pele e gordura - o percebe C. virgatum foi encontrada preso a P. balaenopterae em três das baleias. O piolho da baleia C. balaenopterae foi encontrado na pele de quatro baleias, enquanto uma única baleia apresentava o cirripídeo X. globicipitis preso à pele. Todos os indivíduos amostrados foram infectados com o nematoide Anisakis simplex em seus estômagos (às vezes em seu intestino delgado) e o acantocéfalo Bolbosoma nipponicum em seu intestino delgado. Outros parasitas internos incluíram os cestoides Diphyllobothrium macroovatum, Diplogonoporus balaenopterae e Tetrabothius sp., que infectaram o intestino delgado e foram encontrados em 17 por cento da amostra (todas as três espécies combinadas).[102]
No leste do Pacífico Norte, quarenta e três das quarenta e quatro baleias individualmente identificadas possuíam o que se acreditava serem cicatrizes de tubarões-charuto (Isistius brasiliensis), enquanto três tinham X. globicipitis presos às suas nadadeiras dorsais. Ambas são principalmente espécies de água quente e podem ser evidências de migração de baleias da Colúmbia Britânica para águas tropicais.[78] Uma baleia macho imatura que encalhou na península de Banks, ilha Sul, Nova Zelândia, tinha um estômago fortemente infestado com o nematoide Anisakis e cistos do gênero cestoide Phyllobothrium encerrado no limite entre sua gordura e músculo, enquanto um macho imaturo capturado em uma rede de emalhar no sul do Brasil tinha um estômago fortemente infestado com nematoides dos gêneros Pseudoterranova (cerca de 97%) e Anisakis (cerca de 3%).[42][92]
Comportamento[editar | editar código-fonte]
Tamanho dos grupos[editar | editar código-fonte]
Baleias-de-minke são normalmente vistas individualmente. Nas ilhas de São João, embora até seis baleias pudessem ser vistas em uma área de alimentação ao mesmo tempo, geralmente agiam de forma independente, sem indicações de alimentação cooperativa como a observada em seus parentes maiores, a baleia-jubarte e a baleia-comum. Ocasionalmente, duas baleias podiam ser vistas emergindo ao mesmo tempo, a um ou dois corpos de distância uma da outra, com tais associações com as emersões podendo durar apenas por cerca de 90 minutos. Apenas uma vez três indivíduos foram vistos juntos realizando emersões. Na área da baía de Monterey, geralmente apenas uma baleia era visível por vez; em apenas quatro ocasiões foram vistas duas baleias nadando juntas. Em várias ocasiões, na área do estreito de Johnstone, pares e trios foram vistos brevemente emergindo juntos.[40] Em torno da ilha de Mull, cerca de 68 por cento dos avistamentos envolveram baleias isoladas, 26,5 por cento envolveram duas ou três baleias, enquanto apenas 5,4 por cento envolveram grupos de quatro a dez.[71] Ao largo da Groenlândia Ocidental e no golfo de São Lourenço e no sul do golfo do Maine, quase todos os avistamentos envolveram baleias solteiras.[65][66][103] Junto a Islândia, a maioria dos avistamentos (93%) foram de baleias solitárias, com apenas uma minoria dos encontros incluindo pares (4%) ou trios (menos de 3%).[104] Pares de filhotes estavam ausentes na maioria dessas regiões - um único par foi visto na ilha de Mull em 1992,[71] enquanto apenas três foram vistos no sul do golfo do Maine (em maio, agosto e outubro ).[103] De 89 avistamentos no mar de Ocótsqui e no noroeste do Pacífico, 80 foram de baleias solitárias, sete de pares, e cada um envolveu grupos de quatro e cinco baleias.[67]
As baleias-de-minke ocasionalmente saltam, às vezes limpando completamente a água - um indivíduo na área do estreito de Johnstone reagiu à aproximação de orcas forrageiras saltando oito vezes em rápida sucessão.[40] Todas as baleias-de-minke-anãs capturadas na África do Sul foram capturadas individualmente.[15] A maioria dos avistamentos na Grande Barreira de Corais envolveu baleias solteiras (53,3%) ou pares (28,9%), com o número máximo de indivíduos em um grupo sendo oito. Quatro pares de filhotes também foram vistos. Indivíduos encontrados nos vários sistemas de recife frequentemente se aproximam dos barcos de mergulho e os circundam, assim como os mergulhadores na água. Também foram vistos saltando.[61] No Brasil, os grupos normalmente consistiam de apenas um ou dois indivíduos, que evitam ativamente os barcos de observação de baleias e de pesca. Ali, foram vistos se associando com a alimentação de bandos de pássaros marinhos, geralmente atobás-pardos (Sula leucogaster), mas também gaivotas (Larus dominicanus) e gaivina (esternídeos) ocasionalmente.[105]
Segregação[editar | editar código-fonte]
Exibem um grande grau de segregação espacial e temporal por sexo, idade e condição reprodutiva. Ao largo da Groenlândia, as fêmeas dominam na costa oeste (compreendendo 68% dos indivíduos), enquanto os machos predominam na costa leste (57%). Na costa oeste, a proporção de fêmeas em mar aberto aumenta com a latitude, sendo mais baixa no sul (menos de 40% de 60 a 63 ° N) e mais alta no norte de 70 ° N (mais de 90%). As fêmeas dominam durante a primavera e o início do verão (compreendendo quase 79% dos indivíduos de maio a julho), enquanto a porcentagem de machos aumenta de 38 para 45 por cento no final do verão (agosto a setembro). Nas águas costeiras, a maior incidência de fêmeas ocorre na primavera (cerca de 85%), diminui no verão (72%) e aumenta novamente no outono (mais de 75%). Mais de 70 por cento das fêmeas maduras estão em zonas de mar aberto, quase todas grávidas (94,4%).[106][107][108][109][110]
Ao largo da Islândia, os machos dominam na maioria das áreas (particularmente na costa sudoeste, onde compreendem 70% dos indivíduos), enquanto as fêmeas constituem a ligeira maioria (53%) na costa leste. As fêmeas predominam na primavera na maioria das áreas (61%), enquanto os machos predominam no verão (58%) e no outono (66%).[111] No nordeste do Atlântico Norte, as fêmeas dominam ao redor do arquipélago de Esvalbarda e no mar de Barents (62,2 a 73,9%), enquanto os machos predominam ao redor das ilhas Britânicas e ao largo da Noruega (54,3 a 68,1%). Indivíduos maiores de ambos os sexos ocorrem principalmente mais ao norte (ao largo de Esvalbarda e no mar de Barents), enquanto os indivíduos menores ocorrem principalmente ao sul (por exemplo, ao longo da costa norueguesa de Lofoten ao sul, em uma área antes conhecida como um local de verão para filhotes recém-desmamados).[21][112] No Mar de Barents, mais de 40 por cento das fêmeas são maduras, com a grande maioria grávida (94,4%).[34]
No oeste do Pacífico Norte, animais maiores são normalmente encontrados em latitudes mais altas (por exemplo, no mar de Ocótsqui, ao sul das ilhas Curilas e ao redor das ilhas Comandante e Aleutas Ocidentais), enquanto animais menores, especialmente fêmeas, dominam nas latitudes mais baixas (por exemplo fora de Sanricu). O percentual de fêmeas maduras é alto nas áreas abertas (72,5 a 86,7%), com a maioria delas grávidas (85,7 a 100%). Nas áreas costeiras, entretanto, a maioria das fêmeas é imatura (60,4 a 94,2%) e menos fêmeas maduras estão grávidas (40 a 58,4%). As fêmeas dominam no norte do mar Amarelo (90,9%) e na costa leste da Coreia do Norte (69,2%), enquanto os machos predominam na costa oeste de Honxu (72,6%) e nas costas sudoeste e oeste de Hocaido (90,5 e 59,7 %). No sul do mar de Ocótsqui, as fêmeas chegam mais cedo que os machos (abril e maio, respectivamente), enquanto as fêmeas maduras chegam mais cedo que as imaturas.[113][114]
Sequência de emersão[editar | editar código-fonte]
Quando uma baleia-de-minke chega à superfície para respirar, seu rostro pontudo é o primeiro a romper a superfície. Ela pode exala primeiro ou dar um golpe estreito e difuso ou um golpe baixo, espesso e difuso. Em seguida, arqueia as costas em um movimento rápido, exagerando este arco durante seu mergulho profundo terminal. Frequentemente, o espiráculo e a nadadeira dorsal são visíveis ao mesmo tempo. Dependendo de seu comportamento, pode expirar em qualquer lugar de uma a sete vezes em rápida sucessão antes de entrar em um mergulho mais longo de vários minutos de duração. No golfo de São Lourenço, isso dependia de a baleia estar viajando, forrageando ou se alimentando. Durante a viagem, quando a baleia se movia mais lentamente (geralmente em linha reta), exalava o maior número de vezes (6,44 em média) e mergulhava por um período de tempo mais longo (3,67 minutos em média) do que quando estava se alimentando, que se caracterizava por uma mudança constante de direção e natação vigorosa - normalmente envolvia uma ou duas respirações intercaladas com três a sete (2,27 em média) seguidas por um mergulho relativamente curto (1,36 minutos em média). Quando uma baleia estava forrageando, por outro lado (o que envolvia a baleia se movendo a uma velocidade mais rápida do que viajar em uma espécie de movimento em zigue-zague), exalava 3,22 vezes em média e mergulhava o mais longo dos três modos (3,76 minutos em média ).[115]
Na área da baía de Monterey, sequências focais mostraram que respiraram em média 3,74 vezes durante uma sequência de ressurgimento. Esses mergulhos de curta duração tiveram em média 37,8 segundos e foram seguidos por um mergulho de longa duração de uma média de 4,43 minutos.[116] Nas ilhas de São João, o número de exalações e a duração dos mergulhos dependiam se a baleia estava se alimentando de estocada ou se alimentando com pássaros. No primeiro método de alimentação, as baleias faziam mergulhos curtos - cerca de 22 segundos de duração - até sete vezes em rápida sucessão antes de fazer um mergulho longo de cerca de 3,8 minutos, enquanto durante o último método faziam mergulhos curtos mais longos de cerca de 65 segundos seguidos por mergulhos longos mais curtos, de cerca de 1,5 minutos.[40]
Técnicas de alimentação[editar | editar código-fonte]
No golfo de São Lourenço, exibem três tipos de comportamento: manobras de aprisionamento, de engolfamento e de aprisionamento / engolfamento. As manobras de aprisionamento incluem círculos, giros, elipses, oito e hipérboles. Os círculos envolvem uma baleia, deitada de lado com a superfície ventral voltada para a presa pretendida, nadando em um círculo de 1,5 a 2,5 vezes seu diâmetro e avançando com a boca aberta em todo o diâmetro desse círculo. À medida que a baleia sobe na coluna d'água, o movimento de suas nadadeiras cria uma impressão ou traço. Os giros são versões maiores de círculos que diminuem constantemente de diâmetro à medida que a baleia realiza cada circuito. As elipses cobrem uma área maior do que as duas manobras anteriores, pois a baleia nada um eixo longo e curto - o primeiro pode ser maior que 100 metros (330 pés) às vezes. As elipses podem ser mantidas por longos períodos de tempo e podem incluir círculos de alimentação dentro delas, bem como uma série de manobras envolventes. Ao contrário dos círculos, os traços da superfície raramente são aparentes. Figura-de-oitos são versões menores de elipses, com um eixo longo de menos de seis comprimentos de corpo. A baleia gira em direções opostas em cada extremidade do eixo longo. As hipérboles envolvem a baleia girando pelo menos uma vez no final de uma curta corrida em linha reta - essa manobra às vezes é realizada ao longo de uma superfície rochosa, seguida por uma estocada voltada para dentro.[115]
As manobras de engolfamento incluem mergulhos, avanços oblíquos, laterais, verticais e ventrais. Durante os mergulhos, a baleia se aproxima da água em um ângulo de menos de 30 ° com sua superfície ventral voltada para baixo. Normalmente, apenas o rostro e parte do lábio inferior são visíveis acima da superfície da água à medida que rompe a superfície e, frequentemente, o topo das pregas ventrais estendidas. Golpes oblíquos são executados em um ângulo maior (cerca de 45 °) e expõem inteiramente as pregas ventrais estendidas; às vezes, todo o corpo sai da água em uma brecha baixa, como um golfinho. Durante uma estocada lateral, a baleia quebra a superfície de lado, enquanto durante estocadas verticais e ventrais a baleia sai da água em um ângulo de 90 ° e enquanto está de costas, respectivamente.[115]
As manobras de aprisionamento / envolvimento incluem arcos horizontais, laterais e ventrais. Durante um arco horizontal, uma baleia vira bruscamente - para os dois lados - com apenas uma barbatana peitoral ou, ocasionalmente, uma ponta das asas rompendo a superfície da água. Os arcos laterais e ventrais são semelhantes aos pulmonares laterais e ventrais, mas sem nenhuma parte da baleia rompendo a superfície da água. Todas as três manobras foram observadas com pregas ventrais expandidas e não expandidas. Os mergulhos foram usados com mais frequência (22% do tempo), seguidos pelos ventrais (19%), laterais (17%) e oblíquos (15%). Invasões verticais foram raramente utilizadas (apenas 5% do tempo), assim como arcos horizontais (7%), ventrais (6%) e laterais (3%).[115]
Novas técnicas de alimentação foram observadas durante um estudo de cinco baleias individualmente identificadas (chamadas de M1 a M5) no Parque Nacional do fiorde de Saguenay, no lado norte do golfo de São Lourenço, de junho a outubro de 2003. Essas manobras incluíram tapas na cabeça, golpes para cima e expirações no mergulho. Durante um tapa na cabeça, a baleia levantava a cabeça para fora da água em um ângulo de cerca de 30 a 45 °, respirava rapidamente e batia a cabeça na água, criando um alto respingo. Faria isso sem expandir suas pregas ventrais ou forçar a água para fora da boca. Depois de dar vários tapas na cabeça, a baleia dava uma estocada para se alimentar. Os tapas na cabeça foram usados quase exclusivamente por M4 e M5. Um golpe para cima é semelhante a uma emersão normal, mas é mais enérgico e executado em um ângulo maior quando a baleia sai alto da água para respirar e mergulhar novamente em um movimento contínuo sem bater na superfície da água. Golpes para cima foram utilizados com frequência e executados por todas as cinco baleias; foi a principal técnica usada por M1, M2 e M3 antes de uma investida. Uma exalação no mergulho é exatamente o que seu nome indica: uma baleia exalando enquanto seus espiráculos submergem. Isso resultou em um grande volume de água sendo deslocado e normalmente seguido de um golpe normal ou um golpe de queixo para cima e, ocasionalmente, um tapa na cabeça. Esta técnica só foi executada por M1 e M5. Acredita-se que essas novas técnicas tenham sido desenvolvidas por essas baleias para ajudá-las a agrupar pequenos peixes de cardume (provavelmente capelim) nas águas bem misturadas do fiorde; essas táticas não foram observadas no vizinho canal Laurentiano, onde "fortes correntes de maré, uma coluna de água estratificada e topografia de fundo se combinam para criar grandes áreas de ressurgência nas quais as presas são forçadas a emergir".[117]
Em julho de 2007, uma baleia com o que parecia ser um ferimento provocado por corda foi observada alimentando-se de capelim na superfície do Golfo de São Lourenço. A laceração longa e linear se estendia ao redor das pregas ventrais, restringindo sua distensão. Esse indivíduo executou uma série de estocadas oblíquas do lado direito e, em seguida, girou no ar para a esquerda, pousando ereto sobre o rostro. Isso não foi observado em nenhuma das outras baleias que se alimentam. Isso pode ter sido feito para evitar pousar na parte lesada de suas pregas ventrais.[118]
Acústica[editar | editar código-fonte]
As baleias-anãs produzem vocalizações que incluem pulsos de baixa frequência, estalos e cliques ultrassónicos. De um modo geral, os chamamentos destas baleias consistem numa rápida sequência (aproximadamente um minuto) de impulsos de frequência curta (intervalo de 30 a 450 Hz), com a duração de 100 a 200 ms cada um.[119]

Caça[editar | editar código-fonte]
A exploração como recurso vivo marinho deu-se principalmente no Atlântico Norte por volta dos anos 1940. Os registos de capturas totais da Baleia Anã como recurso pesqueiro apontam para valores de 140 mil espécimes capturados. Os noruegueses são o povo de eleição no que toca à caça deste recurso na zona Este do Atlântico, uma vez que os dados apresentam valores que rondam os 120 mil indivíduos desde o ano 1948. A tendência destes valores tem vindo a diminuir desde os 50 até aos anos 80, em que os mesmos variaram desde 4 mil capturas por ano às 2 mil capturas por ano, respectivamente. Ocorreu também uma época em que não se capturaram estes mamíferos desde 1984 a 1987. A caça foi retomada em 1993 para níveis mais baixos até aos dias de hoje. No ano de 2006, a quota estipulada sugeria a caça de 1052 indivíduos, ainda que realmente caçados foram 521.[120]
Acções conservacionistas[editar | editar código-fonte]
A implementação de quotas pesqueiras que proíbem a caça de baleias é, sem dúvida, uma acção conservacionista importante no que diz respeito à gestão da população de baleias-anãs. No entanto, esta medida não se aplica a países como a Noruega, Islândia e Rússia, que continuam a caçar activamente. Também a autorização de caça para fins científicos, como é o caso polémico do Japão e a permissão da mesma do povo indígena da Gronelândia que caça para fins autossustentáveis têm vindo a causar alguma discussão. Existem dois apêndices na regulamentação do comércio desta caça que são declarados pela Convenção sobre o Comércio Internacional das Espécies da Fauna e da Flora Silvestres Ameaçadas de Extinção. Estes apêndices dividem-se em dois, sendo que o primeiro engloba todas as espécies em perigo de extinção autorizando-se o comércio apenas em situações excepcionais; enquanto que no segundo englobam-se as espécies que não estão necessariamente em perigo de extinção em que se obriga a que o seu comércio deva ser controlado. B. acutorostrata está incluída no Apêndice I, com a excepção da população da Gronelândia que está incluída no Apêndice II. Existe um movimento recente que explora estes misticetos com o objectivo de accionar a sensibilização desta espécie: a observação de cetáceos. Um caso caricato é o da Islândia em que a caça) decorre ao mesmo tempo que a observação das baleias, ocorrendo um determinado tipo de turismo que se interessa pelo consumo da carne caçada. No entanto, existem organizações nestes locais cujo objectivo é terminar com o consumo da carne de baleia como fonte de atracção turística. Um bom exemplo disso é a IFAW (International Fund for Animal Welfare), que trabalha em conjunto com as empresas de observação de baleias, cujo lema de autopromoção é Meet us don’t eat us ("Conhece-nos, não nos comas") como medida de conservação destes animais.[121] Recorre-se hoje em dia também a uma forma de educação do público de observação de baleias através de acções de foto identificação, em que são atribuídos nomes aos indivíduos que se presenciam com frequência na área de observação de modo a sensibilizar o turista com os animais que permanecem nas diferentes áreas com os que vão desaparecendo por motivos variados que incluem a migração para outras localidades ou porque foram alvos de caça.[122]
Galeria[editar | editar código-fonte]
-
Globo ocular de baleia Balaenoptera acutorostrata. Em exposição no MAV/USP.
Referências
- ↑ a b c d e Cooke, J. G. (2018). «Common Minke Whale - Balaenoptera acutorostrata». Lista Vermelha da IUCN. União Internacional para Conservação da Natureza (UICN). p. e.T2474A50348265. doi:10.2305/IUCN.UK.2018-2.RLTS.T2474A50348265.en. Consultado em 30 de agosto de 2021
- ↑ Mead, J.G.; Brownell, R. L. Jr. (2005). «Balaenoptera acutorostrata». In: Wilson, D. E.; Reeder, D.M. Mammal Species of the World: A Taxonomic and Geographic Reference 3.ª ed. Baltimore, Marilândia: Imprensa da Universidade Johns Hopkins. p. 723–743. ISBN 978-0-8018-8221-0. OCLC 62265494
- ↑ Bannister, J. L. (2002). Baleen whales (Mysticetes). Encyclopaedia of Marine Mammals, 2002. Academic Press, pp. 1189-1192.
- ↑ Reeves, R. R., Stewart, B. S., Clapham, P. J., Powell, J. A. (2002). Sea Mammals of the World - A Complete Guide to Whales, Dolphins, Seals, Sea Lions and Sea Cows. A&C Black Publishers Ltd, London.
- ↑ a b Ferreira, A. B. H. (1986). Novo Dicionário da Língua Portuguesa 2.ª ed. Rio de Janeiro: Nova Fronteira. p. 224
- ↑ Ferreira, A. B. H. (1986). Novo Dicionário da Língua Portuguesa 2.ª ed. Rio de Janeiro: Nova Fronteira. p. 1413
- ↑ Bull, H. J. (1896). The cruise of the 'Antarctic' to the South Polar regions. Londres: Edward Arnold
- ↑ a b c Allen, G. M. (1916). The whalebone whales of New England. Boston: Sociedade de História Natural
- ↑ Ellis, Richard (1980). The Book of Whales. Nova Iorque: Alfred Knopf
- ↑ a b Scammon, Charles (1968) [1874]. The Marine Mammals of the North-western Coast of North America: Together with an Account of the American Whale-fishery. Nova Iorque: Dover. ISBN 978-0-486-21976-9
- ↑ a b Omura, H.; Sakiura, H. (1956). «Studies on the little piked whale from the coast of Japan». Sci. Rep. Whales Res. Inst. 11: 1-37
- ↑ Boertman, David (2007). Greenland red list (PDF). Nuque: Governo da Groenlândia e Universidade Aarhus. p. 60. ISBN 978-87-990586-2-4
- ↑ True, F. W. (1904). The whalebone whales of the western North Atlantic: Compared with those occurring in European waters. Washington: Instituto Smithsonian
- ↑ a b Van Waerebeek, K.; Andre, M.; Sequeira, M.; Martin, V.; Robineau, D.; Collet, A.; Papastavrou, V.; Ndiyaye, E. (1999). «Spatial and temporal distribution of the minke whale, Balaenoptera acutorostrata (Lacepede, 1804), in the southern northeast Atlantic Ocean and the Mediterranean Sea, with reference to stock identity». Journal of Cetacean Research and Management. 1 (3): 223–238
- ↑ a b c d e f Best, P (1985). «External characters of southern minke whales and the existence of a diminutive form». Scientific Reports of the Whales Research Institute. 36: 1–33
- ↑ a b c d e Arnold, P.; Marsh, H.; Heinsohn, G. (1987). «The occurrence of two forms of minke whales in east Australian waters with a description of external characters and skeleton of the diminutive or dwarf form». Scientific Reports of the Whales Research Institute. 38: 1–46
- ↑ Árnason, Ú.; Gullberg, A.; Widegren, B. (1993). «Cetacean mitochondrial DNA control region: sequences of all extant baleen whales and two sperm whale species». Molecular Biology and Evolution. 10 (5): 960–970. PMID 8412655. doi:10.1093/oxfordjournals.molbev.a040061
- ↑ Pastene, L. A.; Goto, M.; Kanda, N.; Zerbini, A. N.; Kerem, D. A. N.; Watanabe, K.; Bessho, Y.; Hasegawa, M; Nielsen, R.; Larsen, F.; Palsböll, P. J. (2007). «Radiation and speciation of pelagic organisms during periods of global warming: the case of the common minke whale, Balaenoptera acutorostrata». Molecular Ecology. 16 (7): 1481–1495. PMID 17391271. doi:10.1111/j.1365-294x.2007.03244.x
- ↑ Glover, K. A.; Kanda, N.; Haug, T.; Pastene, L. A.; Øien, N.; Goto, M.; Seliussen, B. B.; Skaug, H. J. (2010). «Migration of Antarctic minke whales to the Arctic». PLOS ONE. 5 (12): 1–6. Bibcode:2010PLoSO...515197G. PMC 3008685
 . PMID 21203557. doi:10.1371/journal.pone.0015197
. PMID 21203557. doi:10.1371/journal.pone.0015197
- ↑ Glover, K. A.; Kanda, N.; Haug, T.; Pastene, L. A.; Øien, N.; Seliussen, B. B.; Sørvik, A. G. E.; Skaug, H. J. (2013). «Hybrids between common and Antarctic minke whales are fertile and can back-cross». BMC Genetics. 14 (1): 1–11. PMC 3637290
 . PMID 23586609. doi:10.1186/1471-2156-14-25
. PMID 23586609. doi:10.1186/1471-2156-14-25
- ↑ a b Øien, N (1988). «Length distribution in catches from the northeastern Atlantic stock of minke whales». Report of the International Whaling Commission. 39: 289–296
- ↑ Ivashin, M. (1992). «USSR catch and sightings data». Report of the Scientific Committee on North Pacific minke whales (Appendix 7). Impington: Comitê Científico da Comissão Baleeira Internacional. p. 168
- ↑ a b c d Hauksson, E.; Víkingsson, G. A.; Halldorsson, S. D.; Olafsdottir, D.; Sigurjónsson, J. (2011). «Preliminary report on biological parameters for NA minke whales in Icelandic waters». Report of the International Whaling Commission. 63: 1–45
- ↑ a b c Kato, H (1992). «Body length, reproduction and stock separation of minke whales off Northern Japan». Report of the International Whaling Commission. 43: 443–456
- ↑ Kishiro, T.; Kato, H.; Ohizumi, H.; Yoshida, H.; Saito, T.; Isoda, T.; Tabata, S.; Sakakibara, M.; Saino, S.; Hara, T.; Hayashi, T.; Miyashita, T.; Fukudome, K.; Kiwada, H.; Kawahara, S. (2003). «Report of the 2002 JARPN II survey in the western North Pacific. Part II: Coastal component – Coastal survey off Kushiro, northeast Japan». Paper SC/55/O8 submitted to the 55th IWC Scientific Committee: 26
- ↑ Yoshida, H.; Kato, H.; Kishiro, T.; Iwasaki, T.; Miyashita, T.; Ryono, T.; Tabata, S.; Sakakibara, M.; Saino, S.; Hara, T.; Hayashi, T.; Tomizawa, Y.; Tamai, K.; Okamoto, R.; Fukuoka, M.; Watanabe, H.; Tsunekawa, M.; Kawahara, S. (2004). «Report of the coastal survey on common minke whales off Sanriku coast, northeast Japan: the Japanese whale research program under special permit in the western North Pacific–Phase II (JARPN II) in 2003 (Part II) – Coastal component». Paper SC/56/O14 submitted to the 56th IWC Scientific Committee: 31
- ↑ Kishiro, T.; Kato, H.; Yoshida, H.; Miyashita, T.; Ryono, T.; Tabata, S.; Kawahara, S. (2005). «Cruise report of the coastal survey on common minke whales off Kushiro, northeast Japan: the 2004 JARPN II survey (Part II) – Coastal component». Paper SC/57/O4 submitted to the 57th IWC Scientific Committee: 37
- ↑ Yoshida, H.; Kato, H.; Kishiro, T.; Iwasaki, T.; Miyashita, T.; Saito, T.; Shigeo, T.; Morita, Y.; Sato, H.; Okada, A.; Tomizawa, Y.; Saino, S.; Kuroishi, H.; Ebisui, T.; Nakai, K.; Nishiwaki, S.; Kawahara, S. (2006). «Cruise report of the second phase of the Japanese Whale Research Program under Special Permit in the western North Pacific (JARPN II) in 2005 – Coastal component off Sanriku». Paper SC/58/09 Submitted to the 58th IWC Scientific Committee: 30
- ↑ Kishiro, T.; Kato, H.; Yoshida, H.; Miyashita, T.; Ryono, T.; Tabata, S.; Kawahara, S. (2006). «Cruise report of the Second phase of the Japanese Whale Research Program under Special Permit in the western North Pacific (JARPN II) in 2005 – Coastal component off Kushiro». Paper SC/58/O10 submitted to the 58th IWC Scientific Committee: 32
- ↑ Goto, M.; Kato, H.; Zenitani, R.; Yoshida, H.; Saito, T.; Tabata, S.; Kawahara, S. (2007). «Cruise report of the second phase of the Japanese Whale Research Program under Special Permit in the Western North Pacific (JARPN II) in 2006 – Coastal component off Sanriku». Paper SC/59/O6 submitted to the 59th IWC scientific Committee: 34
- ↑ Yoshida, H.; Kato, H.; Kishiro, T.; Miyashita, T.; Iwasaki, T.; Minamikawa, S.; Kawahara, S. (2007). «Cruise report of the second phase of the Japanese Whale Research Program under Special Permit in the Western North Pacific (JARPN II) in 2006 – Coastal component off Kushiro». Paper SC/59/O7 submitted to the 59th IWC Scientific Committee: 43
- ↑ Bando, T.; Kato, H.; Kishiro, T.; Goto, M.; Saito, T.; Tabata, S.; Kawahara, S. (2008). «Cruise report of the second phase of the Japanese Whale Research Program under Special Permit in the Western North Pacific (JARPN II) in 2007 – Coastal component off Sanriku». Paper SC/60/O6 submitted to the 60th IWC scientific Committee: 27
- ↑ Kishiro, T.; Kato, H.; Yoshida, H.; Miyashita, T.; Iwasaki, T.; Kanaji, Y.; Kawahara, S. (2008). «Cruise report of the Second phase of the Japanese Whale Research Program under Special Permit in the western North Pacific (JARPN II) in 2007 – Coastal component off Kushiro». Paper SC/60/O7 submitted to the 60th IWC Scientific Committee: 33
- ↑ a b c d Christensen, I (1981). «Age determination of minke whales, Balaenoptera acutorostrata, from laminated structures in the tympanic bulla». Report of the International Whaling Commission. 31: 245–253
- ↑ a b Zerbini, A. N.; Secchi, E. R.; Siciliano, S.; Simoes-Lopes, P. C. (1996). «The dwarf form of the minke whale, Balaenoptera acutorostrata Lacepede, 1804, in Brazil». Reports of the International Whaling Commission. 46: 333–340
- ↑ Reeves, R. R.; Stewart, B. S.; Clapham, P. J.; Powell, J. A. (2005). National Audubon Society Guide to Marine Mammals of the World. Nova Iorque: Alfred A. Knopf
- ↑ Farinha, N.; Correia, F. (2003). Cetáceos dos Açores : baleias, golfinhos e toninhas. Mirandela: João Azevedo. p. 180
- ↑ Kato, H.; Kishiro, T.; Fujise, T.; Wada, S. (1992). «Morphology of minke whales in the Okhotsk Sea, Sea of Japan and off the East Coast of Japan, with respect to stock identification». Report of the International Whaling Commission. 43: 437–442
- ↑ Hauksson, E.; Christensen, I.; Víkingsson, G. A.; Halldorsson, S. D. (2013). «Morphometric comparison of common minke whales Balaenoptera acutorostrata from different areas of the North Atlantic, including animals from Icelandic waters». Reports of the International Whaling Commission. 65: 1–21
- ↑ a b c d e f g h Dorsey, E. M.; Stern, S. J.; Hoelzel, A. R.; Jacobsen, J. (1990). «Minke whales (Balaenoptera acutorostrata) from the west coast of North America: individual recognition and small-scale site fidelity». Reports of the International Whaling Commission. 12: 357-368
- ↑ a b Acevedo, J.; Aguayo-Lobo, A.; Acuna, P.; Pastene, L. A. (2006). «A note on the first record of the dwarf minke whale (Balaenoptera acutorostrata) in Chilean waters». Journal of Cetacean Research and Management. 8 (3): 293–296
- ↑ a b c Dawson, S. M.; Slooten, E. (1990). «Stranding of a dwarf minke whale at Banks Peninsula, New Zealand». New Zealand Natural Science. 17: 89–93
- ↑ a b c d Arnold, P. W.; Birtles, R. A.; Dunstan, A.; Lukoschek, V.; Matthews, M. (2005). «Colour patterns of the dwarf minke whale Balaenoptera acutorostrata sensu lato: description, cladistic analysis and taxonomic implications». Memoirs of the Queensland Museum. 51: 277–307
- ↑ Abraham, K. F.; Lim, B. K. (1990). «First minke whale, Balaenoptera acutorostrata, record for James Bay». Canadian Field-Naturalist. 104: 304–305
- ↑ Pattie, D. L.; Webber, M. (1992). «First record of a minke whale, Balaenoptera acutorostrata, in Manitoba waters». Canadian Field-Naturalist. 106: 266–267
- ↑ Higdon, J. W.; Ferguson, S. H. (2011). «Reports of humpback and minke whales in the Hudson Bay region, eastern Canadian Arctic». Northeastern Naturalist. 18 (3): 370–377. doi:10.1656/045.018.0309
- ↑ Freitas, L.; Dinis, A.; Alves, F. (2006). «Occurrence and distribution of cetaceans off Maderia archipelago (Portugal)». Twentieth annual conference of the European Cetacean Society
- ↑ «The Status of Cetaceans in the Black Sea and Mediterranean Sea» (PDF)
- ↑ «Current knowledge of the cetacean fauna of the Greek Seas» (PDF). 2003: 219–232. Consultado em 21 de abril de 2016
- ↑ Mitchell, E. D. (1991). «Winter records of the minke whale (Balaenoptera acutorostrata Lacepede 1804) in the southern North Atlantic». Reports of the International Whaling Commission. 41: 455–457
- ↑ Folkow, L. P.; Blix, A. S. (1991). «Norwegian whale sightings and acoustic surveys in the Atlantic Ocean during the winter of 1989/90». Reports of the International Whaling Commission. 41: 531–538
- ↑ Rankin, S.; Norris, T. F.; Smultea, M. A.; Oedekoven, C.; Zoidis, A. M.; Silva, E.; Rivers, J. (2007). «A visual sighting and acoustic detections of minke whales, Balaenoptera acutorostrata (Cetacea: Balaenopteridae), in nearshore Hawaiian waters». Pacific Science. 61 (3): 395–398. doi:10.2984/1534-6188(2007)61[395:avsaad]2.0.co;2. hdl:10125/22623
- ↑ Norris, T.; Martin, S.; Thomas, L.; Yack, T.; Oswald, J. N.; Nosal, E. M.; Janik, V. (2012). «Acoustic ecology and behavior of minke whales in the Hawaiian and Marianas Islands: localization, abundance estimation, and characterization of minke whale 'boings». The Effects of Noise on Aquatic Life. Nova Iorque: Springer. pp. 149–153
- ↑ Ivashin, M. V.; Votrogov, L. M. (1981). «Minke whales, Balaenoptera acutorostrata davidsoni, inhabiting inshore waters of the Chukotka coast». Reports of the International Whaling Commission. 31: 231
- ↑ Norman, S. A.; Bowlby, C. E.; Brancato, M. S.; Calambokidis, J.; Duffield, D.; Gearin, P. J.; Scordino, J. (2004). «Cetacean strandings in Oregon and Washington between 1930 and 2002». Journal of Cetacean Research and Management. 6 (1): 87–100
- ↑ Leatherwood, S.; Stewart, B. S.; Folkens, P. A. (1987). «Cetaceans of the Channel Islands National Marine Sanctuary». National Marine Sanctuary Program
- ↑ Tershy, B. R.; Breese, D.; Strong, C. S. (1990). «Abundance, seasonal distribution and population composition of balaenopterid whales in the Canal de Ballenas, Gulf of California, Mexico». Reports of the International Whaling Commission. 12: 369-375
- ↑ Rankin, S.; Barlow, J. (2005). «Source of the North Pacific "boing" sound attributed to minke whales"». Journal of the Acoustical Society of America. 118 (5): 3346–3351. Bibcode:2005ASAJ..118.3346R. PMID 16334704. doi:10.1121/1.2046747
- ↑ Magalhaes, F. A.; Severo, M. M.; Tosi, C. H.; Garri, R. G.; Zerbini, A. N.; Chellappa, S.; Silva, F. J. L. (2007). «Record of a dwarf minke whale (Balaenoptera acutorostrata) in northern Brazil». JMBA2 – Biodiversity Records: 2
- ↑ Zerbini, A. N.; Secchi, E. R.; Siciliano, S.; Simões-Lopes, P. C. (1997). «A review of the occurrence and distribution of whales of the genus Balaenoptera along the Brazilian coast». Reports of the International Whaling Commission. 47: 407–417
- ↑ a b Arnold, P. W. (1997). «Occurrence of dwarf minke whales (Balaenoptera acutorostrata) on the northern Great Barrier Reef, Australia». Reports of the International Whaling Commission. 47: 419–24
- ↑ Acevedo, J.; Olavarría, C.; Plana, J.; Aguayo-Lobo, A.; Larrea, A.; Pastene, L. A. (2011). «Occurrence of dwarf minke whales (Balaenoptera acutorostrata subsp.) around the Antarctic Peninsula». Polar Biology. 34 (2): 313–318. doi:10.1007/s00300-010-0884-y
- ↑ Skaug, H. J.; Øien, N.; Schweder, T.; Bøthun, G. (2004). «Abundance of minke whales (Balaenoptera acutorostrata) in the Northeast Atlantic: variability in time and space». Canadian Journal of Fisheries and Aquatic Sciences. 61 (6): 870–886. CiteSeerX 10.1.1.172.1639
 . doi:10.1139/f04-020
. doi:10.1139/f04-020
- ↑ Heide-Jørgensen, M. P.; Simon, M. J.; Laidre, K. L. (2007). «Estimates of large whale abundance in Greenlandic waters from a ship-based survey in 2005». J. Cetacean Res. Manage. 9 (2): 95–104
- ↑ a b Heide-Jørgensen, M. P.; Borchers, D. L.; Witting, L.; Laidre, K. L.; Simon, M. J.; Rosing-Asvid, A.; Pike, D. G. (2008). «Estimates of large whale abundance in West Greenland waters from an aerial survey in 2005». J. Cetacean Res. Manage. 10 (2): 119–129
- ↑ a b Kingsley, M. C. S.; Reeves, R. R. (1998). «Aerial surveys of cetaceans in the Gulf of St. Lawrence in 1995 and 1996». Canadian Journal of Zoology. 76 (8): 1529–1550. doi:10.1139/z98-054
- ↑ a b Buckland, S. T.; Cattanach, K. L.; Miyashita, T. (1992). «Minke whale abundance in the northwest Pacific and Okhotsk Sea, estimated from 1989 and 1990 sighting surveys». Reports of the International Whaling Commission. 42: 387–392
- ↑ Moore, S. E.; Waite, J. M.; Mazzuca, L. L.; Hobbs, R. C. (2000). «Mysticete whale abundance and observations on prey association on the central Bering Sea shelf». J. Cetacean Res. Manage. 2 (3): 227–234
- ↑ Zerbini, A. N.; Waite, J. M.; Laake, J. L.; Wade, P. R. (2006). «Abundance, trends and distribution of baleen whales off Western Alaska and the central Aleutian Islands». Deep-Sea Research. 53 (11): 1772–1790. Bibcode:2006DSRI...53.1772Z. doi:10.1016/j.dsr.2006.08.009
- ↑ Williams, R.; Thomas, L. (2007). «Distribution and abundance of marine mammals in the coastal waters of British Columbia, Canada». J. Cetacean Res. Manage. 9 (1): 15–28
- ↑ a b c Gill, A.; Fairbairns, B.; Fairbairns, R. (2000). «Photo-identification of the minke whale (Balaenoptera acutorostrata) around the Isle of Mull, Scotland». Report to the Hebridean Whale and Dolphin Trust
- ↑ Baumgartner, N. (2008). Distribution, diving behaviour and identification of the North Atlantic minke whale in northeast Scotland. Aberdeen, Escócia: Universidade de Aberdeen
- ↑ Bertulli, C. G.; Rasmussen, M. H.; Tetley, M. J. (2013). «Photo-identification rate and wide-scale movement of common minke whales (Balaenoptera acutorostrata) in the coastal waters of Faxaflói and Skjálfandi Bays, Iceland». Journal of Cetacean Research and Management. 13 (1): 39–46
- ↑ Tscherter, U.; Morris, C. (2005). «Identifying a majority of minke whales (Balaenoptera acutorostrata) in the St. Lawrence based on the presence of dorsal fin edge marks». In: Evans, P. G. H.; V. Ridoux. European research on cetaceans. Proceedings of the 15th Annual Conference of the European Cetacean Society. 159. La Rochelle: Sociedade Europeia de Cetáceos
- ↑ Morris, C. and Tscherter, U. (2006). "Site fidelity of individual minke whales (Balaenoptera acutorostrata) in the St. Lawrence estuary". Poster presented at the 20th Annual Conference of the European Cetacean Society in Gdynia (abstract only).
- ↑ Bartha, G. B.; Gowans, S.; Simard, P.; Tetley, M.; Keith, E. O. (2011). «Population size and site fidelity of North Atlantic minke whales (Balaenoptera acutorostrata acutorostrata) off the Atlantic coast of Nova Scotia, Canada». Aquatic Mammals. 37 (4): 454-463
- ↑ Víkingsson, G. A.; Heide-Jørgensen, M. P. (2013). «Migration and local movements of common minke whales tracked by satellite in the North Atlantic during 2001-2010». Reports of the International Whaling Commission's Icelandic Special Meeting: 1-12
- ↑ a b Towers, J. R.; McMillan, C.J.; Malleson, M.; Hildering, J.; Ford, J.K.B.; Ellis, G. M. (2013). «Seasonal movements and ecological markers as evidence for migration of common minke whales photo-identified in the eastern North Pacific». J. Cetacean Res. Manage. 13 (3): 221–229
- ↑ Darby, Andrew (30 de novembro de 2013). «Minke route pits whale hunt against tourism». The Sydney Morning Herald. Consultado em 13 de junho de 2014
- ↑ a b Olsen, E.; Sunde, J. (2002). «Age determination of minke whales (Balaenoptera acutorostrata) using the aspartic acid racemization technique». Sarsia: North Atlantic Marine Science. 87 (1): 1–8. doi:10.1080/003648202753631686
- ↑ Skaug, H. J.; Bérubé, M.; Rew, M. B.; Palsbøll, P. J. (2007). «Genetic analyses reveal promiscuous mating in female minke whales, Balaenoptera acutorostrata». Journal of Cetacean Research and Management. 9 (3): 249–251
- ↑ Evans, Peter G. H. (1987). The Natural History of Whales and Dolphins. Nova Iorque: Facts on File
- ↑ a b Windsland, K.; Lindstrom, U.; Nilssen, K. T.; Haug, T. (2007). «Relative abundance and size composition of prey in the common minke whale diet in selected areas of the northeastern Atlantic during 2000–04». Journal of Cetacean Research and Management. 9: 167–178
- ↑ a b Jonsgård, A (1982). «The food of minke whales (Balaenoptera acutorostrata) in northern North Atlantic waters». Report of the International Whaling Commission. 32: 259–262
- ↑ Víkingsson, G.; Elvarsson, B.; Chosson, V.; Olafsdottir, D. (2013). «Recent changes in the diet composition of common minke whales (Balaenoptera acutorostrata) in Icelandic waters – Consequence of climate change?». Reports of the International Whaling Commission. 65: 1–31
- ↑ Mitchell, E (1974). «Preliminary report on Newfoundland fishery for minke whales». Reports of the International Whaling Commission. 24: 159–176
- ↑ Kasamatsu, F.; Hata, T. (1985). «Notes on minke whales in the Okhotsk Sea-West Pacific area». Reports of the International Whaling Commission. 36: 299–304
- ↑ Tamura, T.; Konishi, K.; Isoda, T.; Okamoto, P. (2009). «Prey consumption and feeding habits of common minke, sei and Bryde's whales in the western North Pacific». NAMMCO/SC/16/MMFI/07
- ↑ Perrin, W. F.; Würsig, Bernd G.; Thewissen, J. G. M. (2009). Encyclopedia of Marine Mammals. Amesterdã: Elsevier/Academic Press
- ↑ Kasamatsu, F.; Yamamoto, Y.; Zenitani, R.; Ishikawa, H.; Ishibashi, T.; Sato, H.; Takashima, K.; Tanifuji, S. (1993). «Report of the 1990/91 southern minke whale research cruise under scientific permit in Area V». Reports of the International Whaling Commission. 43: 505–522
- ↑ Kato, H.; Hiroyama, H.; Fujise, Y.; Ono, K. (1989). «Preliminary report of the 1987/88 Japanese feasibility study of the special permit proposal for Southern Hemisphere minke whales». Reports of the International Whaling Commission. 39: 235–248
- ↑ a b Secchi, E. R.; Barcellos, L.; Zerbini, A. N.; Dalla Rosa, L. (2003). «Biological observation on a dwarf minke whale (Balaenoptera acutorostrata), caught in southern Brazilian waters, with a new record of prey for the species». Latin American Journal of Aquatic Mammals. 2 (2): 109–115. doi:10.5597/lajam00039
- ↑ Jefferson, T. A.; Stacey, P.J.; Baird, R.W. (1991). «A review of killer whale interactions with other marine mammals: predation to co-existence» (PDF). Mammal Review. 21 (4): 151–180. doi:10.1111/j.1365-2907.1991.tb00291.x
- ↑ Ford, J. K.; Reeves, R. R. (2008). «Fight or flight: antipredator strategies of baleen whales». Mammal Review. 38 (1): 50–86. CiteSeerX 10.1.1.573.6671
 . doi:10.1111/j.1365-2907.2008.00118.x
. doi:10.1111/j.1365-2907.2008.00118.x
- ↑ Rice, D. W. (1968). «Stomach contents and feeding behavior of killer whales in the eastern North Pacific». Norsk Hvalfangsttid. 57: 35–38
- ↑ Ford, J. K.; Ellis, G. M.; Matkin, D. R.; Balcomb, K. C.; Briggs, D.; Morton, A. B. (2005). «Killer whale attacks on minke whales: prey capture and antipredator tactics». Marine Mammal Science. 21 (4): 603–618. doi:10.1111/j.1748-7692.2005.tb01254.x
- ↑ Leclerc, L. M.; Lydersen, C.; Haug, T.; Glover, K. A.; Fisk, A. T.; Kovacs, K. M. (2011). «Greenland sharks (Somniosus microcephalus) scavenge offal from minke (Balaenoptera acutorostrata) whaling operations in Svalbard (Norway)». Polar Research. 30 (1): 1–4. doi:10.3402/polar.v30i0.7342
- ↑ Thomas, Pete (30 de setembro de 2013). «Great white sharks, blue sharks spotted feasting on minke whale carcass off Ventura». Pete Thomas Outdoors. Consultado em 10 de junho de 2016
- ↑ Glover, A. G; Kallstrom, B.; Smith, C. R; Dahlgren, T. G (2005). «World-wide whale worms? A new species of Osedax from the shallow north Atlantic». Proceedings of the Royal Society B: Biological Sciences. 272 (1581): 2587–2592. PMC 1559975
 . PMID 16321780. doi:10.1098/rspb.2005.3275
. PMID 16321780. doi:10.1098/rspb.2005.3275
- ↑ Ólafsdóttir, D.; Shinn, A. P. (2013). «Epibiotic macrofauna on common minke whales, Balaenoptera acutorostrata Lacépède, 1804, in Icelandic waters». Parasites & Vectors. 6 (1): 105. PMC 3673810
 . PMID 23594428. doi:10.1186/1756-3305-6-105
. PMID 23594428. doi:10.1186/1756-3305-6-105
- ↑ Nichols, O. C.; Tscherter, U. T. (2010). «Feeding of sea lampreys Petromyzon marinus on minke whales Balaenoptera acutorostrata in the St. Lawrence Estuary, Canada». Journal of Fish Biology. 78 (1): 338–343. PMID 21235565. doi:10.1111/j.1095-8649.2010.02842.x
- ↑ Araki, J.; Kuramochi, T.; Machida, M.; Nagazawa, K.; Uchida, A. (1997). «A note on the parasite fauna of the western North Pacific minke whale (Balaenoptera acutorostrata)». Report of the International Whaling Commission. 47: 565–568
- ↑ a b Murphy, M. A. (1995). «Occurrence and group characteristics of minke whales, Balaenoptera acutorostrata, in Massachusetts Bay and Cape Cod Bay». Fishery Bulletin. 93: 577–585
- ↑ Sigurjónsson, J.; Gunnlaugsson, Th.; Ensor, P.; Newcomer, M.; Víkingsson, G. (1991). «North Atlantic sightings survey 1989 (NASS-89) shipboard surveys in Icelandic and adjacent waters July–August 1989». Reports of the International Whaling Commission. 41: 559–572
- ↑ Hassel, L. B.; Venturotti, A.; Magalhães, F. A.; Cuenca, S.; Siciliano, S.; Marques, F. F. (2003). «Summer sightings of dwarf minke whales (Balaenoptera acutorostrata) off the eastern coast of Rio de Janeiro State, Brazil». Latin American Journal of Aquatic Mammals. 2 (1): 47–50. doi:10.5597/lajam00030
- ↑ Larsen, F.; Kapel, F. O. (1981). «Collection of biological material of minke whales off West Greenland, 1979». Reports of the International Whaling Commission. 31: 279–285
- ↑ Larsen, F.; Kapel, F. O. (1982). «Norwegian minke whaling off West Greenland, 1976–80 and biological studies of West Greenland minke whales». Reports of the International Whaling Commission. 32: 263–274
- ↑ Larsen, F.; Kapel, F. O. (1983). «Further biological studies of the West Greenland minke whale». Reports of the International Whaling Commission. 33: 329–332
- ↑ Larsen, F.; Øien, N. (1988). «On the discreteness of stocks of minke whales at East and West Greenland». Reports of the International Whaling Commission. 39: 251–255
- ↑ Laidre, K. L.; Heagerty, P. J.; Heide-Jørgensen, M. P.; Witting, L.; Simon, M. (2009). «Sexual segregation of common minke whales (Balaenoptera acutorostrata) in Greenland, and the influence of sea temperature on the sex ratio of catches». ICES Journal of Marine Science. 66 (10): 2253–2266. doi:10.1093/icesjms/fsp191
- ↑ Hauksson, E.; Víkingsson, G.; Sigurjónsson, J. (2013). «Geographic, temporal and size segregation of sexes of the common minke whale (Balaenoptera acutorostrata) in Icelandic waters based on catch data from 1974 to 2009». Reunião Especial da Comissão Baleeira Internacional da Islândia. SC/F13/SP14: 1-13
- ↑ Jonsgard, A. (1974). «On whale exploitation in the eastern part of the North Atlantic Ocean». In: W.E. Schevill. The Whale Problem: A Status Report. Cambridge, MA: Harvard University Press. pp. 97–107. ISBN 978-0-674-95075-7
- ↑ Ohsumi, S (1983). «Minke whales in the coastal waters of Japan in 1981, with special reference to their stock boundary». Reports of the International Whaling Commission. 33: 365–372
- ↑ Wada, S (1989). «Latitudinal segregation of the Okhotsk Sea-West Pacific stock of minke whales». Reports of the International Whaling Commission. 39: 229–33
- ↑ a b c d Lynas, E. M.; Sylvestre, J. P. (1988). «Feeding techniques and foraging strategies of minke whales (Balaenoptera acutorostrata) in the St. Lawrence River estuary». Aquatic Mammals. 14 (1): 21–32
- ↑ Stern, J. S. (1992). «Surfacing rates and surfacing patterns of minke whales (Balaenoptera acutorostrata) off central California, and the probability of a whale surfacing within visual range». Reports of the International Whaling Commission. 42: 379–385
- ↑ Kuker, K. J.; Thomson, J. A.; Tscherter, U. (2005). «Novel surface feeding tactics of minke whales, Balaenoptera acutorostrata, in the Saguenay-St. Lawrence National Marine Park». The Canadian Field-Naturalist. 119 (2): 214–218. doi:10.22621/cfn.v119i2.109

- ↑ Kot, B. W.; Ramp, C.; Sears, R. (2009). «Decreased feeding ability of a minke whale (Balaenoptera acutorostrata) with entanglement-like injuries». Marine Mammal Science. 25 (3): 706–713. doi:10.1111/j.1748-7692.2009.00285.x
- ↑ National Oceanic and Atmospheric Administration: http://www.noaa.gov
- ↑ Amundsen, E. S., BjØrndal, T., Conrad, J. M.(1995). Open Access harvesting of the Northeast Atlantic Minke Whale. Environmental and Resource Economics. Netherlands. 6: 167-185.
- ↑ International fund for animal welfare: http://www.ifaw.org/us/
- ↑ http://www.faxa-cetacean.org/Minke-Whale/







