コペルニシウム
この項目「コペルニシウム」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:英語版 "Cepernicium" 00:44, 3 Dec. 2022 (UTC)) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2023年1月) |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外見 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 不明 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 一般特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称, 記号, 番号 | コペルニシウム, Cn, 112 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分類 | ポスト遷移金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族, 周期, ブロック | 12, 7, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子量 | [285] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子配置 | [Rn] 5f14 6d10 7s2(推定) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 電子殻 | 2, 8, 18, 32, 32, 18, 2(推定)(画像) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子特性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 酸化数 | 4, 2(推定) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共有結合半径 | 122 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| その他 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS登録番号 | 54084-26-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 主な同位体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 詳細はコペルニシウムの同位体を参照 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
コペルニシウム(Copernicium 英語: [ˌkoʊpərˈnɪsiəm])は、元素記号Cn、原子番号112の合成元素である。既知の同位体は放射性が非常に高く、研究室内でしか作られない。最も安定な同位体はコペルニシウム285で、半減期は約28秒である。1996年にドイツ・ダルムシュタット近郊の重イオン研究所で初めて合成され、天文学者のニコラウス・コペルニクスに因んで命名された。
周期表上では、dブロックの遷移元素であり、第12族元素である。金との反応では、非常に揮発性が高い様子が見られ[2]、そのため、標準状態では気体もしくは揮発性の液体である可能性がある。
同じ第12族元素でより軽い亜鉛、カドミウム、水銀と比べると、いくつかの性質がかなり異なっていると計算されている。コペルニシウムは相対論効果のため7s軌道の電子の代わりに6d軌道の電子を失いやすく、第12族元素よりもラドン等の希ガスにより性質が近いと考えられる。計算により+4の酸化状態を取りうることが示されているが、これは水銀ではその存在が議論されている1つの化合物(フッ化水銀(IV))だけが持つ値であり、亜鉛やカドミウムはこの状態を示さない。また、他の第12族元素と比べ、中性状態からの酸化がより難しいと計算される。コペルニシウムの固体が金属か、半導体か、絶縁体であるかについては予測が一致していない。化学的性質が実験的に調べられている中で、最も重い元素の一つである。
導入[編集]
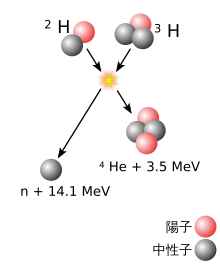
重い[注釈 1]原子核は、2つのサイズが異なる原子核[注釈 2]の核融合反応により形成され、おおまかに、2つの原子核の質量の差が大きいほど、反応の可能性は高くなる[8]。重い方の原子核を持つ物質を標的とし、軽い原子核の粒子線を照射することで、2つの原子核が十分に接近すると、1つの原子核への融合が起こりうる。通常、陽電荷を持つ2つの原子核は、静電的な斥力により互いに反発する。原子核同士が非常に近づくときのみ、強い相互作用がこの反発力に打ち克つ。そのため、粒子線となる原子核の速度を、この反発力が無視できる程度まで、加速器で加速する必要がある。ただし、2つの原子核が融合するためには、2つの原子核が単に近づくだけでは不十分である。2つの原子核が近づいただけでは、通常、1つの原子核に融合するのではなく、およそ10−20秒間だけ一緒に留まった後、離れていく(この時、反応前と同じ構成とは限らない)[9][10]。核融合が起こる場合、複合核と呼ばれる一時的な融合状態は励起状態にある。複合核は核分裂反応を起こすか、1つまたはいくつかの中性子を放出し、それによってエネルギーを放出することで励起エネルギーを失い、より安定な状態に達する[注釈 3]。この反応は、最初の衝突の約10-16秒後に起こる[11][注釈 4]。
粒子線は標的を通り過ぎて、次のチェンバーであるセパレーターに入射する。新しい原子核ができていると、この粒子線により運ばれる[14]。セパレーターでは、生成した原子核は他の原子核(粒子線そのものの原子核やその他の反応生成物)から分離され[注釈 5]、表面障壁型半導体検出器に運ばれる。粒子はそこで停止し、検出器上での正確な衝突位置とそのエネルギー、到達時間が記録される[14]。移送には約10−6秒を必要とし、検出までに原子核はこれだけの時間にわたって生き残る必要がある[17]。その原子核が崩壊すると、崩壊が起きた位置、エネルギー、時間が再度記録される[14]。
原子核の安定性は、強い相互作用によってもたらされる。しかしそれが及ぶ範囲は非常に短く、原子核が大きくなるほど、最外殻の核子(陽子と中性子)が強い相互作用から受ける影響は小さくなっていく。同時に、陽子間の静電反発により原子核は引き裂かれ、これは範囲の制約がない[18]。そのため、重元素の原子核は、このような反発によるアルファ崩壊や自発核分裂[注釈 6]のようなモードが主要な崩壊過程になると理論的に予測されており[20]、これまで実際の観測もそれを裏付けてきた[21]。このような崩壊モードは、超重元素の原子核には支配的なものである。アルファ崩壊は、放出されたアルファ粒子により記録され、崩壊生成物は実際の崩壊前に容易に決定できる。一度の崩壊や連続した崩壊により既知の原子核が生成されると、計算により反応の出発点となる原子核が決定できる[注釈 7]。しかし、自発核分裂では生成物として様々な原子核が生じ、そのため、娘核からは、出発点となる原子核が決定できない[注釈 8]。
重い元素を合成しようとする物理学者が得られる情報は、このように検出器により収集される、粒子が検出器に衝突した位置、エネルギー、時間と、その粒子が崩壊する際の同様の情報となる。物理学者はこのデータを分析し、これが新元素によって引き起こされたものであり、他の核種により引き起こされたものではないと結論付けようとする。しばしば、得られたデータは、新元素の生成を確定するには不十分なものであり、誤った解釈がなされることもある[注釈 9]。
歴史[編集]
発見[編集]
コペルニシウムは、1996年2月9日に、ドイツの重イオン研究所において、シグルド・ホフマン、ヴィクトル・ニノフらによって初めて合成された[31]。粒子加速器により、鉛208原子核を標的として、加速した亜鉛70原子核を衝突させることで、質量数277のコペルニシウム原子が一つだけ合成されたものである(当初、2つめの発見も報告されたが、後にヴィクトル・ニノフにより捏造されたデータに基づいていたことが明らかとなったため、撤回された)[31]。
- 208
82Pb + 70
30Zn → 278
112Cn* → 277
112Cn + 1
0n
2000年5月、重イオン研究所は、277Cn原子を新たに一個合成する追試に成功した[32]。理化学研究所は2004年及び2013年に気体充填型反跳イオン分離器を備えた超重元素分析装置によってこの反応の追試を行い、さらに3つの原子を合成して、重イオン研究所のチームにより報告された崩壊データを確認した[33][34]。またこの反応は、かつて1971年に(中性子2個の放出による)276Cnの合成を目的にロシアのドゥブナ合同原子核研究所でも試みられたが、成功しなかった[35]。
IUPAC/IUPAP共同作業部会は2001年[36]と2003年[37]に重イオン研究所のチームによるコペルニシウム発見について評価を行い、どちらにおいても主張を裏付ける十分な証拠がないと判断した。これは主に、261Rfについての既知の崩壊データと矛盾するためであった。しかし、2001年から2005年の間に、重イオン研究所のチームは、248Cm(26Mg,5n)269Hsの反応を研究し、269Hsと261Rfの崩壊データを確定することができた。261Rfの既存のデータは核異性体のものであったことが明らかとなり[38]、これは現在では、261mRfと名付けられている。
2009年5月、共同作業部会は、112番元素発見の主張について再び報告を出し、重イオン研究所のチームを112番元素の発見者として公式に認定した[39]。この決定は、娘核の崩壊の性質の確定と、理化学研究所による確認実験に基づくものであった[40]。
1998年より、ロシアのドゥブナ合同原子核研究所でも、238U(48Ca,3n)283Cnの熱核融合反応により、より重い同位体である283Cnの合成に向けた研究が行われた。279Dsへのアルファ崩壊も一例検出されたものの、観測された283Cnの大部分は自発核分裂により崩壊した。実験の当初には、生成された原子核(約3分の長い半減期を持つと観測されていた)を化学的性質に基づいて同定しようとしていたが、予想されたような水銀に似たものではないことが分かった(コペルニシウムは周期表上で水銀の下にある)[40]。実際は長寿命の放射性は283Cnによるものではなく、それが電子捕獲した娘核283Rgによる可能性が明らかとなった(もう一つの可能性は、準安定な核異性体283mCnである)[41]。後に、242Pu + 48Caと245Cm + 48Caの交差衝撃で、283Cnとその親核である287Fl、291Lvの性質が確定し、これが2011年の共同作業部会によるフレロビウムとリバモリウム(原子番号114と116)の発見の認定に重要な役割を果たした。しかしながらこの研究は、重イオン研究所による277Cnの研究よりも開始が遅かったため、優先権は重イオン研究所に与えられた[40]。
命名[編集]

ドミトリ・メンデレーエフによる未命名・未発見元素の命名規則により、112番元素は、エカ水銀として知られていた。1979年に国際純正・応用化学連合が出した勧告により、112番元素は発見が確定し正式に命名されるまでの間、ウンウンビウム(記号:Uub)と呼ばれることが推奨された[42]。この名前は、化学の授業からより上級の教科書まで、あらゆるレベルの化学コミュニティで広く使われたが、この分野の多くの科学者からはほぼ無視され、「元素112」と呼ばれたり、E112、(112)または単に112という記号で表された[43]。
重イオン研究所のチームによる発見の認定後、国際純正・応用化学連合は彼らに112番元素の名前を提案するよう求めた[40][44]。2009年7月14日、「私たちの世界の見方を変えた、顕著な科学者の業績を称え」て、ニコラウス・コペルニクスの名前に因んだコペルニシウムという名称とCpという記号が提案された[45]。
標準的な6か月間の、命名についての科学者コミュニティにおける議論の間[46][47]、Cpという記号は、現在ルテニウムとして知られている元素のかつての名前、カシオピウムの記号に割り当てられていたこと、また化合物のシクロペンタンジエンを表す記号と同じであることが指摘された[48][49]。この理由から、国際純正・応用化学連合は記号としてCpを用いることを認可せず、代わりにCnを用いることを提案した。コペルニクスの537回目の誕生日に当たる2010年2月19日、国際純正・応用化学連合は、提案された名前と記号を公式に認可した[46][50]。
同位体[編集]
コペルニシウムは、安定同位体や天然に生成する同位体を持たない。いくつかの放射性同位体が、2つの原子核の融合かより重い原子核の崩壊により、研究室内で合成されている。質量数が277と281から286までの7つの同位体が報告されており、質量数285のものの未確定の核異性体が報告されている[51]。これらの大部分は主にアルファ崩壊するが、いくつかは自発核分裂も起こし、283Cnは電子捕獲もすると考えられる[52]。
283Cnは、フレロビウム及びリバモリウムの発見に役立った[53]。
半減期[編集]
既知の全ての同位体は非常に不安定で放射性を持つ。一般的には重い同位体ほど安定である。既知の最も安定な同位体は285Cnで、半減期は29秒である。283Cnの半減期は4秒、未確定の285mCn、286Cnの半減期は、各々約15秒、8.45秒である。他の同位体の半減期は1秒よりも短い。281Cnと284Cnの半減期は数百ミリ秒で、その他2つの同位体の半減期は1ミリ秒より短い[52]。291Cnと293Cnは、安定の島の内側にあり、半減期は数十年より長い可能性があると予測される。それらの同位体は鉛の約10-12倍しか存在しないが、r過程で生成し宇宙線から検出されうると考えられる[54]。
コペルニシウムの軽い同位体は、崩壊生成物であることが知られていない277Cnを除き、2つの原子核の融合かより重い原子核の崩壊により生成されている。一方、重い同位体は、さらに重い原子核の崩壊による生成のみが知られる。2つの原子核の融合により生成する最も重い同位体は、283Cnで、これより重い3つの同位体は、より重い原子核の崩壊生成物としてのみ知られる[52]。
1999年、カリフォルニア大学バークレー校の科学者が293Og原子3個の合成に成功したと発表した[55]。これらの親核は、3つのアルファ粒子を連続して放出してコペルニシウム281核となり、崩壊エネルギー10.68 MeV、半減期0.90ミリ秒でアルファ崩壊したものと報告された。しかし、これらはニノフが捏造したデータに基づいたもので[56]、2001年に撤回された[57]。 この同位体は、2010年に同じチームによって、実際に合成された。新しいデータは、以前の捏造されたデータとは矛盾するものであった[58]。
予測される性質[編集]
コペルニシウムまたはその化合物で実測されている性質は非常に少ない。これは、生産が非常に限られておりまた高価であること[59]や、非常に早く崩壊するためである。沸点等、いくつかの化学的性質は実測されているが、金属コペルニシウムの性質の多くは不明であり、予測値のみが利用可能である。
化学的性質[編集]
コペルニシウムは、10番目で最後の6d元素であり、最も重い第12族元素である。周期表上では、亜鉛、カドミウム、水銀の下に位置するが、より軽い他の第12族元素とは性質がかなり異なることが予測されている。第12族元素と第7周期元素の最外殻のs小軌道は、コペルニシウムにおいて、相対論的に最も強く収縮すると予測される。このこととコペルニシウムが閉殻であることにより、コペルニシウムは、貴金属としての性質が強くなる。Cn2+/Cnに対しては、標準還元電位として+2.1 Vが予測される。第一イオン化エネルギーとして予測される1155 kJ/molは、希ガスのキセノンの値である1170.4 kJ/molとよく一致している[43]。コペルニシウムの金属結合は非常に弱いと考えられ、そのため希ガスのように揮発性が非常に高い可能性があり、室温で気体であるかもしれない[43][60]。しかし、銅、パラジウム、白金、銀、金との間で金属-金属結合を形成できると予想され、これらの結合は、水銀における同様の結合よりも弱い約15-20 kJ/molと予測される[43]。初期の提案に反して[61]、高精度のab initio計算によると[62]、1価のコペルニシウムの化学的性質は、希ガスよりも水銀に近いことが予測された。そのことは、コペルニシウムの空の7p1/2状態のエネルギーを大幅に低下させる、巨大なスピン軌道相互作用によって説明できる。
コペルニシウムがイオン化すると、その化学的性質は、亜鉛、カドミウム、水銀のものといくらか異なるものとなると考えられる。相対論効果による7s電子軌道の安定化と6d電子軌道の不安定化のため、Cn2+は[Rn]5f146d87s2の電子配置を取ると考えられ、同族元素とは異なり7s軌道の前に6d軌道から電子を失うことになる。6d電子が化学結合に関与しやすくなることは、コペルニシウムがイオン化すると、特に+4の酸化状態が可能になる等、より軽い同族元素と比べて遷移金属に近い振る舞いをすると考えられる。水溶液中では、+2、あるいは+4の酸化状態を取ると考えられる[43]。水銀が+1の酸化状態を取る2原子イオンHg22+はよく知られているが、Cn22+イオンは不安定であるか、存在しないことが予測されている[43]。フッ化コペルニシウム(II)(CnF2)は、同族元素化合物であるフッ化水銀(II)(HgF2)と比べて不安定であり、自発的に構成元素に分解する可能性がある。最も電気陰性な反応元素であるフッ素は、コペルニシウムを+4、さらに+6まで酸化できる唯一の元素であると考えられ、各々CnF4及びCnF6を生成する。後者は、議論されているフッ化水銀(IV)(HgF4)の検出のように、検出のためにマトリックス分離法を必要とする可能性がある。フッ化コペルニシウム(IV)(CnF4)は、フッ化コペルニシウム(II)よりも安定である。極性溶媒中では、中性フッ化物であるCnF4及びCnF2よりも、CnF5−やCnF3−を優先的に形成すると予測される。ただし、同族元素化合物である臭化物イオンやヨウ化物イオンは水溶液中での加水分解に対してより安定であると考えられる。CnCl42−陰イオンやCnBr42−陰イオンも、水溶液中で存在しうるはずである[43]。熱力学的に安定なCnF2やCnF4の形成は、キセノンの化学的性質に類似している[63]。シアン化水銀(II)(Hg(CN)2)のように、安定なシアン化物であるシアン化コペルニシウム(II)(Cn(CN)2)を形成すると考えられる[64]。
物理学的性質[編集]
コペルニシウムは密な金属で、300K、液体状態での密度は14.0 g/cm3である。これは、水銀の密度である13.534 g/cm3と近い(同じ温度での固体コペルニシウムは、より高密度の14.7 g/cm3と考えられる)。この結果は、水銀と比べたコペルニシウムの原子量の高さが原子間距離の長さを補っているためである[63]。いくつかの計算は、閉殻電子配置のためにコペルニシウムが室温で気体であると予測し[65]、周期表上、最初の気体金属としている[43][60]。2019年の計算でも、相対論効果についてこれらの予測と一致し、標準状態において、ロンドン分散力により結合する揮発性液体になるとしている。融点は283±11 K、沸点は340±10 Kと予測され、後者は実験的に推定された値である357+112
−108 Kと合致している[63]。原子半径は約147 pmと予測される。相対論的な7s軌道の安定性と6d軌道の不安定性のため、Cn+イオンとCn2+イオンは、7s軌道の代わりに6d軌道の電子を最初に失うと予測され、より軽い同族元素の振る舞いとは逆になっている[43]。
7s軌道の相対論的収縮と結合に加え、6d5/2軌道は、スピン軌道相互作用のために不安定化し、大きさ、形、エネルギーの面で7s軌道と似た振る舞いをする。バンド構造の予測については、計算により異なる。2007年の計算では、バンドギャップが約0.2 eV[66]の半導体で[67]、六方最密充填構造に結晶化すると予測された[66]。しかし、2017年及び2018年の計算では、コペルニシウムは標準状態でバンドギャップを持たず体心立方格子の結晶構造を取る貴金属であり、これは水銀と同様であるが、フェルミ準位の状態密度は、コペルニシウムの方が水銀よりも低いと予測された[68][69]。2019年の計算では、コペルニシウムは希ガスのラドン(7.1 eVと予測される)に匹敵する6.4 ± 0.2 eVという大きなバンドギャップを持つ絶縁体であると予測された。これらの計算では、バルクのコペルニシウムは、希ガスのように主にロンドン分散力により結合すると予測される[63]。水銀、ラドン、フレロビウムと同様に、またオガネソンとは異なり、コペルニシウムは電子親和力は持たないと計算される[70]。
コペルニシウム原子気体に関する実験[編集]
コペルニシウムの化学的性質への関心は、118種の全ての既知の元素の中で、相対論的効果が最大であるという点から引き起こされた[43]。コペルニシウムの基底状態での電子配置は[Rn] 5f14 6d10 7s2であり、構造原理によると、周期表の第12族元素に属する。このように、コペルニシウムは水銀より重い同族元素として振舞い、金等の貴金属と強い二元化合物を形成する。コペルニシウムの反応性を調査する実験として、吸着エンタルピーを計算するために、さまざまな温度に保持された金の表面への吸着を調べる研究が集中的に行われた。7s電子の相対論的安定化のため、コペルニシウムはラドンに似た性質を示した。また、水銀とラドンの放射性同位体を同時に形成する実験により、吸着特性が比較された[71]。
コペルニシウムに関する最初の化学実験は、238U(48Ca,3n)283Cn反応を用いて行われ、親種とされる同位体の半減期5分間の自発的核分裂により検出された。このデータの分析により、コペルニシウムは水銀よりも揮発性が高く、希ガスに近い性質を持つことが示された。しかし、コペルニシウム283の生成に関する複雑さからこれらの結果を疑問視する声もあった[71]。この不確実性を解消するために、2006年4月から5月の間にドゥブナ合同原子核研究所において、フリョロフ原子核反応研究所とポール・シェラー研究所のチームは、242Pu(48Ca,3n)287Flの反応による娘核としてこの同位体の合成を調査する実験を行った[71](242Pu + 48Caの核融合反応の反応断面積は、238U + 48Caの反応よりも若干大きく、そのため化学実験でコペルニシウムを合成する最適な方法は、一旦フレロビウムを合成して、その娘核として合成することである)[72]。この実験では、2つのコペルニシウム283原子が合成されていることが疑問の余地なく示され、吸着特性から、金との金属間結合が弱いため水銀よりも揮発性の高い同族元素であることが示された[71]。このことは、コペルニシウムが水銀と「多かれ少なかれ」同族元素としての性質を持つという、相対論的計算の一般的な結論と一致している[73]。しかし、2019年、この結果は、単に強い分散相互作用によるものである可能性が指摘された[63]。
2007年4月、この実験は追試され、さらに3つのコペルニシウム283原子が明瞭に確認された。吸着特性が確認され、第12族元素で最も重い元素であるという事実と一致する値が示された[71]。これらの実験により、沸点が84+112
−108 ℃であることも初めて推定され、標準状態では気体である可能性があるとされた[67]。
第12族のより軽い元素は、しばしば第16族元素の鉱石中に産出するため、2015年にセレン表面上にコペルニシウムを堆積させ、セレン化コペルニシウム(CnSe)を形成する実験が行われた。コペルニシウム原子と三方晶セレンがセレン化物を形成する反応が観察され、吸着エンタルピーは−ΔHadsCn(t-Se) > 48 kJ/molであった。セレン化物形成について、熱力学的には水銀に比べてコペルニシウムが不利だと予想されていたが、反応速度論的には水銀よりもコペルニシウムの方が有利であることが示された[74]。第12族元素のセレン化物の安定性は、セレン化亜鉛(ZnSe)からセレン化水銀(ZnHg)の方に向かって減少する傾向があるため、この結果は予想外であった[75]。
脚注[編集]
注釈[編集]
- ^ 核物理学では、原子番号の大きい元素は、「重い」元素と呼ばれる。原子番号82の鉛は、重い元素の一例である。「超重元素」という用語は、通常、原子番号103以降の元素を指す(ただし、原子番号100[3]以降とするものや112以降[4]とするもの等、いくつかの定義がある[5])。ある元素における「重い同位体」や「重い核」という言葉は、各々、質量の大きい同位体、質量の大きい核を指す。
- ^ 2009年、ユーリイ・オガネシアン率いるドゥブナ合同原子核研究所のチームは、対称の136Xe + 136Xe反応におけるハッシウム合成の試みの結果について公表した。彼らはこの反応で単原子を観測できず、反応断面積の上限を2.5 pbとした[6]。対照的に、ハッシウムの発見に繋がった反応である208Pb + 58Feの反応断面積は、発見者らにより19+19
−11pbと推定された[7]。 - ^ 励起エネルギーが大きくなるほど、より多くの中性子が放出される。励起エネルギーが、各々の中性子を残りの核子に結び付けるエネルギーより低い場合、中性子は放出されない。その代わり、複合核はガンマ線を放出して脱励起する[11]。
- ^ IUPAC・IUPAP共同作業部会による定義では、その核が10-14秒にわたり崩壊しない場合にのみ、発見として認定される。この値は、原子核が外側の電子を獲得して化学的性質を示すのにかかる時間の推定値として選択された[12]。また、一般的に考えられる複合核の寿命の上限値を示すものでもある[13]。
- ^ この分離は、生成した原子核が未反応の粒子線の原子核よりも、標的をよりゆっくり通り過ぎることに基づく。セパレーター内には電場と磁場が印加されているが、特定の粒子速度で移動する粒子に対してはそれらの影響が相殺されるようになっている[15]。このような分離は、飛行時間型質量分析計や反跳エネルギー測定によって補完されることがある。この2つを組み合わせると原子核の質量を推定することが可能となる[16]。
- ^ 全ての崩壊モードが静電反発を原因とするのではなく、例えば、ベータ崩壊の原因は弱い相互作用である[19]。
- ^ 原子核の質量は直接測定されず、ほかの原子核の値から計算され、このような方法を間接的と呼ぶ。直接測定も可能であるが、もっとも重い原子核についてはほとんどの場合可能ではない[22]。超重元素の質量の直接測定は、2018年にローレンス・バークレー国立研究所により初めて報告された[23]。
- ^ 自発核分裂は、ドゥブナ合同原子核研究所を率いていたゲオルギー・フリョロフにより発見され[24]、この研究所の得意分野となった[25]。対称的に、ローレンス・バークレー国立研究所の科学者は、自発核分裂から得られる情報は新元素の合成を裏付けるのに不十分であると信じていた。これは、複合核が中性子だけを放出し、陽子やアルファ粒子のような荷電粒子を放出しないことを立証するのは困難なためである[13]。そのため彼らは、連続的なアルファ崩壊により、新しい同位体を既知の同位体と結び付ける方法を好んだ[24]。
- ^ 例えば、1957年にスウェーデンのノーベル物理学研究所は、102番元素を誤同定した[26]。これ以前にこの元素の合成に関する決定的な主張はなく、発見者により、ノーベリウムと命名されたが、後に、この同定は誤りであったことが分かった[27]。翌年、ローレンス・バークレー国立研究所は、ノーベル物理学研究所による結果は再現性がなく、代わりに彼ら自身がこの元素を合成したと発表したが、この主張も後に誤りであったことが判明した[27]。ドゥブナ合同原子核研究所は、彼らこそがこの元素を最初に合成したと主張し、ジョリオチウムと命名したが[28]、この名前も認定されなかった(ドゥブナ合同原子核研究所は、のちに、102番元素の命名は「性急」であったと述べた)[29]。「ノーベリウム」という名前は、広く使われていたため、変更されなかった[30]。
出典[編集]
- ^ “Interactive Chart of Nuclides”. National Nuclear Data Center. 2015年11月20日閲覧。
- ^ Eichler, R. (2007). “Chemical Characterization of Element 112”. Nature 447 (7140): 72-75. Bibcode: 2007Natur.447...72E. doi:10.1038/nature05761. PMID 17476264.
- ^ Kramer, K. (2016年). “Explainer: superheavy elements”. Chemistry World. 2020年3月15日閲覧。
- ^ “Discovery of Elements 113 and 115”. Lawrence Livermore National Laboratory. 2015年9月11日時点のオリジナルよりアーカイブ。2020年3月15日閲覧。
- ^ Eliav, E.; Kaldor, U.; Borschevsky, A. (2018). "Electronic Structure of the Transactinide Atoms". In Scott, R. A. (ed.). Encyclopedia of Inorganic and Bioinorganic Chemistry. John Wiley & Sons. pp. 1–16. doi:10.1002/9781119951438.eibc2632. ISBN 978-1-119-95143-8. S2CID 127060181。
- ^ Oganessian, Yu. Ts.; Dmitriev, S. N.; Yeremin, A. V. et al. (2009). “Attempt to produce the isotopes of element 108 in the fusion reaction 136Xe + 136Xe”. Physical Review C 79 (2): 024608. doi:10.1103/PhysRevC.79.024608. ISSN 0556-2813.
- ^ Munzenberg, G.; Armbruster, P.; Folger, H. et al. (1984). “The identification of element 108”. Zeitschrift fur Physik A 317 (2): 235-236. Bibcode: 1984ZPhyA.317..235M. doi:10.1007/BF01421260. オリジナルの7 June 2015時点におけるアーカイブ。 2012年10月20日閲覧。.
- ^ Subramanian, S. (2019年). “Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist”. Bloomberg Businessweek. 2020年11月14日時点のオリジナルよりアーカイブ。2020年1月18日閲覧。
- ^ Ivanov, D. (2019年). “Сверхтяжелые шаги в неизвестное” [Superheavy steps into the unknown] (ロシア語). nplus1.ru. 2020年2月2日閲覧。
- ^ Hinde, D. (2014年). “Something new and superheavy at the periodic table”. The Conversation. 2020年1月30日閲覧。
- ^ a b Krasa, A. (2010年). “Neutron Sources for ADS”. Czech Technical University in Prague. pp. 4-8. 2019年3月3日時点のオリジナルよりアーカイブ。2019年10月20日閲覧。
- ^ Wapstra, A. H. (1991). “Criteria that must be satisfied for the discovery of a new chemical element to be recognized”. Pure and Applied Chemistry 63 (6): 883. doi:10.1351/pac199163060879. ISSN 1365-3075 2020年8月28日閲覧。.
- ^ a b Hyde, E. K.; Hoffman, D. C.; Keller, O. L. (1987). “A History and Analysis of the Discovery of Elements 104 and 105”. Radiochimica Acta 42 (2): 67-68. doi:10.1524/ract.1987.42.2.57. ISSN 2193-3405.
- ^ a b c Chemistry World (2016年). “How to Make Superheavy Elements and Finish the Periodic Table [Video]”. Scientific American. 2020年1月27日閲覧。
- ^ Hoffman, Ghiorso & Seaborg 2000, p. 334.
- ^ Hoffman, Ghiorso & Seaborg 2000, p. 335.
- ^ Zagrebaev, Karpov & Greiner 2013, p. 3.
- ^ Beiser 2003, p. 432.
- ^ Beiser 2003, p. 439.
- ^ Staszczak, A.; Baran, A.; Nazarewicz, W. (2013). “Spontaneous fission modes and lifetimes of superheavy elements in the nuclear density functional theory”. Physical Review C 87 (2): 024320-1. arXiv:1208.1215. Bibcode: 2013PhRvC..87b4320S. doi:10.1103/physrevc.87.024320. ISSN 0556-2813.
- ^ Audi et al. 2017, pp. 030001-128–030001-138.
- ^ Oganessian, Yu. Ts.; Rykaczewski, K. P. (2015). “A beachhead on the island of stability”. Physics Today 68 (8): 32-38. Bibcode: 2015PhT....68h..32O. doi:10.1063/PT.3.2880. ISSN 0031-9228. OSTI 1337838.
- ^ Grant, A. (2018). “Weighing the heaviest elements”. Physics Today. doi:10.1063/PT.6.1.20181113a.
- ^ a b Robinson, A. E. (2019). “The Transfermium Wars: Scientific Brawling and Name-Calling during the Cold War”. Distillations 2020年2月22日閲覧。.
- ^ “Популярная библиотека химических элементов. Сиборгий (экавольфрам)” [Popular library of chemical elements. Seaborgium (eka-tungsten)] (ロシア語). n-t.ru. 2020年1月7日閲覧。 Reprinted from “Экавольфрам [Eka-tungsten]” (ロシア語). Популярная библиотека химических элементов. Серебро - Нильсборий и далее [Popular library of chemical elements. Silver through nielsbohrium and beyond]. Nauka. (1977)
- ^ “Nobelium - Element information, properties and uses | Periodic Table”. Royal Society of Chemistry. 2020年3月1日閲覧。
- ^ a b Kragh 2018, pp. 38–39.
- ^ Kragh 2018, p. 40.
- ^ Ghiorso, A.; Seaborg, G. T.; Oganessian, Yu. Ts. et al. (1993). “Responses on the report 'Discovery of the Transfermium elements' followed by reply to the responses by Transfermium Working Group”. Pure and Applied Chemistry 65 (8): 1815-1824. doi:10.1351/pac199365081815. オリジナルの25 November 2013時点におけるアーカイブ。 2016年9月7日閲覧。.
- ^ Commission on Nomenclature of Inorganic Chemistry (1997). “Names and symbols of transfermium elements (IUPAC Recommendations 1997)”. Pure and Applied Chemistry 69 (12): 2471-2474. doi:10.1351/pac199769122471.
- ^ a b Hofmann, S. (1996). “The new element 112”. Zeitschrift fur Physik A 354 (1): 229-230. Bibcode: 1996ZPhyA.354..229H. doi:10.1007/BF02769517.
- ^ Hofmann, S. (2000). “New Results on Element 111 and 112”. European Physical Journal A (Gesellschaft fur Schwerionenforschung) 14 (2): 147-157. Bibcode: 2002EPJA...14..147H. doi:10.1140/epja/i2001-10119-x. オリジナルのFebruary 27, 2008時点におけるアーカイブ。 2008年3月2日閲覧。.
- ^ Morita, K. (2004). "Decay of an Isotope 277112 produced by 208Pb + 70Zn reaction". In Penionzhkevich, Yu. E.; Cherepanov, E. A. (eds.). Exotic Nuclei: Proceedings of the International Symposium. World Scientific. pp. 188–191. doi:10.1142/9789812701749_0027。
- ^ Sumita, Takayuki; Morimoto, Kouji; Kaji, Daiya; Haba, Hiromitsu; Ozeki, Kazutaka; Sakai, Ryutaro; Yoneda, Akira; Yoshida, Atsushi et al. (2013). “New Result on the Production of277Cn by the208Pb +70Zn Reaction”. Journal of the Physical Society of Japan 82 (2): 024202. Bibcode: 2013JPSJ...82b4202S. doi:10.7566/JPSJ.82.024202.
- ^ Popeko, Andrey G. (2016年). “Synthesis of superheavy elements”. jinr.ru. Joint Institute for Nuclear Research. 2018年2月4日時点のオリジナルよりアーカイブ。2018年2月4日閲覧。
- ^ Karol, P. J.; Nakahara, H.; Petley, B. W.; Vogt, E. (2001). “On the Discovery of the Elements 110-112”. Pure and Applied Chemistry 73 (6): 959-967. doi:10.1351/pac200173060959. オリジナルのMarch 9, 2018時点におけるアーカイブ。 2008年1月9日閲覧。.
- ^ Karol, P. J.; Nakahara, H.; Petley, B. W.; Vogt, E. (2003). “On the Claims for Discovery of Elements 110, 111, 112, 114, 116 and 118”. Pure and Applied Chemistry 75 (10): 1061-1611. doi:10.1351/pac200375101601. オリジナルのAugust 22, 2016時点におけるアーカイブ。 2008年1月9日閲覧。.
- ^ “Evidence for Isomeric States in 261Rf”. Annual Report. Paul Scherrer Institute (2001年). 2011年7月7日時点のオリジナルよりアーカイブ。2022年12月14日閲覧。
- ^ “A New Chemical Element in the Periodic Table”. Gesellschaft fur Schwerionenforschung (2009年6月10日). 2009年8月23日時点のオリジナルよりアーカイブ。2012年4月14日閲覧。
- ^ a b c d Barber, R. C. (2009). “Discovery of the element with atomic number 112”. Pure and Applied Chemistry 81 (7): 1331. doi:10.1351/PAC-REP-08-03-05.
- ^ Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Munzenberg, G.; Antalic, S.; Barth, W.; Burkhard, H. G.; Dahl, L.; Eberhardt, K.; Grzywacz, R.; Hamilton, J. H.; Henderson, R. A.; Kenneally, J. M.; Kindler, B.; Kojouharov, I.; Lang, R.; Lommel, B.; Miernik, K.; Miller, D.; Moody, K. J.; Morita, K.; Nishio, K.; Popeko, A. G.; Roberto, J. B.; Runke, J.; Rykaczewski, K. P.; Saro, S.; Schneidenberger, C.; Schott, H. J.; Shaughnessy, D. A.; Stoyer, M. A.; Thorle-Pospiech, P.; Tinschert, K.; Trautmann, N.; Uusitalo, J.; Yeremin, A. V. (2016). "Remarks on the Fission Barriers of SHN and Search for Element 120". In Peninozhkevich, Yu. E.; Sobolev, Yu. G. (eds.). Exotic Nuclei: EXON-2016 Proceedings of the International Symposium on Exotic Nuclei. Exotic Nuclei. pp. 155–164. ISBN 9789813226555。
- ^ Chatt, J. (1979). “Recommendations for the naming of elements of atomic numbers greater than 100”. Pure and Applied Chemistry 51 (2): 381-384. doi:10.1351/pac197951020381.
- ^ a b c d e f g h i j Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). “Transactinides and the future elements”. In Morss; Edelstein, Norman M.; Fuger, Jean. The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Dordrecht, The Netherlands: Springer Science+Business Media. ISBN 1-4020-3555-1
- ^ “New Chemical Element in the Periodic Table”. Science Daily (2009年6月11日). 2022年12月14日閲覧。
- ^ “Element 112 shall be named "copernicium"”. Gesellschaft fur Schwerionenforschung (2009年7月14日). 2009年7月18日時点のオリジナルよりアーカイブ。2022年12月14日閲覧。
- ^ a b “New element named 'copernicium'”. BBC News (2009年7月16日). 2010年2月22日閲覧。
- ^ “Start of the Name Approval Process for the Element of Atomic Number 112”. IUPAC (2009年7月20日). 2012年11月27日時点のオリジナルよりアーカイブ。2012年4月14日閲覧。
- ^ Meija, Juris (2009). “The need for a fresh symbol to designate copernicium”. Nature 461 (7262): 341. Bibcode: 2009Natur.461..341M. doi:10.1038/461341c. PMID 19759598.
- ^ “Lutetium”. Elementymology & Elements Multidict. 2010年2月22日閲覧。
- ^ “IUPAC Element 112 is Named Copernicium”. IUPAC (2010年2月19日). 2016年3月4日時点のオリジナルよりアーカイブ。2012年4月13日閲覧。
- ^ Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Khuyagbaatar, J.; Ackermann, D.; Antalic, S.; Barth, W. et al. (2012). “The reaction 48Ca + 248Cm → 296116* studied at the GSI-SHIP”. The European Physical Journal A 48 (5): 62. Bibcode: 2012EPJA...48...62H. doi:10.1140/epja/i2012-12062-1.
- ^ a b c Holden, N. E. (2004). “Table of the Isotopes”. In D. R. Lide. CRC Handbook of Chemistry and Physics (85th ed.). CRC Press. Section 11. ISBN 978-0-8493-0485-9
- ^ Barber, R. C. (2011). “Discovery of the elements with atomic numbers greater than or equal to 113”. Pure and Applied Chemistry 83 (7): 5-7. doi:10.1351/PAC-REP-10-05-01.
- ^ Zagrebaev, Karpov & Greiner 2013, pp. 1–15.
- ^ Ninov, V. (1999). “Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb”. Physical Review Letters 83 (6): 1104-1107. Bibcode: 1999PhRvL..83.1104N. doi:10.1103/PhysRevLett.83.1104.
- ^ At Lawrence Berkeley, Physicists Say a Colleague Took Them for a Ride George Johnson, The New York Times, 15 October 2002
- ^ Public Affairs Department (2001年7月21日). “Results of element 118 experiment retracted”. Berkeley Lab. オリジナルの2008年1月29日時点におけるアーカイブ。 2008年1月18日閲覧。
- ^ Public Affairs Department (2010年10月26日). “Six New Isotopes of the Superheavy Elements Discovered: Moving Closer to Understanding the Island of Stability”. Berkeley Lab 2011年4月25日閲覧。
- ^ Subramanian, S. (2019年8月28日). “Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist” 2020年1月18日閲覧。
- ^ a b "Chemistry on the islands of stability", New Scientist, 11 September 1975, p. 574, ISSN 1032-1233
- ^ Pitzer, K. S. (1975). “Are elements 112, 114, and 118 relatively inert gases?”. The Journal of Chemical Physics 63 (2): 1032-1033. doi:10.1063/1.431398.
- ^ Mosyagin, N. S.; Isaev, T. A.; Titov, A. V. (2006). “Is E112 a relatively inert element? Benchmark relativistic correlation study of spectroscopic constants in E112H and its cation”. The Journal of Chemical Physics 124 (22): 224302. arXiv:physics/0508024. Bibcode: 2006JChPh.124v4302M. doi:10.1063/1.2206189. PMID 16784269.
- ^ a b c d e Mewes, J.-M.; Smits, O. R.; Kresse, G.; Schwerdtfeger, P. (2019). “Copernicium is a Relativistic Noble Liquid”. Angewandte Chemie International Edition. doi:10.1002/anie.201906966.
- ^ Demissie, Taye B.; Ruud, Kenneth (25 February 2017). “Darmstadtium, roentgenium, and copernicium form strong bonds with cyanide”. International Journal of Quantum Chemistry 2017: e25393. doi:10.1002/qua.25393. hdl:10037/13632.
- ^ Kratz, Jens Volker. The Impact of Superheavy Elements on the Chemical and Physical Sciences. 4th International Conference on the Chemistry and Physics of the Transactinide Elements, 5 - 11 September 2011, Sochi, Russia
- ^ a b Gaston, Nicola; Opahle, Ingo; Gaggeler, Heinz W.; Schwerdtfeger, Peter (2007). “Is eka-mercury (element 112) a group 12 metal?”. Angewandte Chemie 46 (10): 1663-6. doi:10.1002/anie.200604262. PMID 17397075 2013年11月5日閲覧。.
- ^ a b Eichler, R.; Aksenov, N. V.; Belozerov, A. V.; Bozhikov, G. A.; Chepigin, V. I.; Dmitriev, S. N.; Dressler, R.; Gaggeler, H. W. et al. (2008). “Thermochemical and physical properties of element 112”. Angewandte Chemie 47 (17): 3262-6. doi:10.1002/anie.200705019. PMID 18338360.
- ^ Gyanchandani, Jyoti; Mishra, Vinayak; Dey, G. K.; Sikka, S. K. (January 2018). “Super heavy element Copernicium: Cohesive and electronic properties revisited”. Solid State Communications 269: 16-22. Bibcode: 2018SSCom.269...16G. doi:10.1016/j.ssc.2017.10.009 2018年3月28日閲覧。.
- ^ ?en?arikova, Hana; Legut, Dominik (2018). “The effect of relativity on stability of Copernicium phases, their electronic structure and mechanical properties”. Physica B 536: 576-582. arXiv:1810.01955. Bibcode: 2018PhyB..536..576C. doi:10.1016/j.physb.2017.11.035.
- ^ “Fully relativistic ab initio studies of superheavy elements”. www.kernchemie.uni-mainz.de. Johannes Gutenberg University Mainz. 2018年1月15日時点のオリジナルよりアーカイブ。2018年1月15日閲覧。
- ^ a b c d e “Gas Phase Chemistry of Superheavy Elements”. Paul Scherrer Institute. pp. 26-28 (2007年). 2012年2月20日時点のオリジナルよりアーカイブ。2022年12月14日閲覧。
- ^ Moody, Ken (2013-11-30). “Synthesis of Superheavy Elements”. In Schadel, Matthias; Shaughnessy, Dawn. The Chemistry of Superheavy Elements (2nd ed.). Springer Science & Business Media. pp. 24-8. ISBN 9783642374661
- ^ “Relativistic DFT and ab initio calculations on the seventh-row superheavy elements: E113 - E114”. jinr.ru (2007年9月). 2018年2月17日閲覧。
- ^ Towards selenides of the SHE copernicium and flerovium - unexpected Cn-Se bond observation. 5th international conference on the chemistry and physics of the transactinide elements (TAN 15). Fukushima, Japan. 2015. 2023年10月15日閲覧。
- ^ “Annual Report 2015: Laboratory of Radiochemistry and Environmental Chemistry”. Paul Scherrer Institute. p. 3 (2015年). 2022年12月14日閲覧。
関連文献[編集]
- Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). “The NUBASE2016 evaluation of nuclear properties”. Chinese Physics C 41 (3): 030001. Bibcode: 2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- Beiser, A. (2003). Concepts of modern physics (6th ed.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418
- Hoffman, D. C.; Ghiorso, A.; Seaborg, G. T. (2000). The Transuranium People: The Inside Story. World Scientific. ISBN 978-1-78-326244-1
- Kragh, H. (2018). From Transuranic to Superheavy Elements: A Story of Dispute and Creation. Springer Science+Business Media. ISBN 978-3-319-75813-8
- Zagrebaev, Valeriy; Karpov, Alexander; Greiner, Walter (2013). "Future of superheavy element research: Which nuclei could be synthesized within the next few years?" (PDF). 11th International Conference on Nucleus-Nucleus Collisions (NN2012). Journal of Physics: Conference Series. Vol. 420. IOP Publishing. doi:10.1088/1742-6596/420/1/012001. 2013年8月20日閲覧。
外部リンク[編集]
- Copernicium at The Periodic Table of Videos (University of Nottingham)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| |||||||||||||||||||||||||||||||||

