Atomoxetina
| Atomoxetina Alerta sobre risco à saúde | |
|---|---|
| |

| |
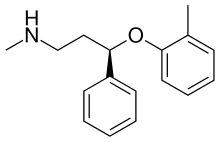
| Nome IUPAC | (3R)-N-Methyl-3-(2-methylphenoxy)-3-phenylpropan-1-amine |
| Identificadores | |
| Número CAS | |
| PubChem | |
| DrugBank | DB00289 |
| KEGG | |
| ChEBI | |
| Código ATC | N06 |
| SMILES |
|
| DCB n° | 08769 |
| Primeiro nome comercial ou de referência | Strattera |
| Propriedades | |
| Fórmula química | C17H21NO |
| Massa molar | 255.35 g mol-1 |
| Farmacologia | |
| Biodisponibilidade | 63 a 94%[1][2][3] |
| Via(s) de administração | Oral |
| Metabolismo | Hepático, via CYP2D6[1][2][3] |
| Meia-vida biológica | 4.5–25 horas[1][2][3][4][5] |
| Ligação plasmática | 98%[1][2][3] |
| Excreção | Renal (80%) e fecal (17%)[1][2][3] |
| Classificação legal | |
| Riscos na gravidez e lactação |
B3(AU) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |

A atomoxetina é um agente neurotônico, indicado exclusivamente para o tratamento de TDAH. Apesar de classificar-se como antidepressivo, não tem efeitos clínicos estudados e aprovados para este propósito. É um bloqueador seletivo da recaptura de noradrenalina cuja patente pertence ao laboratório Eli Lilly and Company EUA Ativa US20150133562A1, Arup Kumar ROY & Matthew Scott MERMEY, "Atomoxetine Solution", publicado em 03 de maio de 2016. Há genéricos fabricados em outros países sob os nomes Tomoxetin (Torrent Pharmaceuticals), Attentin (Ranbaxy Laboratories - divisão Solus) e outros.
No Brasil, a Eli Lilly entrou com ação em 2014 para garantir exclusividade na venda do medicamento, mas o pedido foi negado e julgado improcedente, desta forma garantindo a possibilidade da produção de genérico.[6] Em 2016, o registro do medicamento da Eli Lilly na ANVISA venceu e não foi renovado.[7]
Em 3 de Julho de 2023, a Apsen Farmacêutica teve seu registro publicado na ANVISA sob o nome comercial Atentah.[8]
Referências
- ↑ a b c d e «atomoxetine (Rx) – Strattera». Medscape Reference. WebMD. Consultado em 10 Novembro 2013. Cópia arquivada em 10 Novembro 2013
- ↑ a b c d e «Strattera (atomoxetine hydrochloride)». TGA eBusiness Services. Eli Lilly Australia Pty. Limited. 21 Agosto 2013. Consultado em 10 Novembro 2013. Cópia arquivada em 6 Abril 2017
- ↑ a b c d e «Atomoxetine Hydrochloride capsule [Mylan Pharmaceuticals Inc.]». DailyMed. Mylan Pharmaceuticals Inc. Outubro 2011. Consultado em 10 Novembro 2013. Cópia arquivada em 10 Novembro 2013
- ↑ Sauer JM, Ring BJ, Witcher JW (2005). «Clinical pharmacokinetics of atomoxetine». Clinical Pharmacokinetics. 44 (6): 571–90. PMID 15910008. doi:10.2165/00003088-200544060-00002
- ↑ Brown JT, Bishop JR (2015). «Atomoxetine pharmacogenetics: associations with pharmacokinetics, treatment response and tolerability». Pharmacogenomics. 16 (13): 1513–1520. PMID 26314574. doi:10.2217/PGS.15.93
- ↑ «PRF 1ª Região e PF/ANVISA: Procuradorias asseguram a validade do procedimento de registro de medicamentos genéricos ou similares ao medicamento de referência Strattera, usado para tratamento de hiperatividade». Advocacia Geral da União. 9 de junho de 2014. Arquivado do original em 15 de maio de 2019
- ↑ «Strattera - Agência Nacional de Vigilância Sanitária». ANVISA. Consultado em 31 de julho de 2023
- ↑ «ATENTAH - Agência Nacional de Vigilância Sanitária». ANVISA. Consultado em 31 de julho de 2023

