Adenilosuccinato liase
| Adenilosuccinato liase | |||||||
|---|---|---|---|---|---|---|---|
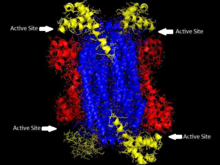
| 'A estrutura homotetramérica de ASL em Thermotoga maritima Domínio 1 em vermelho, Domínio 2 em azul, Domínio 3 em amarelo. Essa estrutura foi inspirada por um artigo de Toth e Yeates[1] | |||||||
| Indicadores | |||||||
| Número EC | 4.3.2.2 | ||||||
| Número CAS | 9027-81-0-- | ||||||
| Bases de dados | |||||||
| IntEnz | IntEnz | ||||||
| BRENDA | BRENDA | ||||||
| ExPASy | NiceZyme | ||||||
| KEGG | KEGG | ||||||
| MetaCyc | via metabólica | ||||||
| PRIAM | PRIAM | ||||||
| Estruturas PDB | RCSB PDB PDBe PDBj PDBsum | ||||||
| Gene Ontology | AmiGO / EGO | ||||||
| |||||||
Adenilosuccinato liase (ou adenilosuccinase) é uma enzima que em humanos é codificado pelo gene ADSL.[2]
Adenilosuccinato liase converte adenilosuccinato a AMP e fumarato como parte do ciclo de nucleotídeos purina. ASL catalisa duas reaçõesa na via biossintética das purinas que produz AMP; ASL cliva adenilosuccinato em AMP e fumarato, e cliva SAICAR em AICAR e fumarato.
Adenilosuccinato liase é parte da superfamília eliminação β de enzimas e isso ocorre através de um mecanismo de reação E1cb. A enzima é um homotetrâmero com três domínios em cada monômero e quatro sítios ativos por homotetrâmero.
Mutações pontuais em adenilosuccinato que causam diminuição da atividade enzimática causam sintomas clínicos que marcam a condição deficiência de adenilosuccinato liase.
Esta proteína pode usar o modelo morfeína de regulação alostérica.[3]
Referências
- ↑ Toth, EA; Yeates, TO (Fevereiro de 2000). «The structure of adenylosuccinate lyase, an enzyme with dual activity in the de novo purine biosynthetic pathway». Structure. 8 (2): 163–74. PMID 10673438. doi:10.1016/S0969-2126(00)00092-7

- ↑ «Entrez Gene: Adenylosuccinate lyase». Consultado em 1 de março de 2012
- ↑ Selwood, T; Jaffe, EK (Mar 2012). «Dynamic dissociating homo-oligomers and the control of protein function». Archives of Biochemistry and Biophysics. 519 (2): 131–43. PMC 3298769
 . PMID 22182754. doi:10.1016/j.abb.2011.11.020
. PMID 22182754. doi:10.1016/j.abb.2011.11.020