Lactato desidrogenase: diferenças entre revisões
| Linha 3: | Linha 3: | ||
== Reacções == |
== Reacções == |
||
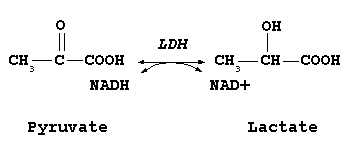
Catalisa a interconversão de [[piruvato]] e [[lactato]] com uma concomitante interconversão de NADH e [[Dinucleótido de nicotinamida e adenina|NAD<sup>+</sup>]]. Converte o piruvato, o produto final da [[glicólise]] em ácido láctico quando o oxigénio está ausente ou em pequenas quantidades, e realiza a |
Catalisa a interconversão de [[piruvato]] e [[lactato]] com uma concomitante interconversão de NADH e [[Dinucleótido de nicotinamida e adenina|NAD<sup>+</sup>]]. Converte o piruvato, o produto final da [[glicólise]] em ácido láctico quando o oxigénio está ausente ou em pequenas quantidades, e realiza a reação reversa durante o [[ciclo de Cori]], via glicolítica anaeróbica, no [[fígado]]. A grandes concentrações de lactato, a enzima exibe inibição por ''feedback'' e a taxa de conversão do piruvato a lactato é reduzida. Em [[humanos]], embora presente em praticamente todos os [[tecidos]] do corpo (em cinco diferentes isoformas), há quantidade muito mais elevada em [[células]] adaptáveis (mesmo que por curtíssimo período de tempo) à [[via anaeróbica]], como os diferentes [[miócitos]], ou que dela dependem, como os [[eritrócitos]]. Sua elevação pode ser dosada durante dano tecidual inespecífico (LDH-Total). Se comprovada, solicita-se dosagem de suas isoformas no auxílio de qual órgão está a ser afetado, acordando para o fato de maior quantidade de LDH-1 estar presente na mm cardíaca e [[eritrócitos]], LDH-2 nos [[leucócitos]] e [[miócitos]] cardíacos, LDH-3 nos [[pneumócitos]], LDH-4 nos [[rins]], [[placenta]] e [[pâncreas]] e LDH-5 nos [[hepatócitos]] e [[miócitos]] esqueléticos. |
||
[[Ficheiro:LDH reaction.png|centro|thumb|355px|Função catalítica da LDH]] |
[[Ficheiro:LDH reaction.png|centro|thumb|355px|Função catalítica da LDH]] |
||
Revisão das 22h09min de 26 de maio de 2013

A lactato desidrogenase (LDH) é uma enzima (EC 1.1.1.27) presente numa grande variedade de organismos, incluindo plantas e animais.
Reacções
Catalisa a interconversão de piruvato e lactato com uma concomitante interconversão de NADH e NAD+. Converte o piruvato, o produto final da glicólise em ácido láctico quando o oxigénio está ausente ou em pequenas quantidades, e realiza a reação reversa durante o ciclo de Cori, via glicolítica anaeróbica, no fígado. A grandes concentrações de lactato, a enzima exibe inibição por feedback e a taxa de conversão do piruvato a lactato é reduzida. Em humanos, embora presente em praticamente todos os tecidos do corpo (em cinco diferentes isoformas), há quantidade muito mais elevada em células adaptáveis (mesmo que por curtíssimo período de tempo) à via anaeróbica, como os diferentes miócitos, ou que dela dependem, como os eritrócitos. Sua elevação pode ser dosada durante dano tecidual inespecífico (LDH-Total). Se comprovada, solicita-se dosagem de suas isoformas no auxílio de qual órgão está a ser afetado, acordando para o fato de maior quantidade de LDH-1 estar presente na mm cardíaca e eritrócitos, LDH-2 nos leucócitos e miócitos cardíacos, LDH-3 nos pneumócitos, LDH-4 nos rins, placenta e pâncreas e LDH-5 nos hepatócitos e miócitos esqueléticos.
Também catalisa a desidrogenação de 2-hidroxibutirato, mas é um substrato mais fraco que o lactato. Existe pouca ou nenhuma actividade com beta-hidroxibutirato.
