Ciclo ozônio-oxigênio: diferenças entre revisões
| Linha 1: | Linha 1: | ||
[[Imagem:Ozone cycle.jpg|thumb|right|350px]] |
[[Imagem:Ozone cycle.jpg|thumb|right|350px]] |
||
'''Ciclo ozônio-oxigênio''', mais conhecido como '''ciclo do ozônio''', é o nome dado ao processo de interconversibilidade entre o [[ozônio]] e o [[oxigênio]], o qual ocorre na [[estratosfera]]. Este ciclo é responsável pela absorção da maior parte da radiação ultravioleta, que pode causar problemas aos seres vivos, como mutações gênicas ou câncer. |
'''Ciclo ozônio-oxigênio''', mais conhecido como '''ciclo do ozônio''', é o nome dado ao processo de interconversibilidade entre o [[ozônio]] e o [[oxigênio]], o qual ocorre na [[estratosfera]]. Este ciclo é responsável pela absorção da maior parte da [[radiação ultravioleta]] solar, que pode causar sérios problemas aos seres vivos, como mutações gênicas ou câncer. |
||
O ciclo ozônio-oxigênio pode ser resumido pela equação química: |
|||
O O<sub>3</sub> é bastante instável, e, para se desintegrar, absorve radiação solar. |
|||
* O<sub>3</sub> |
* O<sub>3</sub> ⇌ O<sub>2</sub> + [O] |
||
| ⚫ | |||
Na reação direta, o ozônio absorve grande quantidade de [[radiação ultravioleta]], e, na reação inversa, há pequeno desprendimento de energia térmica. Este [[equilíbrio químico]] é responsável pela filtração desta radiação. |
|||
Durante todo este processo há absorção de [[radiação solar]], e é esse efeito que a "filtra". O efeito prejudicial de gases como o [[CFC]] é o fornecimento da energia de ativação necessária para a desintegração do ozônio em oxigênio molecular e nascente (ou atômico). Ao fazer isso, o ozônio não absorve a energia solar e portanto não protege os seres vivos na Terra. |
|||
==Formação do ozônio na estratosfera== |
|||
==Rarefação da camada de ozônio== |
|||
Tal como outros sistemas naturais, o ciclo do ozônio é bastante sensível a mudanças externas. O maior problema, sem dúvida, é a emissão dos [[clorofluorcarboneto]]s (CFCs) na atmosfera. O elemento responsável pelo desequilíbrio deste sistema é o cloro, em sua forma atômica. Este age como [[catalisador]] da reação de desintegração do ozônio, sendo representado pelas seguintes equações químicas: |
|||
* Cl<sub>(g)</sub> + O<sub>3(g)</sub> → ClO<sub>(g)</sub> + O<sub>2(g)</sub> |
|||
* ClO<sub>(g)</sub> + O<sub>3(g)</sub> → Cl<sub>(g)</sub> + 2 O<sub>2(g)</sub> |
|||
Reação global: |
|||
| ⚫ | |||
===Papel no aquecimento global=== |
|||
A eficiência do cloro como catalisador é bastante elevada, chegando a quebrar 100.000 moléculas de ozônio em um ano. |
|||
Como o bom ozônio (da estratosfera) absorve grande quantidade de radiação solar no ciclo ozônio-oxigênio, a sua degradação pode intensificar o efeito estufa em muito. Por isso o CFC é considerado um [[gás de efeito estufa]] (GEE), mesmo que sua ação seja indireta. O [[Global Warming Factor]] (GWF) dos CFCs é 5000 a 14000 [http://www.seed.slb.com/en/scictr/watch/climate_change/gases.htm], o que significa que é de 5000 a 14000 vezes mais eficiente que o CO<sub>2</sub> na intensificação do efeito estufa. Porém, não há grande preocupação na comunidade científica internacional quanto a estes compostos, devido a dois fatores: a concentração deles na atmosfera é menor que 1 ppb [http://www.seed.slb.com/en/scictr/watch/climate_change/gases.htm], e, com o [[Protocolo de Montreal]], sua produção e utilização estão sendo diminuídas a valores muito baixos. |
|||
=={{Ver também}}== |
|||
* [[Ozonosfera]] |
|||
* [[Protocolo de Montreal]] |
|||
* [[Ozônio]] |
|||
==Ligações externas== |
==Ligações externas== |
||
Revisão das 03h41min de 21 de setembro de 2007
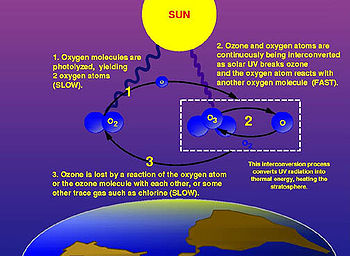
Ciclo ozônio-oxigênio, mais conhecido como ciclo do ozônio, é o nome dado ao processo de interconversibilidade entre o ozônio e o oxigênio, o qual ocorre na estratosfera. Este ciclo é responsável pela absorção da maior parte da radiação ultravioleta solar, que pode causar sérios problemas aos seres vivos, como mutações gênicas ou câncer. O ciclo ozônio-oxigênio pode ser resumido pela equação química:
- O3 ⇌ O2 + [O]
Na reação direta, o ozônio absorve grande quantidade de radiação ultravioleta, e, na reação inversa, há pequeno desprendimento de energia térmica. Este equilíbrio químico é responsável pela filtração desta radiação.
Formação do ozônio na estratosfera
Rarefação da camada de ozônio
Tal como outros sistemas naturais, o ciclo do ozônio é bastante sensível a mudanças externas. O maior problema, sem dúvida, é a emissão dos clorofluorcarbonetos (CFCs) na atmosfera. O elemento responsável pelo desequilíbrio deste sistema é o cloro, em sua forma atômica. Este age como catalisador da reação de desintegração do ozônio, sendo representado pelas seguintes equações químicas:
- Cl(g) + O3(g) → ClO(g) + O2(g)
- ClO(g) + O3(g) → Cl(g) + 2 O2(g)
Reação global:
- 2 O3(g) → 3 O2(g)
Papel no aquecimento global
A eficiência do cloro como catalisador é bastante elevada, chegando a quebrar 100.000 moléculas de ozônio em um ano. Como o bom ozônio (da estratosfera) absorve grande quantidade de radiação solar no ciclo ozônio-oxigênio, a sua degradação pode intensificar o efeito estufa em muito. Por isso o CFC é considerado um gás de efeito estufa (GEE), mesmo que sua ação seja indireta. O Global Warming Factor (GWF) dos CFCs é 5000 a 14000 [1], o que significa que é de 5000 a 14000 vezes mais eficiente que o CO2 na intensificação do efeito estufa. Porém, não há grande preocupação na comunidade científica internacional quanto a estes compostos, devido a dois fatores: a concentração deles na atmosfera é menor que 1 ppb [2], e, com o Protocolo de Montreal, sua produção e utilização estão sendo diminuídas a valores muito baixos.
Ver também
Ligações externas
- Ozonosfera (em inglês)
