Arino
Esta página ou se(c)ção precisa ser formatada para o padrão wiki. (Janeiro de 2016) |
Informações Gerais[editar | editar código-fonte]
Um dos intermediários reativos que podem ser inseridos na classe dos Arinos é o Benzino.
O benzino é uma espécie reativa não isolável facilmente, com a estrutura planar hexagonal contendo seis elétrons π deslocalizados e 2 elétrons π adicionais. A adição de dois elétrons π não afeta o caráter aromático do anel , uma vez que não interferem no número de Huckel. Possui estrutura de um anel de seis membros contendo ligação tripla C-C e é esta ligação tripla que confere alta reatividade para a espécie. O benzino foi detectado e capturado de várias maneiras , mas nunca foi isolado como substância pura.[1]
Embora o benzino seja representado usualmente como um cicloalquino, a vibração de deformação axial da ligação tripla aparece no IV em 1846 cm-1, um valor intermediário entre o da ligação dupla (ciclo hexeno, 1652 cm-1) e o da ligação tripla (3-hexino, 2207 cm-1). Os valores de 13C-RMN destes carbonos (δ= 182,7 ppm) também não são típicos de ligações triplas puras, o que indica a contribuição considerável de uma forma de ressonância relacionada a um trieno cumulado (Figura 1).
-
Figura 1. Estruturas de ressonância do benzino
A ligação é substancialmente enfraquecida pelo pequeno entrosamento dos orbitais p no plano do anel. O diagrama de orbitais moleculares abaixo (Figura 2) mostra que os seis elétrons aromáticos π estão localizados em orbitais perpendiculares aos dois orbitais híbridos adicionais que, por sua vez, formam uma ligação tripla distorcida. Estes orbitais híbridos se superpõem fracamente e por isso o benzino é muito reativo. [2]
-
Figura 2. Diagrama de orbitais moleculares do benzino
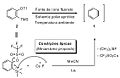
O benzino apresenta grande importância como intermediário altamente reativo em química orgânica, com aplicações que permeiam sínteses totais e preparações de materiais funcionais, desta forma, uma gama de métodos empregados na sua formação encontram-se à disposição na literatura. No entanto, vale destacar que os métodos tradicionais para geração de arinos, embora em posição de destaque no contexto da química de benzino, inviabilizavam muitas das aplicações de tais espécies reativas no universo da química orgânica, devido às condições reacionais drásticas utilizadas , incluindo altas temperaturas , reagentes extremamente básicos ou fortemente oxidantes.[3][4][5][6][7][8] Em virtude do cenário reacional complexo, Kobayashi e colaboradores publicaram no início da década de 80, uma rota sintética para a obtenção de 2-(trimetilsilil) fenil triflato, que foi utilizado na formação de benzino sob condições reacionais brandas, que envolvem o uso de uma fonte de íons fluoreto, um solvente polar aprótico e temperaturas próximas da temperatura ambiente[9], conforme ilustrado na Figura 3.
-
Figura 3. Formação de benzino a partir de 2-(trimetilsilil)-fenil triflato
Embora o emprego das condições brandas apresentadas na Figura 3 possa ser considerado um enorme avanço para a química de benzino, tal metodologia permaneceu pouco utilizada até o final do século X X , quando Guitián e colaboradores empregara m 2 - (trimetilsilil) fenil triflato na preparação de benzo[a] pireno. [10] Os arinos apresentam caráter altamente eletrofílico, resultado de seus LUMOs de baixa energia, e por isso, até mesmo nucleófilos de baixa nucleofilicidade atacam facilmente benzino e seus derivados produzindo espécies zwiteriônicas, que atuam como intermediários chaves nas reações de inserção em ligações sigma[11][12] conforme mostrado na Figura 4.
-
Figura 4. Mecanismo proposto para a inserção de arinos a ligações sigma
A decomposição térmica de sal 1-diazoniobenzeno-2-carboxilato (Figura 5) é um exemplo de geração de arinos via espécies zwiteriônicas. A oxidação com tetraacetato de chumbo de 1-aminobenzotriazole enquadra-se nas estratégias de fragmentação de sistemas cíclicos para formação de arinos.
-
Figura 5. Geração de arinos via espécies zwiteriônicas
Síntese do Benzino[editar | editar código-fonte]
As rotas mais utilizadas para síntese do benzino são mostradas abaixo.
1. Tratamento de halobenzenos com íon amideto
- Não é SN2
- Não é adição-eliminação (não tem grupo ânion estabilizador)
- Só ocorre com nucleófilos muito básicos
2. Decomposição térmica e fotólise
3. Reação do fenil lítio
4. Tratamento de lítio com dihalobenzeno
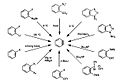
O esquema abaixo (Figura 6) mostra uma visão geral de algumas rotas de síntese do benzino.[13]
-
Figura 6. Rotas de síntese para o benzino
Os intermediários de benzino podem ser "capturados" através do uso das reações de Diels-Alder. Um método conveniente para a geração do benzino é a diazotização do ácido antranílico (ácido 2-aminobenzóico), seguida pela eliminação de CO e N2.
Reações do Benzino[14][editar | editar código-fonte]
1. Benzino como eletrófilo: reação de adição
2. Reação de adição 1,4
3. Reações Polares: Benzino como nucleófilo e eletrófilo
4. Regioquímica de adição nucleofílica no benzino
A regioquímica da adição nucleofílica é influenciada pelos substituintes do anel. Grupos eletro atrativos (EWG) favorecem a adição de nucleófilos em posições mais distantes da ligação tripla, pois permitem a máxima estabilização da carga negativa. Por outro lado, grupos eletro doadores (EDG) apresentam o efeito contrário. Estes efeitos são, provavelmente, oriundos da interação entre o substituinte e o par de elétrons localizado no carbono orto.[15]
Mecanismos de reação para o Benzino[editar | editar código-fonte]
- Substituição Nucleofílica em Aromáticos
Os haletos de arila, tais como o clorobenzeno e o bromobenzeno não reagem com a maioria dos nucleófilos sob circunstâncias normais, eles reagem sob condições muito coercitivas. O seguinte mecanismo (eliminação/adição) foi sugerido para explicar a reação (fácil) de bases fortes (NaNH2 / NH3; carbânions) com halobenzenos (compostos não ativados para SNAr).[16]
A reação começa com a remoção do próton orto ao grupo de saída. O bromo remove densidade eletrônica, esta estabilização é fraca e isso só ocorre com bases fortes.
Ocorre então a perda de brometo, numa reação de eliminação. Intermediário: benzino (eletrofílico). Ligação interna muito fraca, o benzino é muito instável.
- Mecanismo intramolecular
Evidencias que comprovam o mecanismo proposto A primeira peça da evidência clara foi uma experiência feita pelo J. D. Roberts , em1953 - a que marcou o início da química do benzino. Roberts mostrou que quando o bromobenzeno marcado por 14C (C*) é tratado com íon amideto na amônia líquida, a anilina que é formada contém uma marca, igualmente dividida entre as posições 1 e 2. Este resultado é consistente com o seguinte mecanismo de eliminação-adição mas, naturalmente, não é nem um pouco consistente com uma substituição direta ou com um mecanismo de adição-eliminação.[17]
Outra evidencia que comprova o mecanismo proposto é a ocorrência de substituição na posição orto e não para.
Rearranjo no Benzino[18][editar | editar código-fonte]
Um dos rearranjos que ocorrem no benzino pode ser observado na conversão de m-Bromoanisol a m-Anisidina
- ↑ «Juilee. A Kulkarni and Kalyani. D. Asgaonkar. Study of Various Reaction Intermediates. International Journal of Research in Pharmaceutical and Biomedical Sciences. Vol. 3 (1) Jan – Mar 2012»
- ↑ VOLLHARDT, K PETER C. Química Orgânica - Estrutura e Função - 6ª Ed. 2013. [S.l.: s.n.]
- ↑ «Pellissier, H.; Santelli, M.; Tetrahedron 2003, 59, 701; Hart, H. Em The Chemistry of Triple-Bonded Functional Groups , Supplement C2; Patai, S., ed.; Wiley: Chichester, 1994, cap. 18; Gilchrist, T. L. Em The Chem-istry of Functional Groups, Supplement C; Patai, S.; Rappoport, Z., eds.; Wiley: Chichester, 1983, cap. 11; Hoffmann, R. W.; Dehydrobenzene and Cycloalkynes, Academic Press: New York, 1967.»
- ↑ «Logullo, F. M.; Seitz, A. H.; Friedman, L.; Organic Synthesis, Coll. Vol. 5, Willey: New York, 1973, p. 54; Stiles, M.; Miller, R. G.; Burckhardt, U.; J. Am. Chem. Soc. 1963, 85, 1792.»
- ↑ «Fieser, L. F.; Haddadin, M. J.; Organic Synthesis, Coll. Vol. 5 , Willey: New York, 1973, p. 1037; Le Goff, E.; J. Am. Chem. Soc. 1962, 84, 3786»
- ↑ «Wittig, G.; Organic Synthesis, Coll. Vol. 4 , Willey: New York, 1963, p. 964; Wittig, G.; Erhard, K.; Chem. Ber. 1958, 91, 895.»
- ↑ «Lin, W.; Chen, L.; Knochel, P.; Tetrahedron 2007, 63, 2787; Lin, W.; Ilgen, F.; Knochel, P.; Tetrahedron Lett. 2006, 47, 1941.»
- ↑ «Campbell, C. D.; Rees, C. W.; J. Chem. Soc. (C), 1969, 752.; Campbell, C. D.; Rees, C. W.; J. Chem. Soc. (C), 1969, 748; Campbell, C. D.; Rees, C. W.; J. Chem. Soc. (C), 1969, 742.»
- ↑ «Himeshima, Y.; Sonoda, T.; Kobayashi, H.; Chem. Lett. 1983, 1211.»
- ↑ «Cobas, A.; Guitián, E.; Castedo, L.; J. Org. Chem. 1997, 62, 4896.»
- ↑ «Yoshida, H.; Shirakawa, E.; Honda, Y.; Hiyama, T.; Angew. Chem., Int. Ed. 2002, 41, 3247»
- ↑ «Yo s h i d a , H . ; F u k u s h i m a , H . ; M o r i s h i t a , T. ; O h s h i t a , J . ; Ku n a i , A . ; Tetrahedron 2007, 63, 4793; Yoshida, H.; Fukushima, H.; Ohshima, J.; Kunai, A.; Angew. Chem., Int. Ed. 2004, 43, 3935; Yoshida, H.; Fuku-shima, H.; Ohshita, J.; Kunai, A.; Tetrahedron Lett. 2004, 45, 8659.»
- ↑ «Iodonium Triflate: T. Kitamura, M. Yamane, J. Chem. Soc., Chem. Commun. 1995, 983. Silyl Triflate: Y. Himeshima, T. Sonoda, H. Kobayashi, Chem. Lett.
1983, 1211. Benztriazole: C. D. Campbell, C. W. Rees, J. Chem. Soc. (C) 1969, 742. Halo Triflate: T. Matsumoto, T. Hosoya, M. Katsuki, K. Suzuki, Tet. Lett. 1991, 32, 6735. Diazonium Carboxylate: L. Friedman, F. M. Logullo, J. Am. Chem. Soc. 1963, 85, 1792. Fluoro Magnesium and Fluoro Lithium: R. W.
Hoffmann, Dehydrobenzene and Cycloalkanes, Academic Press, New York, 1967. Benzothiadiazol-1,1-dioxide: G. Wittig, R. W. Hoffmann, Org. Synth., Coll. Vol. V, 60, 1971.» line feed character character in
|titulo=at position 152 (ajuda) - ↑ «Moreira, D. Química Orgânica. Aula 7. Centro de Estudos Farmacêuticos»
- ↑ Carey, Francis A.. Organic Chemistry, 8th Edition. [S.l.: s.n.]
- ↑ «Raj K. Bansal, Synthetic approaches in organic chemistry, benzynes and related intermediates Jones and Bartlett publecatioers, barbhouse 1998, 31-36.»
- ↑ «Sachin Kumar Ghosh, General organic chemistry, A modern approach, fundamentals of organic reaction mechanism, new Alipore college New central book agency, May 1994, 384-403»
- ↑ «Jerry March, Advanced organic chemistry Reactions, mechanisms and structures, carbonations carbanions free radicals carbenes and nitrenes, (4th edition) John Wiley and sons, New Jersey, 165-204, 217-218.»