Desenvolvimento do sistema endócrino humano
O artigo a seguir discorre sobre o desenvolvimento de alguns dos órgãos mais importantes do sistema endócrino humano durante a fase embrionária.
Pâncreas
[editar | editar código-fonte]A parte endócrina do pâncreas representa 2% do seu tecido e está organizada em aglomerados de células chamadas ilhotas de Langerhans. As diferentes células que produzem hormônios no pâncreas são as chamadas α, β, δ, ε e PP que produzem, respectivamente, glucagon, insulina, somatostatina, grelina e polipeptídeo pancreático. O desenvolvimento pancreático é um processo altamente regulado que controla a especialização e diferenciação das células progenitoras. Participam dessa regulação diversas rotas de sinalização e cascadas de fatores de transcrição [1].
As células pancreáticas serão originadas a partir de células endodérmicas definitivas (CED), influenciados pela expressão dos fatores de transcrição Foxa1 e Foxa2, sendo que tais fatores também participam do desenvolvimento de células de órgãos gastroinstestinais [2]. Ainda durante a gastrulação, há a formação – através das CED – de partes distintas da endoderme que dará origem ao intestino. A junção da parte média e anterior do endoderma intestinal produz fatores de transcrição Pdx1 e Ptf1α que são essenciais na formação do pâncreas. Células responsivas ao Pdx1 contribuem para formação das partes endócrina e exócrina do pâncreas, enquanto aquelas que respondem ao Ptf1α geram derivativos da glândula [3][4][5][6]. Em seguida, há o desenvolvimento dessa endoderme nos brotos ventral e dorsal do pâncreas, em contato com tecidos originados da mesoderme, como a notocorda, fundamental para a regulação da organogênese da glândula [7].
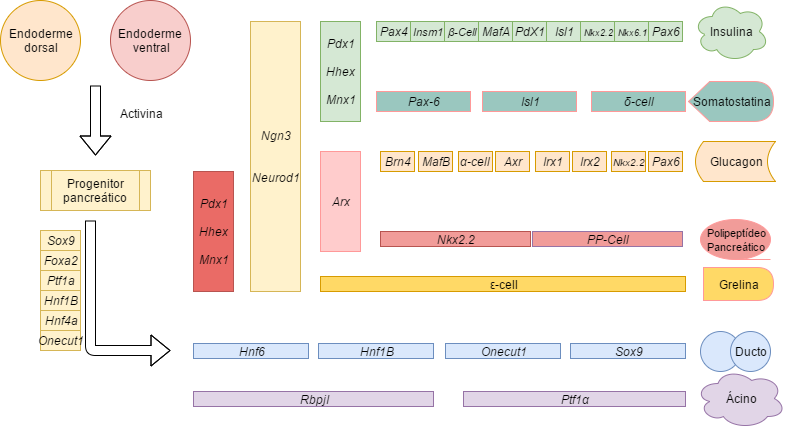
As células que formam os brotos são multipotentes que darão origem a todos os tipos celulares do pâncreas. Primeiramente, há um período de proliferação ativa das células progenitoras, seguida pela expansão da rede epitelial que resulta na diferenciação do órgão, período que também coincide com a primeira detecção de células endócrinas [8]. Ainda na primeira transição há rotação da região visceral, aproximando os brotos e permitindo sua fusão alguns dias depois. Por fim, ocorre a compartimentalização em dois domínios – um predominantemente de células do ácino e outro com o duto e células endócrinas, esse segundo domínio determinado pela expressão de Pdx1, Ptf1a, Cpa1 e C-myc. A transição secundária, que ocorre alguns dias depois, é morfogênese do epitélio pancreático, caracterizado pela especificação de células multipotentes em diferentes linhagens, controlada pela ativação de diferentes genes em associação com distintos fatores de transcrição (Figura 1). A especificação seguida pela diferenciação das células endócrinas ocorre com influência importante através da inibição da via de sinalização Notch, levando à expressão do gene pró-endócrino no fator de transcrição Ngn3. A expressão do fator no epitélio pancreático gera a expressão de diversos outros fatores como Nkx2.2, Neurod1, Nkx6.1, Pax4, Pax6, and Isl1, que controlam a diferenciação de células endócrinas, promovendo a diferenciação de células endócrinas. Por fim, a morfogênese das ilhotas começam através da coalescência em pequenos grupos de células agregadas[9] [10][11]
Em resumo, o desenvolvimento pancreático começa na quarta semana de gestação, chegando à produção de insulina, glucagon, somatostatina e polipeptídeo pancreático entre a 7ª e 8ª semanas [12]. Os níveis de glucagon são mais facilmente identificáveis no plasma fetal, a partir da 15ª semana, enquanto a insulina tem níveis pouco variáveis durante toda a gestação[13]. As ilhotas estão diferenciadas na 31ª semana, contudo a arquitetura final é formada apenas após o nascimento [14]
Glândula suprarrenal
[editar | editar código-fonte]A glândula suprarrenal ou adrenal tem origem mista, com o córtex originado da mesoderme celômica da crista urogenital e a medula originada da crista neural [15]. Por volta da 5ª semana de gestação, ocorre proliferação de células mesoteliais entre a raiz do mesentério e a crista urogenital, formando o córtex primitivo ou fetal da suprarrenal. Em seguida, na 6ª semana, uma nova camada de células mesoteliais envolve o córtex primitivo, formando mais tarde o córtex adulto ou definitivo. Após 8 semanas, o córtex separa-se do tecido mesotelial e é envolvido por tecido conectivo, [15] [16]. A medula surge de um gânglio simpático associado à crista neural, na altura do plexo celíaco. Algumas células desse complexo – chamadas células cromafim – migram da região em direção ao córtex da medula por volta da 7ª semana[15] [16]. Ao longo do tempo, as células atingem gradualmente uma posição central dentro do tecido cortical. Durante o restante da gestação, as adrenais encapsulam e posicionam-se acima dos rins, formando a distinção entre os órgãos [17]. Contudo, a exemplo do pâncreas, essas glândulas terminam seu desenvolvimento apenas no período pós-natal, no caso por volta dos três anos de idade da criança, com a divisão do córtex em três zonas – glomerosa, fasciculata (presentes no nascimento) e reticularis (completadas nessa idade).
Tireoide
[editar | editar código-fonte]A glândula tireoide é a primeira a começar o seu desenvolvimento no embrião, no meio da 3ª semana após a fecundação. A sua origem dá-se a partir de duas estruturas: a faringe primitiva, cujo espessamento das paredes leva a formação da tireoide média (e, em consequência dos grânulos da glândula) e da crista neural, de onde desenvolve a tireoide lateral rudimentar [18]. À medida que o embrião desenvolve-se, a glândula segue uma direção a uma parte anterior à laringe, onde durante certo momento desenvolve uma ligação com a língua através do ducto tireoglosso (este degenera algumas semanas depois). Após, a estrutura originada da faringe primitiva divide-se em dois lobos, um esquerdo e um direito, ligados entre si através do istmo da tireoide, terminando na 7ª semana com a tireoide com forma e posição definidas. Por volta da 11ª semana, já há detecção de atividade da glândula, sendo capaz de estocar iodina e produzir hormônios, principalmente o T4 durante o desenvolvimento do feto [18], [19]. A função da tireoide já é importante no metabolismo do feto, inclusive com mecanismos de feedback já desenvolvidos na produção dos seus hormônios. Problemas no desenvolvimento da tireoide na gestação podem causar condições graves no desenvolvimento, como o cretinismo resultante de deficiência no acúmulo de iodina[20].
Paratireoide
[editar | editar código-fonte]As glândulas paratireoides (PT) são originadas da terceira e quarta bolsa faríngea, sendo detectadas entre 5 e 6 semanas de gestação. A terceira bolsa faríngea dá origem às PT inferiores e ao timo, enquanto a quarta origina as PT superiores e as células parafoliculares da tireoide[21][22]. A atividade da glândula pode ser detectada a partir do segundo trimestre da gestação[23].
Pituitária
[editar | editar código-fonte]A hipófise ou pituitária é uma glândula formada a partir da ectoderme anterior e da neuroectoderme que realiza a coordenação de todas as glândulas do corpo, porém, dependente ao hipotálamo. A mesma é dividida em duas partes – a adenoipófise e a neuroipófise, formadas a partir de diferentes estruturas e que tem anatomia e atividades fisiológicas distintas [24].
Durante o desenvolvimento, a borda da ectoderme epitelial acima da faringe, denominada estomodeu (ou primórdio bucal), forma uma evaginação denominada de bolsa de Rathke, nomeada em homenagem ao embriologista e anatomista alemão Martin Heinrich Rathke (1793-1860). Com cerca de quatro semanas, essa estrutura projeta-se em direção ao diencéfalo, tornando-se adjacente a ele. Na semana seguinte, o alongamento da bolsa de Rathke vai causando uma constrição na sua ligação com a cavidade bucal, que é finalizada em uma degeneração da mesma ligação coincidentemente com o contato da bolsa com o infundíbulo, uma invaginação do diencéfalo que faz a conexão com o hipotálamo [24][25]. Após essa conexão, há formação de três estruturas distintas relacionadas à glândula: a parte distal, originada da proliferação de células da parte distal do divertículo hipofisário; a parte tuberal, que cresce em volta do infundíbulo; e a parte intermediária, formada por células da parte posterior da bolsa de Rathke que não se proliferam [24][26].
Por volta da 16ª semana, toda a estrutura da adenoipófise está diferenciada, sendo que algumas semanas antes já era possível identificar a presença de alguns hormônios com o ACTH e o GH, esse atingindo um pico entre as semanas 20 e 24 da gestação. A neuroipófise é o próprio infundíbulo, não tendo a função de produzir hormônios, mas sim armazenar os hormônios ocitocina e vasopressina, produzidos no hipotálamo [27]. Alguns artigos recentes [28][29] apontam a influência de alguns fatores de transcrição no desenvolvimento da glândula. Entre eles estão a Pit1, responsável pelo desenvolvimento do órgão e expressão de hormônios, PitX1 e PitX2, expressados no primórdio da pituitária, TPIT, um fator de transcrição T-box da glândula e o VEGF, relacionado ao desenvolvimento de células vasculares endoteliais.
Gônadas
[editar | editar código-fonte]O desenvolvimento do sistema reprodutivo começa com quatro a cinco semanas de gestação quando com a migração das células germinativas. A gônada nesse ponto é bipotencial e tem origem na região medioventral da crista urogenital. Ao final da 5ª semana, há separação das gônadas com o sistema imune e a diferenciação sexual acontece após mais de 40 dias de gestação[30].
Desenvolvimento das gônadas femininas
[editar | editar código-fonte]Para os indivíduos do sexo feminino, a ausência da testosterona resulta na diminuição das estruturas de Wolff, ao passo que as estruturas müllerianas permanecem e desenvolvem-se nas trompas de falópio, região superior da vagina e no útero. O seio urogenital se desenvolve na uretra na região inferior da vagina, o tubérculo genital desenvolve-se no clitóris, as dobras urogenitais nos lábios menores e, por fim, as dobras genitais desenvolvem-se nos lábios maiores. Com 16 semanas de gestação os ovários produzem seus receptores para FSH e LH. Com 20 semanas de gestação, os precursores da teca estão presentes e as mitoses das oogônias estão ocorrendo. Com 25 semanas, os ovários estão morfologicamente definidos e a foliculogênese tem condições de começar[31].
Além da influência da testosterona, estudos sobre expressão gênica mostram que há o complemente da atividade de genes específicos que expressam, por exemplo, folistatina e inibidores de ciclinas quinases envolvidos com o desenvolvimento ovariano[31]. Alguns genes e peptídeos foram identificados – como WNT4, RSPO1, FOXL2[32][33][34] e diversos receptores de estrógenos – como responsáveis por prevenir o desenvolvimento de testículos ou outras células da linhagem masculina[35].
Desenvolvimento das gônadas masculinas
[editar | editar código-fonte]No caso do sexo masculino, os testículos formam-se com seis semanas do desenvolvimento fetal e as células de Sertori iniciam o desenvolvimento por volta da 8ª semana. SRY, o lócus de determinação sexual, é responsável pela diferenciação das células de Sertori. Tais células são a origem do hormônio antimülleriano. Uma vez sintetizado, o hormônio antimülleriano inicia a regressão ipsilateral do trato mülleriano e inibe o desenvolvimento de estruturas internas femininas. Com 10 semanas de gestação, as células de Leydig começam a produzir hormônios andrógenos. O hormônio dihidrotestosterona (DHT) é o responsável pelo desenvolvimento externo da genitália masculina[36].
Os testículos descendem durante o período pré-natal em um processo com duas etapas que começa no período de oito semanas de gestação e continua até o meio do terceiro semestre. Durante o estágio transabdominal, de 8 a 15 semanas de gestação, o ligamento gubernacular contrai-se e começa a se espessar. Esse estágio é regulado pela excreção da insulin-like 3 (INSL3), fator com ação de relaxina produzido pelos testículos, e o receptor LGR8. Durante a terceira fase, chamada transinguinal (25 a 35 semanas de gestação), os testículos descem até o escroto. Esse estágio é regulado por andrógenos, pelo nervo genitofemoral e peptídeos relacionados às calcitoninas. Durante o segundo e terceiro trimestres, o desenvolvimento testicular encerra-se com a contração das células Leydig fetais e o alongamento e enrolamento dos tubos seminíferos, estruturas responsáveis pela produção de espermatozoides [37].
Referências
- ↑ Shapiro AM, Lakey JR, Ryan EA, Korbutt GS, Toth E, Warnock GL, et al. Islet transplantation in seven patients with type 1 diabetes mellitus using a glucocorticoid-free immunosuppressive regimen. N Engl J Med 2000; 343: 230-238
- ↑ Cowan PJ, Robson SC, d'Apice AJ. Controlling coagulation dysregulation in xenotransplantation. Curr Opin Organ Transplant 2011; 16: 214-221, doi: 10.1097/MOT.0b013e3283446c65
- ↑ Ekser B, Ezzelarab M, Hara H, van der Windt DJ, Wijkstrom M, Bottino R, et al. Clinical xenotransplantation: the next medical revolution? Lancet 2012; 379: 672-683, doi: 10.1016/S0140-6736(11)61091-X
- ↑ Guney MA, Gannon M. Pancreas cell fate. Birth Defects Res C Embryo Today 2009; 87: 232-248, doi: 10.1002/bdrc.v87:3
- ↑ Shimosato D, Shiki M, Niwa H. Extra-embryonic endoderm cells derived from ES cells induced by GATA factors acquire the character of XEN cells. BMC Dev Biol 2007; 7: 80, doi: 10.1186/1471-213X-7-80
- ↑ Jonsson J, Carlsson L, Edlund T, Edlund H. Insulin-promoter-factor 1 is required for pancreas development in mice. Nature 1994; 371: 606-609, doi: 10.1038/371606a0
- ↑ Pictet RL, Clark WR, Williams RH, Rutter WJ. An ultrastructural analysis of the developing embryonic pancreas. Dev Biol 1972; 29: 436-467, doi: 10.1016/0012-1606(72)90083-8
- ↑ Herrera PL. Adult insulin- and glucagon-producing cells differentiate from two independent cell lineages. Development 2000; 127: 2317-2322. [ Links ]
- ↑ Gradwohl G, Dierich A, LeMeur M, Guillemot F. neurogenin3 is required for the development of the four endocrine cell lineages of the pancreas. Proc Natl Acad Sci U S A 2000; 97: 1607-1611, doi: 10.1073/pnas.97.4.1607. [ Links ]
- ↑ Schwitzgebel VM, Scheel DW, Conners JR, Kalamaras J, Lee JE, Anderson DJ, et al. Expression of neurogenin3 reveals an islet cell precursor population in the pancreas. Development 2000; 127: 3533-3542. [ Links ]
- ↑ Wilson ME, Scheel D, German MS. Gene expression cascades in pancreatic development. Mech Dev 2003; 120: 65-80, doi: 10.1016/S0925-4773(02)00333-7.
- ↑ Edlund, H. (July 2012). "Pancreatic organogenesis--developmental mechanisms and implications for therapy". Nat Rev Genet. 3 (7): 524–32. doi:10.1038/nrg841. PMID 12094230.
- ↑ https://embryology.med.unsw.edu.au/embryology/index.php/Endocrine_-_Pancreas_Development
- ↑ Sperling, M. A.; Tulchinsky, D.; Little, A. B. (1994-05-24). "Carbohydrate metabolism: insulin and glucagons". Maternal-Fetal Endocrinology (2nd ed.). Saunders. pp. 380–400. ISBN 0721642322.
- ↑ a b c Mitty HA. Embryology, anatomy and abnormalities of the adrenal gland. Semin Roentgenol 1988;23:271—9.
- ↑ a b Barwick, T.D. et al. Embryology of the adrenal glands and its relevance to diagnostic imaging. Clinical Radiology , Volume 60 , Issue 9 , 953 – 959
- ↑ Pescovitz,Ora H.; Eugster, Erica A. (2004). Pediatric Endocrinology: Mechanisms, Manifestations, and Management (1st ed.). Lippincott Williams & Wilkins. p. 549. ISBN 978-0781740593.
- ↑ a b Yoshitaka Takanashi, Yohei Honkura, Jose Francisco Rodriguez-Vazquez, Gen Murakami, Tetsuaki Kawase, Yukio Katori Pyramidal lobe of the thyroid gland and the thyroglossal duct remnant: A study using human fetal sections. Ann. Anat.: 2014; PubMed 25458181
- ↑ M P Postiglione, R Parlato, A Rodriguez-Mallon, A Rosica, P Mithbaokar, M Maresca, R C Marians, T F Davies, M S Zannini, M De Felice, R Di Lauro Role of the thyroid-stimulating hormone receptor signaling in development and differentiation of the thyroid gland. Proc. Natl. Acad. Sci. U.S.A.: 2002, 99(24);15462-7 PubMed 12432093
- ↑ Annette Grüters, Heike Biebermann, Heiko Krude Neonatal thyroid disorders. Horm. Res.: 2003, 59 Suppl 1;24-9 PubMed 12566717
- ↑ Gardner, David G.; Shoback, Dolores (2011). Greenspan's Basic & Clinical Endocrinology (9th ed.). New York: McGraw Hill. p. 811. ISBN 978-0-07-162243-1.
- ↑ Fisher, Delbert A.; Brown, Rosalind S. (2012). "The maturation of thyroid function in the perinatal period and during childhood". Werner and Ingbar's The Thyroid: A Fundamental and Clinical Text (10 ed.). Philadelphia, PA: Lippincott Williams & Wilkins. pp. 775–786. ISBN 978-1451120639.
- ↑ S.D. Safford, M.A. Skinner. Thyroid and parathyroid disease in children. Semin Pediatr Surg, 15 (2006), pp. 85–91
- ↑ a b c Giuseppe Musumeci, Sergio Castorina, Paola Castrogiovanni, Carla Loreto, Rosi Leonardi, Flavia Concetta Aiello, Gaetano Magro, Rosa Imbesi A journey through the pituitary gland: Development, structure and function, with emphasis on embryo-foetal and later development. Acta Histochem.: 2015; PubMed 25858531
- ↑ H Z Sheng, H Westphal Early steps in pituitary organogenesis. Trends Genet.: 1999, 15(6);236-40 PubMed 10354584
- ↑ Gleiberman, AS; Fedtsova NG; Rosenfeld MG (15 September 1999). "Tissue interactions in the induction of anterior pituitary: role of the ventral diencephalon, mes- enchyme, and notochord". Dev Biol. 213 (2): 340–353. doi:10.1006/dbio.1999.9386. PMID 10479452.
- ↑ Moore, Keith L. Embriologia Clínica/ Keith L. Moore, T,V.N.Persaud, com a colaboração de Mark G. Torchia; [ tradução Andrea Monte Alta Costa... Et al.].- Rio de Janeiro: Elsevier, 2008.
- ↑ Kathleen M Scully, Michael G Rosenfeld Pituitary development: regulatory codes in mammalian organogenesis. Science: 2002, 295(5563);2231-5 PubMed 11910101
- ↑ C Kioussi, S O'Connell, L St-Onge, M Treier, A S Gleiberman, P Gruss, M G Rosenfeld Pax6 is essential for establishing ventral-dorsal cell boundaries in pituitary gland development. Proc. Natl. Acad. Sci. U.S.A.: 1999, 96(25);14378-82 PubMed 10588713
- ↑ Satoh M (1991). "Histogenesis and organogenesis of the gonad in human embryos.". J Anat. 177: 85–107. PMC 1260417 . PMID 1769902.
- ↑ a b Nef, S; Schaad O; Stallings N; et al. (15 November 2005). "Gene expression during sex determination reveals a robust female genetic program at the onset of ovarian development". Dev Biol. 287 (2): 361–377. doi:10.1016/j.ydbio.2005.09.008. PMID 16214126.
- ↑ Vainio, S; Heikkila M; Kispert A; et al. (4 February 1999). "Female development in mammals is regulated by Wnt-4 signalling". Nature. 397 (6718): 405–409. doi:10.1038/17068. PMID 9989404.
- ↑ Chassot, A; Gregoire EP; Magliano M; et al. (5 November 2008). "Genetics of ovarian differentiation: Rspo1, a major player". Nature. 2 (4-5): 219–227. doi:10.1159/000152038. PMID 18987496.
- ↑ Uhlenhaut, N; Jakob S; Anlag K; et al. (11 December 2009). "Somatic sex reprogramming of adult ovaries to testes by FOXL2 ablation". Cell. 139 (6): 1130–1142. doi:10.1016/j.cell.2009.11.021. PMID 20005806.
- ↑ Beverdam, A; Koopman P. (1 February 2006). "Expression profiling of purified mouse gonadal somatic cells during the critical time window of sex determination reveals novel candidate genes for human sexual dysgenesis syndromes". Hum Mol Genet. 15 (3): 417–431. doi:10.1093/hmg/ddi463. PMID 16399799.
- ↑ Melmed, Shlomo; Polonsky, Kenneth S. (2011). Williams Textbook of Endocrinology (12th ed.). Saunders. p. 869. ISBN 978-1437703245.
- ↑ Bruce M. Carlson. Embriologia Humana e Biologia do Desenvolvimento. Elsevier editora médica (1996). pg 389 ISBN 8535275584