Hibridização: diferenças entre revisões
m Bot: Adicionando: sh:Hibridizacija orbitala |
|||
| Linha 5: | Linha 5: | ||
== Elementos que hibridizam == |
== Elementos que hibridizam == |
||
Os elementos químicos que hibridizam são o [[carbono]], [[silício]], [[enxofre]], (...) . O [[oxigênio]] e o [[nitrogênio]] também hibridizam, porém sem ativação. |
Os elementos químicos que hibridizam são o [[carbono]], [[silício]], [[enxofre]], (...) . O [[oxigênio]] e o [[nitrogênio]] também hibridizam, porém sem ativação. |
||
ecat |
|||
== Formas de hibridação == |
== Formas de hibridação == |
||
Revisão das 21h59min de 16 de abril de 2011
Hibridização, ou hibridação, é o processo de formação de orbitais eletrônicos híbridos. Em alguns átomos, os orbitais dos subníveis atômicos s e p se misturam, dando origem a orbitais híbridos sp, sp² e sp³.
Segundo a teoria das ligações covalentes, uma ligação desse tipo se efetua pela superposição de orbitais semi-preenchidos (com apenas um elétron). A hibridação explica a formação de algumas ligações que seriam impossíveis por aquela teoria, bem como a disposição geométrica de algumas moléculas.
Elementos que hibridizam
Os elementos químicos que hibridizam são o carbono, silício, enxofre, (...) . O oxigênio e o nitrogênio também hibridizam, porém sem ativação. ecat
Formas de hibridação
Hibridação sp3
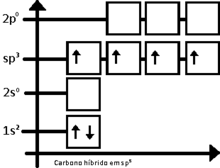
A hibridação sp3 é facilmente explicada pelo carbono. Para o carbono tetraédrico (como no metano, CH4), deve haver quatro ligações simples. O problema é que a distribuição eletrônica do carbono no estado fundamental é 1s2 2s2 2px1 2py1, esquematizando:

(Nota: O orbital 1s tem menos energia que o 2s, que por sua vez tem menos energia que os orbitais 2p)
Dessa forma, o carbono deveria realizar apenas duas ligações, ao que há apenas dois orbitais semipreenchidos. Entretanto, a molécula de metileno (CH2) é extremamente reativo, não estando equilibrado quimicamente. O primeiro passo para se entender o processo de hibridação, é excitar o átomo de carbono em questão, tendo-se:

Então, o carbono equilibra os quatro orbitais, dando origem a orbitais de energia intermediária entre 2s e 2p, dando origem ao orbital sp3 (lido s-p-três), assim chamado por ser o resultado da fusão de um orbital s com três orbitais p. Portanto, tem-se:
Hibridação sp2
Outras formas de hibridação são explicadas de forma semelhante à sp3 do metano. A hibridação sp2 é realizada quando um dos orbitais p não hibrida. Isso acontece em moléculas como a de eteno, na qual há ligação dupla entre carbonos.A fórmula estrutural dessa molécula é algo parecido com a mostrada aqui:
Não são todos os orbitais que hibridam, pois os orbitais híbridos formam apenas ligações σ é necessária para a ligação dupla entre os carbonos. Sua distribuição eletrônica ficará algo como esta abaixo. Temos as ligações tetraédrica, trigonal plana e linear plana respectivamente (109,28)°,120°,180°.




