Reações de substituição α-carbonila
Reações de substituição α-carbonila são reações que envolvem a desprotonação do carbono próximo ao grupo carbonila (posição α) de aldeídos, cetonas e derivados do ácido carboxílico, por uma base e a substituição por um eletrófilo.[1]

Mecanismo[editar | editar código-fonte]
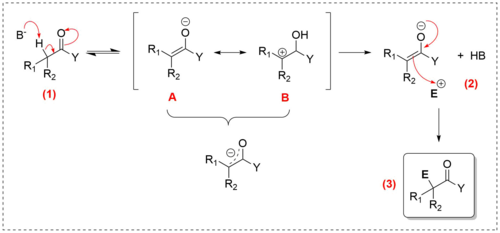
A primeira etapa da reação é a retirada do hidrogênio do de compostos carbonilados por uma base, formando um enolato, que a princípio pode ser reversível. Isso ocorre porque a ligação pode se sobrepor com a ligação na lateral. Logo, a desprotonação do resulta na deslocalização eletrônica no domínio da ligação em relação ao oxigênio, tornando a ligação levemente polar.[2][3] A principal característica do enolato formado é deslocalizada ao longo da fração . Duas estruturas de ressonância, A e B, podem ser escritas para o enolato. Na estrutura A, a carga negativa está no carbono, e na estrutura B a carga negativa está no oxigênio.[4] Na presença de um eletrófilo o enolato reage com este (2), uma vez que o ânion enolato é rico em elétrons e, portanto, é um nucleófilo forte. Logo, quando o enolato reage com um eletrófilo, o eletrófilo é geralmente ligado ao carbono nucleofílico no final da reação (3).[5]

Acidez de átomos de hidrogênio do carbono-α[editar | editar código-fonte]
A desprotonação do só é possível devido ao seu carácter ácido associado a deslocalização da carga negativo ao longo da ligação , estabilizando o carbono. A presença dos grupos metila doadores de elétrons no diminui a acidez, tornando a ligação menos polarizada.[6]
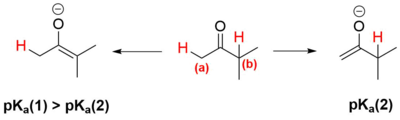
Logo, a desprotonação, por ser uma reação ácido base, ocorre porque o hidrogênio do carbono (b) é menos ácido que o hidrogênio do carbono (a) e, em geral, um átomo de hidrogênio em um carbono substituído é mais ácido que um átomo de hidrogênio em um carbono mais substituído. Isso irá se refletir, portanto, nos valores de : o do composto é maior (desfavorecendo a desprotonação) do que o do composto (desprotonação mais favorecida).
Reações que envolvem o íon inolato[editar | editar código-fonte]
Compostos contendo carbonila, como aldeídos, cetonas e ésteres, sofrem reações de alquilação via formação de íon enolato. Um enolato reage como um nucleófilo, onde tanto o carbono desprotonado como o oxigênio são nucleófilos. No entanto, em reações de alquilação o carbono nucleofílico predomina ao reagir com um haleto de alquila.[7]
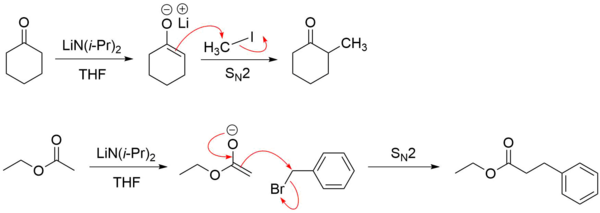
Compostos carbonílicos contendo hidrogênio α também podem sofrer substituição de halogênio na presença de ácido ou base.

Os enolatos podem reagir com muitos eletrófilos que não haletos de alquila. Um exemplo é a abertura de um anel nucleofílico de um epóxido para produzir álcool, ocorrendo no carbono menos estereoquimicamente impedido.[8]

Referências
Bibliografia[editar | editar código-fonte]
- ↑ SUN, X. Organic mechanisms: reactions, methodology, and biological applications. Charleston, USA: Wiley, 1960.ISBN 978-1-118-06564-8
- ↑ SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Organic Chemistry. 11. ed. Charleston, USA: wiley, 2013. ISBN 978-1-118-13357-6
- ↑ SMITH, M. B. Nucleophilic Species That Form Carbon-Carbon Bonds. In: Organic Synthesis. [s.l: s.n.]. p. 659–742. DOI 10.1016/B978-0-12-800720-4.00013-1










