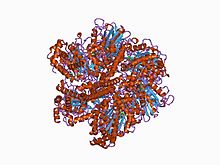
Subunidade gama da ATP sintase
| ATP synthase | |
|---|---|
| Estrutura da F1-ATPase.[1] | |
| Indicadores | |
| Símbolo | ATP-synt |
| Pfam | PF00231 |
| InterPro | IPR000131 |
| PROSITE | PDOC00138 |
| SCOP | 1bmf |
A subunidade gama do complexo F1 da ATP sintase é um polipeptídeo que juntamente com outras subunidades proteicas constituem a ATP sintase, a enzima que fornece energia para o funcionamento das células. Forma o eixo central que liga o motor rotativo Fo ao centro catalítico F1. As F-ATP sintases (também conhecidas como F1Fo-ATPase, ou ATPase de dois setores transportador de H(+)) são compostas por dois complexos ligados: o complexo F1 ATPase é o centro catalítico e é composto por 5 subunidades (alfa, beta, gama, delta, épsilon), enquanto que o complexo Fo ATPase é um canal de protões transmembranar composto pelo menos por 3 subunidades (A-C), nove nas mitocôndrias (A-G, F6, F8).
A subunidade gama da ATP sintase humana está codificada no gene ATP5C1.
Interações moleculares[editar | editar código-fonte]
Tanto os complexos F1 como os Fo são motores rotativos agrupados em pares dispostos em direções opostas. No complexo F, a subunidade gama central forma a parte que roda no interior do cilindro composto pelas unidades alfa(3)beta(3), enquanto que no complexo Fo, as subunidades C, em forma de anel, formam a parte rotativa. Os dois motores rotacionais rodam em sentidos opostos, mas o motor rotativo Fo é geralmente mais potente, usando a força do gradiente de protões para empurrar o rotor F1 ao contrário de modo a conduzir a síntese de ATP.[2] Estas ATPases podem também funcionar de forma inversa de modo a hidrolisar ATP para criar um gradiente de protões.
A subunidade gama do coplexo F1 da ATPase forma o eixo central que liga o rotor Fo ao centro catalítico F1. A subunidade gama funciona como motor rotativo dentro do cilindro formado pelas subunidades alpha(3)beta(3) no complexo F1.[3] Em termos evolutivos, mais bem conservada região da subunidade gama é a extremidade C-terminal, que parece ter um papel importante na montagem das cadeias polipeptídicas e na catálise.[4]
Referências
- ↑ Abrahams JP, Leslie AG, Lutter R, Walker JE (1994). «Structure at 2.8 A resolution of F1-ATPase from bovine heart mitochondria». Nature. 370 (6491): 621–8. PMID 8065448. doi:10.1038/370621a0
- ↑ Itoh H, Yoshida M, Yasuda R, Noji H, Kinosita K (2001). «Resolution of distinct rotational substeps by submillisecond kinetic analysis of F1-ATPase». Nature. 410 (6831): 898–904. PMID 11309608. doi:10.1038/35073513
- ↑ Junge W, Feniouk BA (2005). «Regulation of the F0F1-ATP synthase: the conformation of subunit epsilon might be determined by directionality of subunit gamma rotation». FEBS Lett. 579 (23): 5114–5118. PMID 16154570. doi:10.1016/j.febslet.2005.08.030
- ↑ Miki J., Maeda M., Mukohata Y., Futai M. «ATP synthase gamma subunit signature». PROSITE documentation (em inglês). Consultado em 11 de janeiro de 2014