Subunidades alfa/beta da ATP sintase
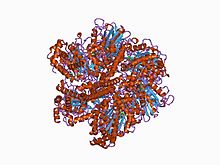
As subunidades alfa e beta (ou A e B) são polipeptídeos que juntamente com outras subunidades proteicas constituem a ATP sintase, a enzima que fornece energia para o funcionamento das células. Organizam-se num hexâmero com três subunidades de cada tipo,[1] formando parte dos complexos F1, V1, e A1 dos seguintes tipos de ATPases: F-ATPases, V-ATPases e A-ATPases, respetivamente. Também entram na constituição da ATPase flagelar e da terminação fator ró.
As F-ATPases (ou F1FO-ATPases), V-ATPases (ou V1VO-ATPases) e A-ATPases (ou A1AO-ATPases) são compostas por dois complexos ligados: os complexos F1, V1 ou A1 contêm o núcleo catalítico que sintetiza/hidroliza ATP, e os complexos FO, VO ou AO que formam o poro que abrange a membrana. As F-ATPases, V-ATPases e A-ATPases contêm motores rotativos, um que conduz a translocação de protões através da membrana e outro que conduz a síntese/hidrólise de ATP.[2][3]
Nas F-ATPases há três cópias de cada uma das subunidades alfa e beta que formam o centro catalítico do complexo F1, enquanto que as restantes subunidades F1 (gama, delta, épsilon) formam os talos. Tanto as subunidades alfa como as subunidades beta contêm um sítio de ligação do substrato, sendo o da subunidade beta catalítico, enquanto que o das subunidades alfa é regulador. As subunidades alfa e beta formam um cilindro ligado ao eixo central. As subunidades alfa//beta passam por uma sequência de transformações na sua conformação que levam à formação de ATP a partir de ADP, que são induzidas pela rotação da subunidade gama, sendo esta conduzida pelo movimento de protões através da subunidade C do complexo FO.[4]
Nas V-ATPases e A-ATPases, as subunidades alfa/A e beta/B dos complexos V1 ou A1 são homólogas das subunidades alfa e beta no complexo F1 das F-ATPases, exceptuando que a subunidade alfa é catalítica e a subunidade beta é reguladora.
As subunidades alfa/A e beta/B podem, cada uma, dividirem-se em três regiões, ou domínios, centrados em volta do sítio ativo de ligação do ATP, definidas pela sua estrutura e função. O domínio central contém os resíduos de ligação dos nucleótidos que fazem contato direto com a molécula de ADP/ATP.[5]
Proteínas humanas que contêm este domínio
[editar | editar código-fonte]ATP5A1; ATP5B; ATP6V1A; ATP6V1B1; ATP6V1B2;
Referências
- ↑ Harvey Lodish, Arnold Berk, Chris A. Kaiser, Monty Krieger, Anthony Bretscher (2012). Molecular Cell Biology / Edition 7. [S.l.]: Freeman, W. H. & Company. pp. 544–549. ISBN 9781429234139
- ↑ Itoh H, Yoshida M, Yasuda R, Noji H, Kinosita K (2001). «Resolution of distinct rotational substeps by submillisecond kinetic analysis of F1-ATPase». Nature. 410 (6831): 898–904. PMID 11309608. doi:10.1038/35073513
- ↑ Wilkens S, Zheng Y, Zhang Z (2005). «A structural model of the vacuolar ATPase from transmission electron microscopy». Micron. 36 (2): 109–126. PMID 15629643. doi:10.1016/j.micron.2004.10.002
- ↑ Amzel LM, Bianchet MA, Leyva JA (2003). «Understanding ATP synthesis: structure and mechanism of the F1-ATPase (Review)». Mol. Membr. Biol. 20 (1): 27–33. PMID 12745923. doi:10.1080/0968768031000066532
- ↑ Chandler D, Wang H, Antes I, Oster G (2003). «The unbinding of ATP from F1-ATPase». Biophys. J. 85 (2): 695–706. PMC 1303195
 . PMID 12885621. doi:10.1016/S0006-3495(03)74513-5
. PMID 12885621. doi:10.1016/S0006-3495(03)74513-5
