Modelo atômico de Rutherford: diferenças entre revisões
bot: revertidas edições de 200.201.3.32 ( modificação suspeita : -182), para a edição 35740662 de Salebot |
|||
| Linha 12: | Linha 12: | ||
==Tamanho do átomo== |
==Tamanho do átomo== |
||
Analisando os resultados de numeros de particulas que passavam ou eram refletidas pela camada de ouro, Rutherford conseguiu inclusive calcular a provável proporção de tamanho entre nucleo e átomo, que segundo ele seria 1/ |
Analisando os resultados de numeros de particulas que passavam ou eram refletidas pela camada de ouro, Rutherford conseguiu inclusive calcular a provável proporção de tamanho entre nucleo e átomo, que segundo ele seria 1/100000000000000000255000000025250000000000000002505000000000000000000000000000000000000000000000000000000000000000000250250520552000000000000000000000000002500000000000000000000000009487603421 a 1/100000. É de costume comparar o tamanho do nucleo do átomo de rutherford em relação ao seu todo, com uma formiga no meio de um campo de futebol, sendo a formiga o núcleo e o campo o tamanho total do átomo. |
||
==Experimento das lâminas== |
==Experimento das lâminas== |
||
Revisão das 19h20min de 14 de maio de 2013
Este artigo não cita fontes confiáveis. (Outubro de 2011) |
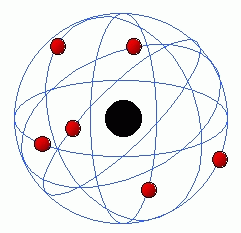

O modelo atômico (português brasileiro) ou modelo atómico (português europeu) de Rutherford (também conhecido como modelo planetário do átomo), é um modelo atômico concebido pelo cientista Ernest Rutherford. Para montar sua teoria, Rutherford analisou resultados de seu experimento que ficou conhecido como "experiência de Rutherford". Nesta experiência, utilizando uma fonte radioativa para emitir particulas alfas, um contador geiger, e uma fina folha de ouro(fina ao ponto de existir rumores de que provavelmente a folha continha apenas 10 mil atomos, ou seja, basicamente uma camada de átomos), ele mediu o numero de partículas alfa que atravessaram esta folha. Porém, ele percebeu que embora muitas das particulas atravessam a folha(como já era previsto pelo modelo átomico em rigor naquela epoca), um número muito pequeno de particulas alfa eram refletidas ou sofriam desvio por esta folha. Com base nisto, Ernest Rutherford montou a sua teoria.
Em 1911, Rutherford apresentou a sua teoria para o seu modelo atômico, afirmou que o modelo vigente até então, também conhecido como "pudim de passas", que foi feito por J. J. Thomson, estava incorreto. Rutherford afirmou com seu experimento, que o átomo não era apenas uma esfera maciça de carga elétrica positiva incrustada com elétrons como dizia J. J. Thomson. Segundo Rutherford, o átomo teria na verdade um núcleo de carga elétrica positiva de tamanho muito pequeno em relação ao seu tamanho total, sendo que este núcleo, que conteria praticamente toda a massa do átomo, estaria sendo rodeado por elétrons de carga elétrica negativa, os quais descreveriam órbitas helicoidais em altas velocidades.
Falha no modelo de Rutherford
A falha do modelo de Rutherford é mostrada pela teoria do electromagnetismo, de que toda partícula com carga elétrica submetida a uma aceleração origina a emissão de uma onda electromagnética. O elétron em seu movimento orbital está submetido a uma aceleração centrípeta e, portanto, emitirá energia na forma de onda eletromagnética. Essa emissão, pelo Princípio da conservação da energia, faria com que o elétron perdesse energia cinética e potencial, caindo progressivamente sobre o núcleo, fato que não ocorre na prática. A falha foi corrigida pelo modelo atômico de Bohr, de seu aluno e colega de trabalho Niels Bohr, que dizia que considerava a ideia de um modelo atômico planetário bonita demais para estar errada. Assim, com o auxílio das descrições quânticas da radiação eletromagnética propostas por Albert Einstein e Max Planck, conseguiu completar a teoria de Rutherford, ficando assim conhecida como modelo átomico-molecular de Rutherford-Bohr.
Tamanho do átomo
Analisando os resultados de numeros de particulas que passavam ou eram refletidas pela camada de ouro, Rutherford conseguiu inclusive calcular a provável proporção de tamanho entre nucleo e átomo, que segundo ele seria 1/100000000000000000255000000025250000000000000002505000000000000000000000000000000000000000000000000000000000000000000250250520552000000000000000000000000002500000000000000000000000009487603421 a 1/100000. É de costume comparar o tamanho do nucleo do átomo de rutherford em relação ao seu todo, com uma formiga no meio de um campo de futebol, sendo a formiga o núcleo e o campo o tamanho total do átomo.
Experimento das lâminas
- Fatos
- A maioria dos raios passa direto pelas placas de metal;
- Algumas partículas sofrem desvio em uma das placas de ouro;
- Pouquíssimas partículas são rebatidas.
- Conclusão
- 1º postulado: Os elétrons descrevem órbitas circulares estacionárias ao redor do núcleo, sem emitirem nem absorverem energia;
- 2º postulado: Fornecendo energia (elétrica, térmica, ....) a um átomo, um ou mais elétrons a absorvem e saltam para níveis mais afastados do núcleo. Ao voltarem as suas órbitas originais, devolvem a energia recebida em forma de luz (fenômeno observado, tomando como exemplo, uma barra de ferro aquecida ao rubro);
- O núcleo é positivamente carregado;
- A região vazia em torno do núcleo é denominada eletrosfera que seria onde os elétrons estão localizados.
Ou seja, Rutherford concluiu: Que todo átomo possui uma eletrosfera, na qual se baseia em um espaço ao redor do núcleo, em que os elétrons estão localizados e giram em órbitas circulares estacionarias ao redor do núcleo maciço e positivo.
