Trimetilalumínio
| Trimetilalumínio Alerta sobre risco à saúde | |
|---|---|
| |
| Nome IUPAC | trimethylalumane |
| Outros nomes | Trimethylaluminium; aluminium trimethyl |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/3CH3.Al/h3*1H3;/rC3H9Al/c1-4(2)3/h1-3H3
|
| Propriedades | |
| Fórmula molecular | C6H18Al2 |
| Massa molar | 144.18 g/mol |
| Aparência | Liquido incolor |
| Densidade | 0.752 g/mL |
| Ponto de fusão |
15 °C |
| Ponto de ebulição |
125 °C |
| Riscos associados | |
| Principais riscos associados |
Pirofórico |
| NFPA 704 | |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
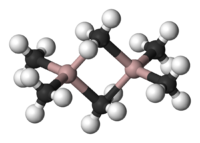
Trimetilalumínio é um composto químico de fórmula Al2(CH3)6,abreviado como Al2Me6, (AlMe3)2 ou pela abreviação TMA.Esse liquido incolor e pirofórico é um importante composto organoalumínico industrial.Evolve uma fumaça branca (óxidos de alumínio) quando seus vapores entram em contato com ar.
Estrutura e ligações[editar | editar código-fonte]
Al2Me6 existe como um dímero, análogo à estrutura do diborano.Assim como no diborano, os metaloides estão ligados por uma ligação três centros dois elétrons.O grupo metil compartilhado liga os dois átomos de alumínio.O terminal Al-C e a ponte de ligamento Al-C tem distância de 1,97 Å e 2,14 Å respectivamente.[1]Os átomos de carbono do radical metil central tem 5 vizinhos: três átomos de hidrogênio e dois de alumínio.Os radicais metil interagem prontamente tanto de forma intramolecular como intermolecular.ligações três centro dois elétrons são ligações deficientes de elétrons, portanto tendem a reagir com bases de Lewis, isso resultaria em produtos com ligações dois centros dois elétrons.Por exemplo a reação com aminas resultaria em adutos R3N-AlMe3.Outra reação que gera produtos que segue a regra do octeto é a de Al2Me6 com tricloreto de alumínio para resultar em (AlMe2Cl2).A espécie química AlMe3, que teria um átomo de alumínio central ligado a três radicais metila é desconhecida.A teoria VSEPR prediz que tal molécula teria uma geometria trigonal plana, assim como observado no BMe3.
Síntese e aplicações[editar | editar código-fonte]
TMA pode ser preparado por um processo que pode ser sumarizado pela seguinte reação:
2 Al + 6 CH3Cl + 6 Na → Al2(CH3)6 + 6 NaCl
TMA é usado principalmente na produção de metilaluminoxano, um ativador para catalisadores Ziegler-Natta usados na polimerização de olefinas.TMA também é empregado como um agente metilante.O reagente de Tebbe, que é usado para a metilação de éster e cetonas,é preparado a partir do TMA.TMA é frequentemente usado como traçante em foguetes para teste de padrões de vento na atmosfera superior.TMA também é usado na fabricação de semicondutores, para crescer um fino filme de óxido de alumínio via o processo de Deposição química em fase de vapor ou deposição de camada atômica. TMA forma complexo com a amina terciaria DABCO, o complexo é mais seguro para transporte que TMA puro[2]. Em combinação com Cp2ZrCl2 (dicloreto de zirconoceno), o (CH3)2Al-CH3 adiciona alcinos transversais para dar espécies de vinil alumínio que são úteis em síntese orgânica em uma reação conhecida como carboaluminação[3].
TMA de grau semicondutor[editar | editar código-fonte]
TMA é a fonte metalorgânica preferida para epitaxia metalorgânica em fase de vapor de semicondutores contendo alumínio, tais como AlAs,AlN,AlP, AlSb, AlGaAs, AlInGaP, AlGaN, AlInGaNP etc.O critério para a qualidade do TMA são impurezas elementais, oxigenadas e orgânicas
Referencias[editar | editar código-fonte]
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Biswas, K.; Prieto, O.; Goldsmith, P. J.Woodward, S. (2005). «Remarkably Stable (Me3Al)2DABCO and Stereoselective Nickel-Catalyzed AlR3 (R = Me, Et) Additions to Aldehydes». Angewandte Chemie International Edition. 44 (15): 2232–2234. PMID 15768433. doi:10.1002/anie.200462569
- ↑ Negishi, E.; Matsushita, H. «Palladium-Catalyzed Synthesis of 1,4-Dienes by Allylation of Alkenyalane: α-Farnesene [1,3,6,10-Dodecatetraene, 3,7,11-trimethyl-]». Org. Synth.; Coll. Vol., 7
| Parte ou a integralidade do conteúdo desta página resulta da tradução de uma página originalmente presente numa Wikipédia noutra língua. A página correspondente pode ser conferida aqui. Data da tradução: 2011-12-09. |

