Rhizoprionodon acutus
| Tubarão-leite | |
|---|---|
| Estado de conservação | |
 Pouco preocupante [1] | |
| Classificação científica | |
| Distribuição geográfica | |
 | |
| Sinónimos | |
| Carcharias aaronis Hemprich & Ehrenberg, 1899 Carcharias acutus Rüppell, 1837 |
O tubarão-leite (Rhizoprionodon acutus) é uma espécie de tubarão requiem, fazendo assim parte da família Carcharhinidae, cujo nome comum deriva da crença indiana de que o consumo de sua carne promove a lactação. O maior e mais amplamente distribuído membro de seu gênero, o tubarão-leite mede tipicamente 1,1 m (3,6 pés) de comprimento e pode ser encontrado em águas tropicais costeiras nas regiões do Atlântico Este e Indo-Pacífico. Ocorrendo da superfície a uma profundidade de 200 m (660 pés), esta espécie é comum perto de praias e estuários e foi registrada nadando em rios no Camboja. Os juvenis são conhecidos por habitar piscinas de maré e prados de ervas marinhas. O tubarão-leite tem um corpo esbelto, com um focinho longo e pontudo e olhos grandes, e é caracterizado por um cinza indefinido acima e branco abaixo. Este tubarão pode ser distinguido de espécies semelhantes em seu alcance pelos longos sulcos nos cantos da boca e por sete a 15 poros dilatados logo acima deles.
Entre os tubarões mais abundantes em sua faixa, o tubarão-leite se alimenta principalmente de pequenos peixes ósseos, mas também consome cefalópodes e crustáceos. Por sua vez, geralmente é vítima de tubarões maiores e possivelmente mamíferos marinhos. Em comum com outros membros de sua família, essa espécie é vivípara, com os embriões em desenvolvimento sustentados por uma conexão placentária. As fêmeas dão à luz de um a oito filhotes durante uma estação de reprodução definida ou durante o ano, dependendo da localização. O ciclo reprodutivo é geralmente anual, mas pode ser bienal ou trienal. Um grande número de tubarões leiteiros é capturado pela pesca artesanal e comercial em muitos países em busca de carne, barbatana e farinha de peixe. Apesar disso, a União Internacional para Conservação da Natureza avaliou esta espécie como sendo de menor preocupação, porque sua ampla distribuição e produtividade relativamente alta aparentemente permitem que os atuais níveis de exploração sejam mantidos.
Taxonomia e filogenia[editar | editar código-fonte]

O naturalista alemão Eduard Rüppell publicou a primeira descrição científica do tubarão-leite, como Carcharias acutus (epíteto específico significa "agudo" em latim), em seu Fische des Rothen Meeres (peixes do mar vermelho), em 1837. Desde então, foi listado em vários gêneros diferentes, incluindo Carcharhinus e Scoliodon, antes de finalmente ser colocado no gênero Rhizoprionodon por meio de sinonímia com as espécies do tipo R. crenidens.[2][3] Como Rüppell não mencionou um espécime tipo, em 1960, Wolfgang Klausewitz designou um macho de 44 cm de comprimento capturado em Jeddah, na Arábia Saudita, como o lectótipo para esta espécie.[2]
O nome comum "tubarão-leite" vem de uma crença na Índia de que comer a carne desse tubarão aumenta a lactação.[3] Outros nomes para esta espécie incluem tubarão-peixe, tubarão-gato-cinzento, tubarão-azul-menor, tubarão-gato-de-Longmans, tubarão-leiteiro, tubarão-(leite)de-nariz-afiado, tubarão-de-nariz-afiado-de-Walbeehm e tubarão-de-olho-branco.[4] Uma análise filogenética de 1992 de Gavin Naylor, baseada em aloenzimas, descobriu que o tubarão-leite é a mais basal das quatro espécies de Rhizoprionodon examinadas.[5] O R. fischeuri extinto, conhecido dos depósitos do Mioceno Médio (16–12 milhões de anos atrás) no sul da França e Portugal, pode ser o mesmo que R. acutus.[6]
Distribuição e habitat[editar | editar código-fonte]
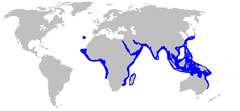
O tubarão-leite tem a distribuição mais ampla de qualquer espécie de Rhizoprionodon.[1] No leste do Oceano Atlântico, é encontrado da Mauritânia a Angola, bem como ao redor da Madeira e no Golfo de Taranto, ao sul da Itália.[7] No Oceano Índico, ocorre da África do Sul e Madagascar até a Península Arábica, para o norte,, e para o leste, para o sul e sudeste da Ásia. No Oceano Pacífico, essa espécie ocorre da China e do sul do Japão, passando pelas Filipinas e Indonésia, até Nova Guiné e norte da Austrália.[2] O tubarão-leite provavelmente já teve uma distribuição contígua pelo Mar de Tétis, até durante a época do Mioceno, quando os tubarões do Atlântico Leste foram isolados dos tubarões do Indo-Pacífico pela colisão da Ásia e da África.[6]
Ocorrendo perto da costa da zona de rebentação a uma profundidade de 200 m (660 pés), o tubarão-leite favorece a água turva das praias e ocasionalmente entra nos estuários.[2][8] Em Shark Bay, Austrália Ocidental, os tubarões-leite juvenis habitam prados de ervas marinhas compostas por Amphibolis antarctica e Posidonia australis.[9] Embora algumas fontes afirmem que essa espécie evita baixas salinidades,[2][3] foi relatada várias vezes a partir de água doce no Camboja, tão rio acima quanto o Tonlé Sap.[10] Tubarões-leite podem ser encontrados em qualquer lugar da coluna de água, desde a superfície até o fundo.[11] Em KwaZulu-Natal, África do Sul, seus números flutuam anualmente com um pico no verão, sugerindo alguma forma de movimento sazonal.[3]
Descrição[editar | editar código-fonte]

O maior membro de seu gênero, na costa da África Ocidental, o tubarão-leite atinge 1,78 m (5,8 pés) e 22 kg (49 lb) para machos e 1,65 m (5,4 pés) e 17 kg (37 lb) para fêmeas ,[12] embora exista incerteza quanto à identidade das espécies desses espécimes.[4] Mesmo se aceitos, esses números são considerados excepcionais e a maioria dos indivíduos não excede 1,1 m (3,6 pés) de comprimento.[2] Geralmente, as fêmeas são mais pesadas e atingem um tamanho máximo maior do que os machos.[13]
O tubarão-leite tem uma estrutura esbelta, com focinho longo e pontudo, olhos grandes e redondos com membranas nictitantes (terceiras pálpebras protetoras) e sem espiráculos. Em cada lado da cabeça atrás do canto da mandíbula, geralmente há sete a 15 poros dilatados. As narinas são pequenas, assim como os retalhos de pele triangulares adjacentes. Há sulcos longos nos cantos da boca, tanto na mandíbula superior quanto na inferior. As linhas dos dentes são de 24 a 25 nas duas mandíbulas. Os dentes superiores são finamente serrilhados e fortemente oblíquos; os dentes inferiores têm uma forma semelhante, embora as dentadas sejam menores e as pontas se curvem suavemente para cima.[2][8] Os dentes dos jovens são de arestas lisas.[14]
As barbatanas peitorais triangulares e largas originam-se abaixo da terceira ou quarta fenda branquial e não ultrapassam a margem frontal da primeira barbatana dorsal. A barbatana anal tem cerca do dobro do tamanho da segunda barbatana dorsal e é precedida por longas cristas. A primeira barbatana dorsal origina-se sobre as pontas traseiras livres da barbatana peitoral e a segunda barbatana dorsal muito menor origina-se no último terço da base da barbatana anal. As barbatanas dorsais não têm uma crista entre elas. O lobo inferior da barbatana caudal é bem desenvolvido e o lobo superior possui um entalhe ventral próximo à ponta. Este tubarão é cinza claro, marrom-cinza ou cinza-roxo acima e branco abaixo. A borda anterior da primeira barbatana dorsal e a borda posterior da barbatana caudal podem estar escuras, e as bordas finais das barbatanas peitorais podem ser claras.[2][8]
Biologia e ecologia[editar | editar código-fonte]
Um dos tubarões costeiros mais abundantes (se não o mais) dentro de sua faixa, o tubarão-leite se alimenta principalmente de pequenos peixes ósseos bentônicos e em cardumes. Ocasionalmente, lulas, polvos, chocos, caranguejos, camarões e gastrópodes também são consumidos.[2] Na Baía dos Tubarões, as presas mais importantes são as Atherinidae, os arenques, os Sillaginidae e os Labridae; esta também é a única espécie local de tubarão que ataca o Psammoperca waigiensis, encontrado em leitos de ervas marinhas evitados por outros tubarões. No Golfo de Carpentaria, alimenta-se principalmente de Hemiramphidae, arenques e tainhas, e também é um dos principais predadores dos camarões penaeídeos. Os tubarões menores comem proporcionalmente mais cefalópodes e crustáceos, mudando para os peixes à medida que envelhecem.[9][15]
Muitos predadores se alimentam do tubarão-leite, incluindo tubarões maiores, como o tubarão-de-ponta-preta (Carcharhinus limbatus) e o tubarão-de-ponta-preta da Austrália (Carcharhinus tilstoni), e possivelmente também mamíferos marinhos. [14] Fora de KwaZulu-Natal, a dizimação de grandes tubarões pelo uso de redes de emalhar para proteger as praias levou a um aumento recente no número de tubarões-leite.[16] Um parasita conhecido dessa espécie é o copépode Pseudopandarus australis.[17] Existem evidências de que os tubarões masculinos e femininos segregam um do outro.[13]
Ciclo de vida[editar | editar código-fonte]
Como outros tubarões requiem, o tubarão-leite é vivíparo; as fêmeas geralmente têm um único ovário funcional (à esquerda) e dois úteros funcionais divididos em compartimentos separados para cada embrião.[13] Os detalhes de seu ciclo de vida variam em diferentes partes de seu alcance. As fêmeas geralmente produzem filhotes a cada ano, embora algumas deem à luz a cada dois anos ou até a cada três anos.[13][18] O acasalamento e o parto ocorrem na primavera ou no início do verão (abril a julho) na África ocidental e meridional[12][13][19] e no inverno na Índia,[2] Alternativamente, o parto em Omã ocorre durante todo o ano com um pico na primavera.[11] O parto também ocorre continuamente nas águas australianas; no Herald Bight de Shark Bay, o número de recém-nascidos atinge o pico em abril e novamente em julho.[20][21] Uma explicação proposta para a falta de sazonalidade reprodutiva nessas subpopulações é um ciclo reprodutivo mais longo e / ou mais complexo do que o detectado (como um período de dormência no desenvolvimento embrionário, embora atualmente não haja evidências disso). As fêmeas não armazenam espermatozóides internamente.[11]
O tamanho da ninhada varia de um a oito, sendo dois a cinco típicos, aumentando com o tamanho da fêmea.[2][19] Nas águas omanenses, as fêmeas superam em média os machos em uma ninhada em mais de 2:1, e as ninhadas só de fêmeas não são incomuns.[11] Desequilíbrios sexuais semelhantes, mas menos extremos, também foram relatados em ninhadas de tubarões-leite no Senegal e no leste da Índia.[13][22] A razão para esse desequilíbrio é desconhecida e não foi observada em espécies relacionadas, como o tubarão-narigão (R. terraenovae).[11] A gestação dos embriões leva cerca de um ano e prossegue em três fases. Na primeira fase, com duração de dois meses a um comprimento embrionário de 63–65 mm (2,5–2,6 pol.), o embrião depende da gema para sustentação e as trocas gasosas ocorrem através de seu tegumento de superfície e possivelmente também do saco vitelino. Durante a segunda fase, que também dura dois meses, com um comprimento embrionário de 81 a 104 mm (3,2 a 4,1 pol.), os filamentos branquiais externos se desenvolvem e o saco vitelino começa a ser reabsorvido, com o embrião ingerindo histotrófico (substância nutritiva secretada pela mãe) enquanto isso. Na terceira fase, com duração de seis a oito meses, o saco vitelino esgotado é convertido em uma conexão placentária através da qual o feto recebe nutrição até o nascimento.[13]
Os tubarões jovens geralmente nascem com um comprimento de 32,5 a 50,0 cm (12,8 a 19,7 pol.) E pesam 127 a 350 g (0,280 a 0,772 lb).[13] Há um registro atípico de uma fêmea, capturada em Mumbai, carregando um feto com apenas 23,7 cm de comprimento que já estava quase totalmente desenvolvido, muito antes da conclusão da gestação.[23] As fêmeas grávidas usam áreas de berçário costeiras para dar à luz, aproveitando as águas mais quentes e a comida abundante; áreas de viveiro conhecidas incluem o Parque Nacional Banc d'Arguin, na Mauritânia, e Cleveland Bay e Herald Bight, na Austrália.[19][20][21] Em Herald Bight, grandes grupos de pequenos tubarões-leite podem ser encontrados em piscinas rasas das marés, bem como em leitos de ervas marinhas, onde são protegidos dos predadores pela vegetação densa e alta. Os tubarões saem desses desembarcadouros costeiros quando amadurecem.[21]
Machos e fêmeas amadurecem nos comprimentos de 84–95 cm (33–37 pol.) e 89–100 cm (35–39 pol.), respectivamente, na África Ocidental,[13] 68–72 cm (27–28 pol.) E 70 –80 cm (28-31 pol.), respectivamente, na África Austral,[24] e 63-71 cm (25-28 pol.) E 62-74 cm (24-29 pol.), respectivamente, no Omã. Essas discrepâncias no tamanho da maturação podem ser o resultado de variação regional ou seleção incidental de forte pressão de pesca.[11] A taxa de crescimento dos tubarões-leite de Chennai foi calculada em 10 cm (3,9 pol.) no primeiro ano, 9 cm (3,5 pol.) no segundo ano, 7 cm (2,8 pol.) no terceiro ano, 6 cm (2,4 pol.) ) no quarto ano, 5 cm (2,0 pol.) no quinto ano e 3 a 4 cm (1,2 a 1,6 pol) por ano a partir de então.[22] Pensa-se que a idade de maturação é de 2 a 3 anos e a vida útil máxima é de pelo menos 8 anos.[1]
Interações humanas[editar | editar código-fonte]

O tubarão-leite é inofensivo para os seres humanos devido ao seu pequeno tamanho e dentes.[14] Capturado usando palangres, redes de emalhar, redes de arrasto e anzol, este tubarão é comercializado fresco ou seco e salgado para consumo humano, e também é usado para sopa de barbatana de tubarão e farinha de peixe.[1][14] Sua abundância faz dele um componente significativo da pesca artesanal e comercial em toda a sua extensão. No norte da Austrália, está entre os tubarões mais comuns capturados em redes de arrasto e compreende 2% e 6% das capturas anuais de rede de emalhar e palangre, respectivamente.[1] Essa espécie também é um dos tubarões mais importantes comercialmente capturados no Senegal, Mauritânia, Omã e Índia.[25] Alguns pescadores esportivos o consideram um peixe de caça.[14]
A União Internacional para Conservação da Natureza listou o tubarão-leite em Menos Preocupação; apesar de ser pescado pesadamente, tem uma ampla distribuição e permanece bastante comum. As características reprodutivas dessa espécie sugerem que ela é capaz de suportar um nível de exploração um tanto alto, embora não tanto quanto o tubarão-cinzento (R. oligolinx) ou o tubarão-australiano (R. taylori).[1] Nos anos 80 e início dos anos 90, as avaliações do estoque de tubarão-leite na costa de Veraval, na Índia, concluíram que as capturas pela pesca de redes de arrasto e de emlahar estavam abaixo do nível máximo sustentável. No entanto, esses estudos foram baseados em metodologias que posteriormente se provaram não confiáveis para populações de tubarões. Além disso, a pressão de pesca na região aumentou substancialmente desde que as avaliações foram realizadas.[14][25]
Ver também[editar | editar código-fonte]
Referências
- ↑ a b c d e f Simpfendorfer, C.A. (2003). «Rhizoprionodon acutus». p. e.T41850A10579779. doi:10.2305/IUCN.UK.2003.RLTS.T41850A10579779.en
- ↑ a b c d e f g h i j k Compagno, L.J.V. (1984). Sharks of the World: An Annotated and Illustrated Catalogue of Shark Species Known to Date. Rome: Food and Agricultural Organization. pp. 525–526. ISBN 92-5-101384-5
- ↑ a b c d Van der Elst, R. (1993). A Guide to the Common Sea Fishes of Southern Africa third ed. [S.l.]: Struik. p. 46. ISBN 1-86825-394-5
- ↑ a b Froese, Rainer; Pauly, Daniel (eds.) (2009). "Rhizoprionodon acutus" em FishBase. Versão September 2009.
- ↑ Naylor, G.J.P. (1992). «The phylogenetic relationships among requiem and hammerhead sharks: inferring phylogeny when thousands of equally most parsimonious trees result» (PDF). Cladistics. 8 (4): 295–318. doi:10.1111/j.1096-0031.1992.tb00073.x. hdl:2027.42/73088

- ↑ a b Carrier, J.C.; J.A. Musick & M.R. Heithaus (2004). Biology of Sharks and Their Relatives. [S.l.]: CRC Press. pp. 52–53. ISBN 0-8493-1514-X
- ↑ Compagno, L.J.V.; M. Dando & S. Fowler (2005). Sharks of the World. [S.l.]: Princeton University Press. pp. 317–318. ISBN 978-0-691-12072-0
- ↑ a b c Randall, J.E. & J.P. Hoover (1995). Coastal Fishes of Oman. [S.l.]: University of Hawaii Press. p. 36. ISBN 0-8248-1808-3
- ↑ a b White, W.T.; M.E. Platell & I.C. Potter (março de 2004). «Comparisons between the diets of four abundant species of elasmobranchs in a subtropical embayment: implications for resource partitioning». Marine Biology. 144 (3): 439–448. doi:10.1007/s00227-003-1218-1
- ↑ Rainboth, W.J. (1996). Fishes of the Cambodian Mekong. [S.l.]: Food and Agriculture Organization. p. 51. ISBN 92-5-103743-4
- ↑ a b c d e f Henderson, A.C.; J.L. McIlwain; H.S. Al-Oufi & A. Ambu-Ali (junho de 2006). «Reproductive biology of the milk shark Rhizoprionodon acutus and the bigeye houndshark Iago omanensis in the coastal waters of Oman». Journal of Fish Biology. 68 (6): 1662–1678. doi:10.1111/j.0022-1112.2006.01011.x
- ↑ a b Cadenat, J. & J. Blache (1981). «Requins de Méditerranée et d'Atlantique (plus particulièrement de la côte occidentale d'Afrique)». ORSTOM. 21: 1–330
- ↑ a b c d e f g h i Capape, C.; Y. Diatta; M. Diop; O. Guelorget; Y. Vergne & J. Quignard (2006). «Reproduction in the milk shark, Rhizoprionodon acutus (Ruppell, 1837) (Chondrichthyes: Carcharhinidae), from the coast of Senegal (eastern tropical Atlantic)». Acta Adriatica. 47 (2): 111–126
- ↑ a b c d e Bester, C. Biological Profiles: Milk Shark. Florida Museum of Natural History Ichthyology Department. Retrieved on September 10, 2009.
- ↑ Salini, J.P.; S.J.M. Blaber & D.T. Brewer (1990). «Diets of piscivorous fishes in a tropical Australian estuary, with special reference to predation on penaeid prawns». Marine Biology. 105 (3): 363–374. doi:10.1007/BF01316307
- ↑ Heemstra, E. & P. Heemstra (2004). Coastal Fishes of Southern Africa. [S.l.]: NISC and SAIAB. p. 62. ISBN 1-920033-01-7
- ↑ Cressey, R. & C. Simpfendorfer (1988). «Pseudopandarus australis, a new species of pandarid copepod from Australian sharks». Proceedings of the Biological Society of Washington. 101 (2): 340–345
- ↑ Devadoss, P. (1988). «Observations on the breeding and development of some sharks». Journal of the Marine Biological Association of India. 30: 121–131
- ↑ a b c Valadou, B.; J. Brethes & C.A.O. Inejih (31 de dezembro de 2006). «Biological and ecological data of five elasmobranch species from the waters of the Banc d'Arguin National Park (Mauritania)». Cybium. 30 (4): 313–322
- ↑ a b Simpfendorfer, C.A. & N.E. Milward (agosto de 1993). «Utilisation of a tropical bay as a nursery area by sharks of the families Carcharhinidae and Sphyrnidae». Environmental Biology of Fishes. 37 (4): 337–345. doi:10.1007/BF00005200
- ↑ a b c White, W.T. & I.C. Potter (outubro de 2004). «Habitat partitioning among four elasmobranch species in nearshore, shallow waters of a subtropical embayment in Western Australia». Marine Biology. 145 (5): 1023–1032. doi:10.1007/s00227-004-1386-7
- ↑ a b Krishnamoorthi, B. & I. Jagadis (1986). «Biology and population dynamics of the grey dogshark, Rhizoprionodon (Rhizoprionodon) acutus (Ruppell), in Madras waters». Indian Journal of Fisheries. 33 (4): 371–385
- ↑ Setna, S.B. & P.N.Sarandghar (1949). «Breeding habits on Bombay elasmobranchs». Records of the Indian Museum. 47: 107–124
- ↑ Bass, A.J.; J.D. D’Aubrey & N. Kistnasamy (1975). «Sharks of the east coast of southern Africa. III. The families Carcharhinidae (excluding Mustelus and Carcharhinus) and Sphyrnidae». Investigative Report of the Oceanographic Research Institute of South Africa. 33: 1–100
- ↑ a b Fowler, S.L.; R.D. Cavanagh; M. Camhi; G.H. Burgess; G.M. Cailliet; S.V. Fordham; C.A. Simpfendorfer & J.A. Musick (2005). Sharks, Rays and Chimaeras: The Status of the Chondrichthyan Fishes. [S.l.]: International Union for Conservation of Nature and Natural Resources. p. 92–93, 146–147. ISBN 2-8317-0700-5

