Pentafluoreto de fósforo
Pentafluoreto de fósforo é o composto de fórmula química PF5
Preparo[editar | editar código-fonte]
O pentafluoreto de fósforo foi preparado pela primeira vez em 1876 através da fluoração do pentacloreto de fósforo usando trifluoreto de arsênico. Essa síntese continua a ser um método preferido:[1]
- 3 PCl5 + 5 AsF3 → 3 PF5 + 5 AsCl3
Estrutura[editar | editar código-fonte]
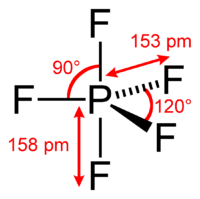
Estudos de raios X de monocristal indicam que o PF5 tem geometria molecular bipiramidal trigonal. Dessa forma, apresenta dois tipos distintos de ligações P-F (axial e equatorial): o comprimento de uma ligação P-F axial é distinto da ligação P-F equatorial na fase sólida, mas não nas fases líquida ou gasosa devido à pseudo-rotação de Berry.
A espectroscopia de RMN de flúor-19, mesmo a temperatura de -100°C, falha em distinguir os ambientes axial e equatorial dos átomos de flúor. Esta aparente equivalência surge da baixa barreira para pseudo-rotação através do mecanismo de Berry, pelo qual os átomos de flúor axiais e equatoriais trocam rapidamente de posição. A aparente equivalência dos centros F em PF5 foi observada pela primeira vez por Gutowsky.[2] A explicação para o fenômeno foi descrita pela primeira vez por Stephen Berry. O mecanismo de Berry influencia o espectro de 19F NMR do PF5, uma vez que a espectroscopia de NMR opera em uma escala de tempo de milissegundos.
A difração de elétrons e a cristalografia de raios X não detectam esse efeito, pois as estruturas do estado sólido são, em relação a uma molécula em solução, estáticas e não podem sofrer as mudanças necessárias na posição atômica.
Acidez de Lewis[editar | editar código-fonte]
O pentafluoreto de fósforo é um ácido de Lewis. Esta propriedade é relevante para sua rápida hidrólise. Um aduto extensivamente estudado é o PF5 com piridina. Com aminas primárias e secundárias, os adutos convertem-se facilmente em derivados diméricos a fórmula [PF4(NR2)]2. Uma variedade de complexos é conhecida com ligantes bidentados.[3]
O ácido hexafluorofosfórico (HPF6) é derivado do pentafluoreto de fósforo e fluoreto de hidrogênio. Sua base conjugada, hexafluorofosfato (PF6-), é um ânion não coordenante útil.
Referências
- ↑ Kwasnik, W. (1963). "Phosphorus(V) fluoride". In Brauer, G. (ed.). Handbook of Preparative Inorganic Chemistry. Vol. 1 (2nd ed.). New York: Academic Press. p. 190
- ↑ Gutowsky, H. S.; McCall, D. W.; Slichter, C. P. (1 de fevereiro de 1953). «Nuclear Magnetic Resonance Multiplets in Liquids». The Journal of Chemical Physics (2): 279–292. ISSN 0021-9606. doi:10.1063/1.1698874. Consultado em 11 de dezembro de 2022
- ↑ Wong, Chih Y.; Kennepohl, Dietmar K.; Cavell, Ronald G. (1 de janeiro de 1996). «Neutral Six-Coordinate Phosphorus». Chemical Reviews (em inglês) (6): 1917–1952. ISSN 0009-2665. doi:10.1021/cr9410880. Consultado em 11 de dezembro de 2022