Ponto triplo
Em termodinâmica, o ponto triplo é um estado particular de uma substância determinado por valores de temperatura e pressão, no qual as três fases ou estados físicos da substância (sólido, líquido e gasoso) coexistem em equilíbrio.[1]
O ponto triplo do dióxido de carbono (CO2), por exemplo, ocorre na temperatura de 216,55 K e à pressão de 517 kPa. Já o ponto triplo do mercúrio ocorre à temperatura de −38,83440 °C e à pressão de 0,2 mPa.
Além do ponto triplo entre sólido, líquido e gasoso, podem existir pontos triplos envolvendo mais de uma fase sólida, nas substâncias com polimorfismo. Em geral, para um sistema com p fases possíveis, existem pontos triplos.[1]
Note que a pressão aqui referida é a pressão de vapor da substância — não a pressão total do sistema.
O ponto triplo da água é dado por definição - não por uma medição exata. É usado para definir o kelvin, a unidade de temperatura termodinâmica no Sistema Internacional de Unidades.[2][3] Os pontos triplos de várias substâncias são usados para definir pontos na Escala Internacional de Temperaturas de 1990 (ITS-90), que vai desde o ponto triplo do hidrogênio (13,8033 K) até o ponto triplo da água (273,16 K, 0,01 °C ou 32,018 °F)
Pontos triplos da água[editar | editar código-fonte]
Ponto triplo sólido-líquido-gás[editar | editar código-fonte]
A única combinação de pressão e temperatura na qual os três estados físicos da água (sólido (gelo), gasoso (vapor) e líquido) podem coexistir em equilíbrio estável ocorre exatamente quando a temperatura é de 273,16 kelvins (0,01 °C) e a pressão é de 611,73 pascals (cerca de 0,006 bar; 0,0060373 atm). Nesse ponto, é possível mudar toda a substância para gelo, água ou vapor fazendo pequenas mudanças na temperatura e pressão.
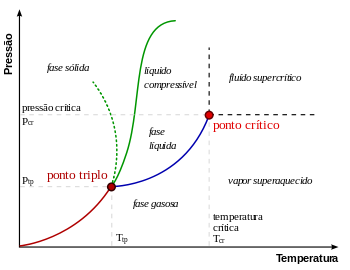
O ponto triplo sólido-líquido-gás corresponde à mínima pressão na qual a água líquida pode existir. Sob pressões abaixo do ponto triplo (como no espaço sideral), o gelo, quando aquecido a uma pressão constante, converte-se diretamente em vapor de água, num processo conhecido como sublimação. Acima do ponto triplo, o gelo, quando aquecido a uma pressão constante, primeiro derrete, formando água líquida, e depois evapora ou ferve, passando ao estado gasoso (vapor).
Para a maioria das substâncias, o ponto triplo também é a mínima temperatura na qual o líquido pode existir. Para a água, porém, isto não é verdade, por causa de seu comportamento anômalo[4] que faz com que o ponto de fusão do gelo diminua com o aumento da pressão, conforme mostra a linha verde pontilhada, no diagrama de fases (ver figura). A uma temperatura um pouco abaixo do ponto triplo (entre 251–273 K), a compressão a temperatura constante transforma o vapor de água, primeiro, em gelo I e depois em água líquida (o gelo tem uma densidade menor do que a água líquida, de modo que um aumento de pressão leva à liquefação).
Durante a missão Mariner 9, da NASA, para Marte, a pressão do ponto triplo da água foi usada como ponto de referência para o "nível do mar". Missões mais recentes utilizam altimetria a laser e medições da gravidade, em vez da pressão, para definir elevações em Marte.[5]
Outros pontos triplos da água em pressões mais altas[editar | editar código-fonte]
Em altas temperaturas, a água tem um diagrama de fases complexo com quinze fases conhecidas do gelo e um número de pontos triplos, incluíndo os dez cujas coordenadas são mostradas no diagrama. Por exemplo, o ponto triplo em 251 K (-22 °C) e 210 MPa (2070 atm) corresponde às condições de coexistência do gelo Ih (gelo comum), gelo III e água líquida, todos em equilíbrio. Mas podem existir também pontos em que três fases sólidas coexistam em equilíbrio, como a 218 K e 620 MPa.

Células do ponto triplo[editar | editar código-fonte]
Células do ponto triplo são usadas na calibração de termômetros. Para medições exatas, células de ponto triplo são geralmente preenchidas com uma substância química com alta pureza, como o hidrogênio, argônio, mercúrio ou água, dependendo da temperatura desejada. A pureza destas substâncias pode ser tal que apenas uma parte em um milhão seja um contaminante, o que significa 99,9999% puro. As células de ponto triplo são tão eficientes no alcance de temperaturas precisas e reproduzíveis que um padrão internacional de calibração de termômetros chamado ITS-90 se baseia em células de hidrogênio, neon, oxigênio, argônio, mercúrio e água para determinar seus seis pontos definidos de temperatura.
Tabela de pontos triplos[editar | editar código-fonte]
Esta tabela lista o ponto triplo sólido-líquido-gasoso de substâncias comuns. A menos que diferentemente indicadas, as informações vieram da U.S. National Bureau of Standars (agora NIST (National Institute of Standards and Technology).[6]
| Substância | T [K] | p [kPa]* |
|---|---|---|
| Acetileno | 192,4 | 120 |
| Amoníaco | 195,40 | 6,076 |
| Argônio | 83,81 | 68,9 |
| Arsênio | 1090 | 3628 |
| Butano | 134,6 | 7 × 10−4 |
| Carbono (grafite) | 4765 | 10132 |
| Dióxido de carbono | 216,55 | 517 |
| Monóxido de carbono | 68,10 | 15,37 |
| Clorofórmio | 175,43 | 0,870 |
| Deuterio | 18,63 | 17,1 |
| Etano | 89,89 | 8 × 10−4 |
| Etanol | 150 | 4,3 × 10−7 |
| Etileno | 104,0 | 0,12 |
| Ácido fórmico | 281,40 | 2,2 |
| Hélio-4 (ponto lambda) | 2,19 | 5,1 |
| Hexafluoroetano | 173,08 | 26,60 |
| Hidrogênio | 13,84 | 7,04 |
| Cloreto de Hidrogênio | 158,96 | 13,9 |
| Iodo[7] | 386,65 | 12,07 |
| Isobutano[8] | 113,55 | 1,9481 × 10−5 |
| Mercúrio | 234,2 | 1,65 × 10−7 |
| Metano | 90,68 | 11,7 |
| Neon | 24,57 | 43,2 |
| Óxido nítrico | 109,50 | 21,92 |
| Nitrogênio | 63,18 | 12,6 |
| Óxido nitroso | 182,34 | 87,85 |
| Oxigênio | 54,36 | 0,152 |
| Paládio | 1825 | 3,5 × 10−3 |
| Platina | 2045 | 2,0 × 10−4 |
| Dióxido de enxofre | 197,69 | 1,67 |
| Titânio | 1941 | 5,3 × 10−3 |
| Hexafluoreto de urânio | 337,17 | 151,7 |
| Água | 273,16 | 0,6117 |
| Xenônio | 161,3 | 81,5 |
| Zinco | 692,65 | 0,065 |
* Nota: Para fins de comparação, a pressão atmosférica típica é 101,325 kPa (1 atm).
Ver também[editar | editar código-fonte]
Referências
- ↑ a b IUPAC Gold Book.[1] Acessado em 07/08/2013.
- ↑ (em inglês) IUPAC Compendium of Chemical Terminology: kelvin.
- ↑ (em inglês) BIPM. Definition of the kelvin
- ↑ Anomalia da água. Por Domiciano Correa Marques da Silva. Mundo Educação.
- ↑ Carr, Michael H. (2007). The Surface of Mars. [S.l.]: Cambridge University Press. p. 5. ISBN 0-521-87201-4
- ↑ Cengel, Yunus A.; Turner, Robert H. (2004). Fundamentals of thermal-fluid sciences. Boston: McGraw-Hill. p. 78. ISBN 0-07-297675-6
- ↑ Walas, S. M. (1990). Chemical Process Equipment – Selection and Design. Amsterdam: Elsevier. p. 639. ISBN 0-7506-7510-1
- ↑ Veja en:Isobutane (data page)
Ligações externas[editar | editar código-fonte]
- Definição do kelvinno BIPM.

