Reagente de Tebbe
| Reagente de Tebbe Alerta sobre risco à saúde | |
|---|---|

| |
| Nome IUPAC | μ-Chloro[di(cyclopenta-2,4-dien-1-yl)]dimethyl(μ-methylene)titaniumaluminum |
| Outros nomes | Tebbe's reagent |
| Identificadores | |
| Número CAS | |
| Propriedades | |
| Fórmula molecular | C13H18AlClTi |
| Massa molar | 284.60 g/mol |
| Aparência | Vermelho |
| Solubilidade | tolueno, benzeno, diclorometano, THF (apenas em baixas temperaturas) |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
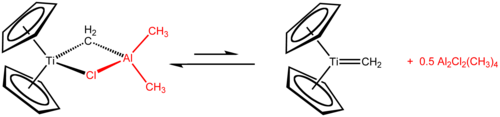
O reagente de Tebbe é um composto organometálico com a fórmula (C5H5)2Tich2Clal(CH3)2. É utilizado na metilenação de carbonilos compostos, que ele converte os compostos orgânicos que contêm a R2C ao grupo R no relacionado derivado 2C=CH2. [1] O reagente de tebbe é um sólido vermelho que é pirofórico no ar, e assim, é normalmente tratado com ar livre de técnicas. Ele contém dois centros tetraédricos ligados por um par de ligandos em ponte. Esse titanium possui dois ciclopentadienilo ([C5H5]-, ou anéis Cp) e em alumínio, tem dois ligantes metila. Os átomos de titânio e alumínio estão ligados em ponte por ambos CH 2 e ligandos de cloreto. Este composto exibe um quase quadrada (Ti-CH 2 ponte-Al-Cl). O reagente de Tebbe foi o primeiro composto relatado em que um grupo metileno preenche um metal de transição (Ti) e um metal do grupo principal (Al).[2]
Preparação[editar | editar código-fonte]
O reagente de Tebbe é sintetizado a partir da solução de dicloreto de titanoceno e trimetilalumínio. [2][3]
Cp2TiCl2 + 2 Al(CH3)3 → CH4 + Cp2TiCH2AlCl(CH3)2 + Al(CH3)2Cl
Após cerca de 3 dias, o produto é obtido após recristalização para remover o Al(CH3)2Cl.[2] Embora sínteses de utilizar o reagente de Tebbe isolado dão um produto mais limpo, os procedimentos de sucesso utilizando o reagente têm sido relatados.[4][5] Em vez de isolar o reagente Tebbe, a solução é meramente arrefecida num banho de gelo ou banho de gelo seco antes de adicionar o material de partida. Uma síntese alternativa mas menos conveniente implica a utilização de dimethyltitanocene (reagente Petasis):
Cp2Ti(CH3)2 + Al(CH3)2Cl → Cp2TiCH2AlCl(CH3)2 + CH4
Uma desvantagem deste método, além de requerer Cp2Ti(CH3)2, é a dificuldade de separar do produto a partir de que não reagiu o reagente de partida.
Mecanismo de reação[editar | editar código-fonte]
O reagente de Tebbe em si não reage com compostos de carbonilo, mas deve ser primeiro tratado com um ligeiro base de Lewis, tais como piridina, que gera o ativo carbono Schrock.
Também análogo ao reagente de Wittig, a reatividade parece ser impulsionada pelo elevado oxophilicity de Ti (IV). O carbono Schrock (1) reage com compostos de carbonilo (2) para dar um postulado oxatitanacyclobutane intermediário (3). Este intermediário cíclico nunca foi directamente isolado, presumivelmente porque se decompõe imediatamente para a produzir o desejado alceno (5).
Âmbito[editar | editar código-fonte]
O reagente de Tebbe é usado em síntese orgânica para metilenação de carbonilo.[6][7][8] Esta conversão pode também ser efetuada usando o reação de Wittig , embora o reagente Tebbe é mais eficiente especialmente para carbonilos estericamente oneradas. Além disso, o reagente de Tebbe é menos básico do que o reagente de Wittig e não dá os produtos β-eliminação. As reações metilenação também ocorrer por aldeídos , bem como ésteres e lactonas e amidas. O reagente de Tebbe converte ésteres e lactonas de éteres enólicos e amidas para enaminas. Nos compostos que contêm tanto grupos éster, a cetona seletivamente reage na presença de um equivalente do reagente de Tebbe.
O reagente Tebbe methylenates carbonilas sem racemizing uma quiral carbono α. Por esta razão, o reagente de Tebbe tem encontrado aplicações em reacções de açúcares em que a manutenção de estereoquímica pode ser crítico. O reagente de Tebbe reage com cloretos de ácido para formar enolatos de titânio, substituindo Cl-.
Ver também[editar | editar código-fonte]
Referências
- ↑ F. N. Tebbe, G. W. Parshall and G. S. Reddy (1978). «Olefin homologation with titanium methylene compounds». J. Am. Chem. Soc. 100 (11): 3611–3613. doi:10.1021/ja00479a061
- ↑ a b c Herrmann, W.A., "The Methylene Bridge" Advances in Organometallic Chemistry 1982, 20, 195-197.
- ↑ Straus, D. A., "μ-Chlorobis(cyclopentadienyl)(dimethylaluminium)-μ-methylenetitanium": Encyclopedia of Reagents for Organic Synthesis. John Wiley, London, 2000.
- ↑ Pine, S. H.; Kim, G.; Lee, V. (1993). «Enol ethers by methylenation of esters: 1-Phenoxy-1-phenylethene and 3,4-dihydro-2-methylene-2H-1-benzopyran». Org. Synth.; Coll. Vol., 8
- ↑ L. F. Cannizzo and R. H. Grubbs (1985). «In situ preparation of (μ-chloro)(μ-methylene)bis(cyclopentadienyl)(dimethylaluminum)titanium (Tebbe's reagent)». J. Org. Chem. 50 (13): 2386–2387. doi:10.1021/jo00213a040
- ↑ Titanium carbenoid reagents for converting carbonyl groups into alkenes" Hartley, R. C.; Li, J.; Main, C. A.; McKiernan, G. J. Tetrahedron 2007, 63, 4825-4864 (Review).
- ↑ Pine, S. H. Org. React. 1993, 43, 1. (Review)
- ↑ Beadham, I.; Micklefield, J. Curr. Org. Syn. 2005, 2, 231-250. (Review)