Hibridização
Este artigo não cita fontes confiáveis. (Outubro de 2011) |
Hibridização ou hibridação é o processo de formação de orbitais eletrônicos híbridos. Em alguns átomos, os orbitais dos subníveis atômicos s e p se misturam, dando origem a orbitais híbridos sp, sp² e sp³.
Segundo a teoria das ligações covalentes, uma ligação desse tipo se efetua pela superposição de orbitais semi-preenchidos (com apenas um elétron). A hibridação explica a formação de algumas ligações que seriam impossíveis por aquela teoria, bem como a disposição geométrica de algumas moléculas.
Elementos que hibridizam
Os elementos químicos que hibridizam são o carbono, silício, enxofre, (...) . O oxigênio e o nitrogênio também hibridizam, porém sem ativação.
Hibridação do Carbono
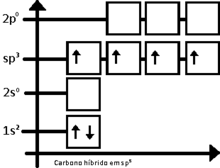
Hibridação sp3
A hibridação sp3 é facilmente explicada pelo carbono. Para o carbono tetraédrico (como no metano, CH4), deve haver quatro ligações simples. O problema é que a distribuição eletrônica do carbono no estado fundamental é 1s2 2s2 2px1 2py1, esquematizando:

(Nota: O orbital 1s tem menos energia que o 2s, que por sua vez tem menos energia que os orbitais 2p)
Dessa forma, o carbono deveria realizar apenas duas ligações, ao que há apenas dois orbitais semipreenchidos. Entretanto, a molécula de metileno (CH2) é extremamente reativa, não estando equilibrada quimicamente. O primeiro passo para se entender o processo de hibridação, é excitar o átomo de carbono em questão, tendo-se:

Então, o carbono equilibra os quatro orbitais, dando origem a orbitais de energia intermediária entre 2s e 2p, dando origem ao orbital sp3 (lido s-p-três), assim chamado por ser o resultado da fusão de um orbital s com três orbitais p. Portanto, tem-se:
Hibridação sp2
Outras formas de hibridação são explicadas de forma semelhante à sp3 do metano. A hibridação sp2 é realizada quando um dos orbitais p não hibrida. Isso acontece em moléculas como a de eteno, na qual há ligação dupla entre carbonos.A fórmula estrutural dessa molécula é algo parecido com a mostrada aqui:
Não são todos os orbitais que hibridam, pois os orbitais híbridos formam apenas ligações σ. Já que as ligações duplas são formadas por ligações pi, é necessário um orbital "puro" para a ligação dupla entre os carbonos, por este motivo a hibridização em sp² permite a dupla ligação. Sua distribuição eletrônica ficará algo como esta abaixo.
Cada tipo de hibridização do carbono acarreta em uma diferente geometria ao redor do átomo do carbono, podendo esta ser tetraédrica (sp³), trigonal plana (sp²) ou linear (sp), possuindo assim um ângulo entre os ligantes de, respectivamente, 109°28', 120° ou 180°.




