Estereoquímica
Esta página ou seção foi marcada para revisão devido a incoerências ou dados de confiabilidade duvidosa. |
A estereoquímica é uma subdisciplina da química que estuda a disposição espacial relativa dos átomos que formam a estrutura das moléculas.[1] O principal estudo da estereoquímica são os estereoisômeros, moléculas que têm a mesma fórmula molecular e sequência de átomos ligados (constituição), mas diferem nas orientações tridimensionais de seus átomos no espaço. Por esse motivo, também é conhecido como química 3D - o prefixo "estéreo" significa "tridimensionalidade".
Um ramo importante da estereoquímica é o estudo de moléculas quirais. A estereoquímica abrange todo o espectro da química orgânica, inorgânica, biológica, física e especialmente supramolecular. A estereoquímica inclui métodos para determinar e descrever esses relacionamentos; o efeito nas propriedades físicas ou biológicas que essas relações transmitem às moléculas em questão e a maneira pela qual essas relações influenciam a reatividade das moléculas em questão (estereoquímica dinâmica).
Isômeros[editar | editar código-fonte]
Moléculas que possuam a mesma fórmula molecular, porém com os seus átomos em distintos arranjos espaciais são chamadas isômeros. Pode falar-se em isomerismo constitucional (ou estrutural) e isomerismo espacial (que levará ao caso dos estereoisômeros).
Isomerismo constitucional dá-se quando a conectividade entre os átomos é distinta e os isômeros já se diferenciam numa projeção bidimensional. O isomerismo espacial, por sua vez, é dividido em conformacional e configuracional e os isômeros só se diferenciam na disposição relativa dos átomos e, portanto, diferenças só serão observadas no espaço tridimensional.
Estereoisômeros[editar | editar código-fonte]
Os estereoisômeros[1] não são isômeros constitucionais. Os estereoisômeros têm seus átomos ligados na mesma sequência, mas eles diferem no arranjo de seus átomos no espaço. Estereoisômeros (também chamados de isômeros configuracionais) são substâncias diferentes que não se convertem facilmente. Por esta razão, podem ser separados. Há dois tipos de estereoisômeros: enantiômeros e diasteroisômeros.

Diasteroisômeros[editar | editar código-fonte]
Os diasteroisômeros[1] são estereoisômeros cujas moléculas não são imagens especulares uma da outra.
Os isômeros de alqueno cis- e trans-1,2-dicloroeteno e os isômeros cis e trans dos cicloalcanos são exemplos de estereoisômeros que são diastereoisômeros.


Esses dois compostos abaixo são isômeros um do outro, porque são compostos diferentes que não se convertem um no outro e porque tem a mesma fórmula molecular. Eles não são isômeros constitucionais porque seus átomos estão ligados na mesma sequência. Por tanto, são estereoisômeros. Eles diferem apenas no arranjo dos seus átomos no espaço. Como não guardam uma relação objeto imagem especular são diastereoisômeros.


Enantiômeros[editar | editar código-fonte]
Os enantiômeros[1] são estereoisômeros cujas moléculas são imagens especulares não sobreponíveis.
Todo estereoisômero do tipo enantiômero é um isômero ótico, no entanto, nem todo isômero ótico é um enantiômero. Pode ser oticamente ativo e representar um isômero do tipo diastereoisômero.
Enantiômeros ocorrem apenas com compostos cujas moléculas são quirais. Uma molécula quiral é definida com uma que não é idêntica a sua imagem no espelho. Uma molécula quiral e sua imagem especular são enantiômero.
A palavra quiral vem da palavra grega cheir, que significa “mão”. Objetos quirais (incluindo moléculas) possuem um lado direito e um esquerdo. O termo quiral é usado é utilizado para descrever moléculas de enantiômeros porque estão relacionadas uma com a outra da mesma maneira que a mão direita está relacionada com a mão esquerda. Assim, significando moléculas assimétricas. Quando você olha sua mão esquerda no espelho a imagem que você vê no espelho é a da mão direita e vice-versa. Suas mãos esquerda e direita não são idênticas, e isso pode ser mostrado pela observação que elas não se superpõe. A imagem especular da mão esquerda é a mão direita. No entanto, a mão direita e a mão esquerda não são superponíveis. Veja figura abaixo:
Simetria e Estereoquímica[editar | editar código-fonte]
Há uma relação direta entre simetria, quiralidade e estereoquímica. Então, podemos dizer que moléculas que possuem determinados elementos de simetria não são quirais, porque o elemento de simetria assegura que as formas da imagem no espelho (imagem especular) sejam sobreponíveis. O modelo mais comum é um plano de simetria que divide uma molécula em duas metades posicionando de forma idêntica os substituintes em ambos os lados do plano, como veremos mais à frente. Um exemplo trivial pode ser encontrado em qualquer átomo tetraédrico com dois substituintes idênticos, como, por exemplo, em 2-propanol. O plano subdivide o 2-OH grupos 2-H e e os dois grupos metilo são idênticos.
Relações entre simetria e quiralidade[editar | editar código-fonte]
Uma das melhores formas de testar a quiralidade molecular é construir modelos estruturais da molécula e sua imagem especular e, em seguida, determinar se eles são sobreponíveis. Se os dois modelos são sobreponíveis, a molécula que eles representam é aquiral. Se os modelos não são sobreponíveis, então as moléculas que eles representam são quirais. Nós podemos aplicar este método a modelos reais, como acabamos de descrever, ou podemos aplicá-lo desenhando estruturas tridimensionais e tentando sobrepô-las em nossas mentes. Existem outras formas, no entanto, de nos ajudar a reconhecer a quiralidade de uma determinada molécula. Mencionamos uma já: a presença de um único centro de quiralidade. Outros baseiam-se na ausência de certos elementos de simetria da molécula, que veremos na próxima seção. Abaixo estão algumas informações úteis sobre quiralidade.[2],[1]
1. Uma molécula não será quiral, se ela possuir um plano de simetria.
2. Um plano de simetria (também chamado plano de espelho) é definido como um plano imaginário que bissecta uma molécula, ou seja divide a molécula em duas partes iguais, de tal maneira que as duas metades da molécula são imagens de espelho um do outro.[2],[1]
Um exemplo de uma molécula aquiral podemos citar o 2-cloropropano, que apresenta um plano de simetria, enquanto que 2-clorobutano é uma molécula quiral, não apresenta plano de simetria.[1]
Isso indica que todas as moléculas com um plano de simetria em sua conformação são aquirais.
Elementos e operações básicas de simetria[editar | editar código-fonte]
Uma operação que torna uma molécula indistinguível da original depois de aplicada é chamada de operação de simetria.
Podemos considerar quatro operações de simetria:
- A rotação em torno de um eixo de simetria (Cn)
- Reflexão (s)
- Inversão (i)
- Rotação – reflexão (Sn) : esse tipo de operação envolve duas manipulações, uma rotação de 360°/n sobre um eixo designado Sn, e uma reflexão por um plano perpendicular ao eixo Sn que atravessa a molécula (plano de simetria)
Para cada operação de simetria existe um elemento de simetria correspondente, que se delimita como um ponto, uma linha, (eixo) ou um plano, em referência a operação.
Os elementos de simetria são:
- Eixos de rotação (Cn)
- Operação Identidade (E)
- Eixos de simetria (σ)
- Centros de simetria ou centro de inversão (i)
- Eixo rotação – reflexão (Sn), também chamado eixo espelho, ou eixos impróprios
Rotação em torno de um eixo de simetria (Cn)[editar | editar código-fonte]
A existência de um eixo de rotação Cn (n eixos de rotação) em uma molécula implica que se esta gira com uma rotação de 360°/n ao redor deste eixo de modo que o arranjo dos átomos da molécula não será alterado, ou seja, o arranjo não será distinguido do original. Por exemplo, pode-se girar o cis-dicloroeteno a 180º por um eixo perpendicular ao plano da ligação dupla que passa através do ponto médio do mesmo e a molécula permanecerá inalterada.
Outros exemplos que podemos destacar para identificar o eixo de rotação: a molécula de água tem dois eixos de simetria (C2), e o clorofórmio tem um eixo C3. Benzeno tem um eixo C6 perpendicular ao plano da molécula e atravessando o centro geométrico, e seis eixos C2 adicionais que se cruzam no plano molecular.
Quando "n" é n = 360/180 = 2 dizemos que é um eixo de simetria de ordem 2, nesse caso C2. Quando uma molécula existir em mais de um eixo quer dizer que a ordem mais elevada (de maior "n") é a principal. No exemplo acima, para o benzeno o eixo de maior n é o C6, então prevalece como sendo seu eixo de simetria.[2],[1]
Identidade (E)[editar | editar código-fonte]
Identidade é a operação de rodar o objeto a 360°, de modo que este permaneça inalterado e corresponde a um eixo de rotação C1. Deste modo, todo e qualquer objeto tem esse elemento de simetria. Dizemos que as moléculas que apresentam apenas esse tipo de elemento de simetria são moléculas assimétricas.[1][2]
Reflexão de um plano de simetria (σ)[editar | editar código-fonte]
A reflexão (operação de simetria) num plano de simetria σ (elemento de simetria correspondente), gera uma imagem geométrica da molécula no espelho, esta operação não se aplica a moléculas quirais.
Se consideramos o plano de simetria e o centro geométrico, podemos analisar relações entre os eixos de rotação e planos de simetria. Assim, dizemos que um plano de simetria é vertical ao eixo principal e o designamos de plano vertical (σv) quando este contém o eixo principal de rotação. Se um plano é perpendicular ao eixo principal de rotação e atravessa a molécula no centro geométrico, dizemos que é um plano horizontal (σh). Se o plano é paralelo ao eixo principal e bissecta o ângulo formado por dois eixos de rotação C2 dizemos que é um plano diagonal (σd).[1][2]
Centros de simetria ou centro de inversão (i)[editar | editar código-fonte]
Uma inversão envolve o movimento de cada átomo através do centro da molécula, esse elemento coincide com o centro geométrico da molécula. Qualquer ponto da molécula leva até seu centro e depois move-a com a mesma distância percorrida, no entanto, no sentido oposto da molécula. Inversão é equivalente a operação S2, mas distingue-se através pelo símbolo ”i”.[1][2]
Eixo de rotação - reflexão (Sn)[editar | editar código-fonte]
Uma rotação-reflexão, também chamado eixo espelho, ou eixos impróprios consiste em uma rotação seguida de uma reflexão através do plano perpendicular do eixo de rotação. Por exemplo, se girarmos um molécula que contém 3 carbonos por 2/4 sobre o eixo destes três átomos e então refletirmos através do plano perpendicular contendo o átomo de carbono central, o resultado seria uma rotação imprópria S4.[1][2]
Muito simplesmente, se tomarmos como referência uma molécula rígida (ou objeto de qualquer tipo), um critério necessário e suficiente para identificar a sua quiralidade é uma ausência de eixos Sn; a existência de qualquer eixo Sn torna um objeto aquiral. As moléculas quirais não precisam ser assimétricas. Assimétrico é definida como a ausência completa de simetria. No entanto, muitas moléculas quirais podem ter um ou mais eixos de rotação adequados – mas apenas eixos impróprios estão presentes. Compostos como estes podem ser referidos como dissimétrico, sinônimo de quiral. Assim, enquanto todos os compostos assimétrico são moléculas quirais, nem todas as moléculas quirais são assimétricos.[2][3]
Isomeria configuracional[editar | editar código-fonte]
Introdução[editar | editar código-fonte]
No século XIX o mineralogista francês René Just Haüy constatou a existência de dois cristais de quartzo que eram diferentes apenas na posição de duas faces. Estes cristais eram imagens especulares um do outro e não eram superponíveis. Foram assim denominados enantiomorfos. Não apenas os cristais, mas vários seres vivos, objetos e moléculas possuem enantiomorfos. O termo quiral vem da palavra grega cheir que significa mão, e ao colocar uma palma sobre a outra(faça isso com as palmas voltadas para o seu rosto) verá que não se superpõem, ou seja, os dedos serão opostos, com exceção do dedo médio. Algumas plantas como a trepadeira da espécie Convolvus arvensis enrosca-se para a direita; já a Lonicera sempervirens enrosca-se para a esquerda.
Luz natural e luz polarizada[editar | editar código-fonte]
A luz natural é formada por ondas eletromagnéticas, sendo que as ondas elétricas vibram em um plano e as magnéticas em outro, mas perpendicular ao primeiro.Uma luz ou radiação que não foi polarizada é denominada comum e se propaga por todas as direções; já a luz polarizada se propaga em uma única direção.
Polaroides e Polarímetro[editar | editar código-fonte]
Há várias maneiras de polarizar a luz e a mais simples é o uso de um polaroide, o qual possui cristais de substâncias orgânicas complexas depositados sobre o material plástico transparente, estas estão organizadas em determinadas posições que assim que a luz ou radiação comum passar, esta irá ser polarizada ou seja, vibrará apenas em uma única direção. O polarímetro é um instrumento científico o qual possui em seu interior um prisma de Nicol(CaCO3) uma fonte de radiação(lâmpada de sódio) e um recipiente para a amostra. Quando a luz despolarizada passa por um prisma de Nicol, é polariza, esta segue para o recipiente onde está a amostra dissolvida com um solvente que não causa interferência na polarização da luz. Quando a luz sai do recipiente a radiação chega ao observador, indicando um desvio no plano de sua propagação e este é medido em graus. Nas unidades produtoras de açúcar (usinas de açúcar e álcool) o polarímetro também podem ser chamado de sacarímetro, e este é usado para medir a quantidade de açúcar de uma amostra,e o resultado é expressado em uma unidade denominada Pol. Se a luz observada causar um desvio da luz polariza para a direita esta é denominada dextrógera e na nomenclatura apresenta(+)antes do nome do composto o qual segundo a IUPAC descreverá tal propriedade apresentada acima.Sendo o desvio para a esquerda esta é denominada levógira,sendo assim o símbolo(-)antes do nome do composto para indicar tal propriedade.
Compostos opticamente ativos[editar | editar código-fonte]
Em 1848 Louis Pasteur, trabalhava com cristais do ácido tartárico que se depositavam no fundo dos barris de vinhos durante a fermentação, quando Pauster preparou uma solução aquosa deste composto e analisou-o em um polarímetro, observou que esta solução desviava a luz para a direita, determinando assim este composto como dextrógiro e opticamente ativa. Preparou outra solução com outros cristais e esta não causou nenhum desvio, o que a caracterizou como opticamente inativa. Pauster dissolveu novamente este cristais inativos e recristalizou-os na forma de sal de amônio e sódio, e foram formados dois novos tipos de cristais que foram separados por uma pinça por Pauster. Estes cristais eram enatiomorfos, ou seja eram imagens especulares.
Poder rotatório específico[editar | editar código-fonte]
=
O ângulo de desvio do plano da luz polarizada que ocorre em uma solução opticamente ativa é representada pela fórmula descrita acima
onde:
20° é a temperatura da solução em graus Celsius.
D representa a transição eletrônica ou raia, que resulta na radiação do comprimento de onda = 583 nm de uma lâmpada de sódio.
C é a concentração da solução em g/ml.
d é o comprimento do tubo do polarímetro por onde a luz atravessa a solução a qual é expressa em cm.
Notação Estereoquímica[editar | editar código-fonte]
Um importante aspecto da estrutura química é sua configuração, isto é, o arranjo tridimensional de seus átomos. O objetivo dos estereodescritores é promover uma identificação concisa e sem ambiguidade [4].
Notação Absoluta[editar | editar código-fonte]
A configuração absoluta de uma molécula quiral está relacionada à estrutura tridimensional exata dos átomos ligados ao seu centro estereogênico, podendo ser representada por projeções de Fischer e designada pelas letras R e S, que são representações das palavras latinas rectus e sinister, significando direito e esquerdo, respectivamente.[4],[5]
A convenção do sistema R,S de Cahn-Ingold-Prelog, segue as ordem de prioridade estabelecida nos números atômicos e/ou número de massas para isótopos, do grupo de átomos que compõem o centro de quiralidade [5].
O substituinte de maior prioridade é aquele com maior número atômico, ou maior número de massa no caso de isótopos. Se o centro quiral possui dois átomos de idênticos ligados a ele, então percorre-se as cadeias até encontrar um ponto de diferença e, atribui-se prioridade aos átomos diferentes [6].


Para realizar a leitura posiciona-se o grupo de menor prioridade para trás, afastando-se do leitor, no momento da leitura. Lê-se os grupos em ordem decrescente de prioridade.[1] Caso a ordem de prioridade girar no sentido horário, o isômero será designado R. Se ao seguir do grupo de maior prioridade para o de menor, a direção da rotação for anti-horária, denominamos a molécula como S.[4]

Quando a estrutura apresente ligações duplas ou triplas, estas são tratadas como ligações simples e os átomos são duplicados.[4]

Estereodescritores para alcenos[editar | editar código-fonte]
A hibridização sp2 dos átomos de carbono em uma dupla ligação provoca um arranjo planar em seus átomos e não permite rotação. Quando os substituintes dos dois carbonos não são iguais, a posição que os ligantes assumem é relevante, pois dão origem a compostos diferentes. Para nomear essas estruturas utiliza-se notações cis e trans ou E e Z. [6]

Quando há apenas dois substituintes diferentes, utiliza-se a notação cis e trans. O isômero com ambos os substituintes no mesmo lado são chamados de cis, enquanto que o isômero com substituintes opostos são denominados trans.[6]
Entretanto, quando há mais de dois substituintes no alceno, essa notação se torna ambígua. Existe a notação E-Z que é capaz de ser aplicada a todos os sistemas, sem que as designações gerem dúvidas.[6]
Os estereodescritores E-Z também é baseado nas regras de prioridade de Cahn-Ingold-Prelog, citada anteriormente.[7]

Quando a prioridade for atribuída, o isômero que apresentar as maiores prioridades no mesmo lado é chamado isômero Z. Se os grupos com maiores prioridades estiverem em lados opostos, o isômero é denominado E. As letras são de origem alemã, E representa a palavra entgegen, que significa “opostos” e Z refere-se a zusammen, que quer dizer “juntos”.[4]
Assim como em uma dupla ligação onde os substituintes podem estar no mesmo lado ou opostos, em um composto cíclico isto também pode ocorrer. Os arranjos são de configurações diferentes e, portanto não podem ser modificadas a menos que haja quebra ou formação de pelo menos uma ligação.[6]
Alguns átomos possuem um par de elétrons ao invés de um substituinte. Par de elétrons são atribuídos a baixa prioridade pela conversão de Cahn-Ingold-Prelog. Assim, as atribuições de configuração E-Z para compostos como iminas e oximas segue as mesma regras com R ou H > par de elétron.[6]

Sistema com múltiplos centros estereogênicos[editar | editar código-fonte]
As moléculas podem ter vários centros estereogênicos, como por exemplo, para o (2R,3R)-2-3-dibromobutano. Para determinar a configuração absoluta, considera-se cada centro separadamente e cada centro é especificada como R e S. O grupamento contendo o segundo centro estereogênico é considerado como um substituinte[6].
Um composto que contém mais de um centro estereogênico, mas é sobreponível à sua imagem especular é chamado de composto meso.

Estereodescritores para moléculas cíclicas[editar | editar código-fonte]
O ácido 2,2-dimetilciclopropanocarboxílico (A) tem um centro quiral em C(1) e existe como um par de enantiômeros e seu estereoisomerismo não se difere de moléculas quirais acíclicas. O mesmo ocorre no ácido ciclopropano-1,2-dicarboxílico que tem três estereoisômeros: uma forma meso (B) e um par de enantiômeros (C, D) diastereoméricos com a forma meso [8].
Entretanto, uma característica adicional devido a rigidez da estrutura cíclica é que como substituintes podem estar no mesmo lado de uma ligação dupla ou mesmo oposto, o mesmo pode ocorrer em moléculas cíclicas [6], [8]. Como por exemplo, no diácido meso B, os grupos carboxila estão no mesmo lado do anel e nos enantiômeros C e D estão em lados opostos. Por isso, pode-se chamar de cis a forma meso e de trans os dois isômeros quirais [8].

Estereoisômeros também surgem quando dois anéis compartilham um vínculo comum. No isômero cis ambas os ramificações do anel fundido estão no mesmo lado e no isômero trans, estão em lados opostos. Como por exemplo, o composto formado pela junção de dois anéis do ciclohexano, a decalina, apresenta isomeria cis-trans; na cis-decalina, os dois átomos de hidrogênios, ligados aos átomos da cabeça de ponte, estão no mesmo lado do anel, enquanto que na trans-decalina, eles estão em lados opostos [6].

O Sistema de notação R-S de Cahn-Ingold-Prelog (CIP) pode ser naturalmente utilizada em compostos cíclicos [8], [9]. Compostos nos quais um centro de quiralidade faz parte de um anel são tratados de forma semelhante ao de moléculas acíclicas. Por exemplo, para determinar se a configuração do (+)-4-metilciclohexeno é R ou S, são tratados caminhos horário e anti-horário ao redor do anel como se eles fossem grupos independentes [9].

Com o grupo de classificação mais baixa (hidrogênio) direcionado para o lado contrário ao nosso, observamos que a precedência decrescente da regra de sequência é horária e por isso a configuração absoluta é R [9].
Aplicando o sistema CIP nas moléculas A, B, C e D tem-se que A é R, a forma meso B é 1R,2S (equivalente a 1S,2R), e os enantiômeros C e D são 1S,2S e 1R,2R, respectivamente.
O sistema CIP é sempre inequívoco, todavia quando se trata de diastereômeros a nomenclatura cis e trans é mais fácil de entender.
Infelizmente a nomenclatura cis-trans pode causar ambiguidade, como por exemplo, o composto A’ causaria dúvidas se deveria ser chamado de ácido cis ou trans-2-hidroxi-2-fenilciclopropanocarboxílico. Por isso, opta-se utilizar a regra em que o substituinte referência é marcado com o prefixo r- e as posições dos outros substituintes são denotados como cis (c-) ou trans (t-) em relação a ele. Assim, como o composto A’ é um ácido ciclopropanocarboxílico, o carbono no qual o grupo CO2H está ligado é o carbono de referência e o composto é chamado de ácido t-2-hidroxi-2-fenilciclopropano-r-1-carboxílico ou ácido t-2-hidroxi-2-fenil-r-1-ciclopropanocarboxílico (o símbolo c do grupo fenil foi omitido já que necessariamente seguiria esta posição devido o grupo hidroxi estar na posição trans). Deve-se observar que mesmo se o nome e a numeração for atribuída de forma incorreta a utilização do símbolo r- garante que a estereoquímica correta possa ser derivada de forma inequívoca a partir do nome dado.
O prefixo r também é muito útil quando se tem mais de dois centros estereogênicos no anel, como ocorre em B’. Pode haver confusão já que os substituintes cloro são trans em relação ao grupo carboxila, mas cis em relação um ao outro. No entanto, o nome de ácido t-2,t-3-diclorociclopropano-r-1-carboxílico é inequívoco, e neste caso o ponto de referência é o grupo ácido carboxílico e os dois substituintes cloro são trans em relação a ele.
No caso do isômero C’ para saber como os carbonos do anel serão numerados deve-se utilizar a regra em que o cis precede o trans de modo que o composto é chamado de ácido c-2,t-3-diclorociclopropano-r-1-carboxílico (ou ácido c-2,t-3-dicloro-r-1-ciclopropanocarboxílico.
Já o comporto D’ que não possui nenhum sufixo (tais como ácido carboxílico, carboxaldeído, -carbinol, ou –ol) em seu nome deve-se utilizar como carbono de referência aquele substituído com o grupo de prioridade mais elevada (CIP) que neste caso é o Br, com isso o nome correto é r-1-bromo-1-cloro-c-2-etil-2-metilciclopropano [8].

Quando não se sabe se um substituinte de um ciclo é cis ou trans em relação aos outros substituintes usa-se uma linha ondulada, e o símbolo utilizado para tal substituinte é ε (xi grego) em vez de c ou t.

Em um anel de quatro membros uma nova característica surge: o estereoisomerismo em ciclobutanos 1,2-dissubstituídos (A’’) é análogo aos dos ciclopropanos 1,2-dissubstituídos, mas os ciclobutanos 1,3-dissubstituídos apesar de existirem como diastereômeros cis (B”) e trans (C”), B” e C” são aquirais, onde C(1) e C(3) são estereogênicos mas não quirotópicos, eles não possuem centros quirais. Por isso, não deve-se chamar de formas meso de diastereômeros, na medida em que o conjunto não contém quaisquer isômeros quirais.

Entretanto, no caso de, por exemplo, 1,3-ciclobutanodiols os carbonos C(1) e C(3) podem ainda serem chamados de centros pseudo-assimétricos no sentido de que os dois – CH2CHOHCH2- ligados a cada um destes centros são enantiomórficos. Para atribuir descritores pseudo-assimétricos a C(1) e C(3) os segmentos C(2), C(3), C(4) e C(4), C(3), C(2) são separados do centro quiral das suas extremidades. Descritores de quiralidade auxiliares (marcados pelo sufixo zero) podem ser atribuídos a C(3) em dois segmentos, que são agora novos substituintes de C(1). Estes símbolos irão definir uma prioridade para os dois segmentos, e portanto permite atribuir descritor pseudo-assimétrico (r ou s) em C(1). [Os descritores suportam o sufixo n (novo) porque eles surgiram a partir de 1982 com a modificação do Sistema CIP]. O símbolo em C(1) para o isômero cis fica sn. O descritor em C(3) deve ser determinado de forma independente, mas uma vez que a molécula tem um eixo C2 em intercâmbio com C(1) e C(3) este deve ser o mesmo que em C(1). O isômero cis é portanto 1sn ,3sn. Já para o isômero trans ficaria 1rn,3rn [8].

Antes que se possa determinar descritores cis-trans de substituintes do anel, deve-se decidir se os substituintes estão no mesmo lado (cis) ou em lados opostos (trans). Nos ciclohexanos substituídos, em que o anel geralmente está na forma de cadeira existem alguns problemas. A relação trans em A* (diaxial 1,4-dissubstiuídos) é óbvia, mas a relação em B* (diequatorial 1,4-dissubstituídos) é menos óbvia.
Já no ciclohexano C* 1,2-diequatorial trans-dissubstituído o ângulo de torção é cerca de 60°, assim como no isômero cis-dissubstituído D*. Para determinar a relação trans em B* e C* pode-se focar nos átomos dos hidrogênios terciários (em vez dos substituintes x e y), ou pode-se dizer que os grupos são cis se ambos estiverem para cima (ou para baixo) e trans se um estiver para cima e o outro para baixo [8].

Estereodescritores Adicionais[editar | editar código-fonte]
Anti e Sin[editar | editar código-fonte]
Os isômeros com mais de um centro estereogênico também podem ser caracterizados como sin ou anti. Dois substituintes apontados na mesma direção (ou face) são chamados de sin, porém quando estão apontados em direções diferentes são chamados de anti.[6]

Erythro e Threo[editar | editar código-fonte]
Para compostos de cadeia aberta, os prefixos Erythro e Threo são aplicados a sistemas que contém dois carbonos estereogênicos, quando dois grupos substituintes são iguais e um terceiro é diferente[4].

O prefixo Erythro possui os grupos do mesmo lado quando desenhado na projeção de Fisher. Na estrutura Threo, os grupos estão em lados opostos.[7]
D e L[editar | editar código-fonte]
Essa nomenclatura é utilizada para caracterizar isômeros que apresentam atividade óptica.

Os prefixos D e L são derivados das palavras dextrógiro (do latim dexter, direito) e levógiro (do latim laevus, esquerda) respectivamente e, indicam para qual lado o isômero é capaz de desviar o plano da luz polarizada.[1]
Os descritores D e L pode ser utilizada para a denominação da posição dos substituintes nas projeções de Fisher. Nelas, os substituintes quando desenhados no lado esquerdo da linha vertical são chamados de L, enquanto os desenhados no lado direto são chamados de D.[6]
Alfa (α) e Beta (β)[editar | editar código-fonte]

Os termos α e β são utilizados para descrever a estereoquímica de esteroides e carboidratos. Uma molécula α é aquela em que a hidroxila se encontra abaixo do plano de projeção do sistema anular.[7]
Já o descritor β é aquele que apresenta uma hidroxila acima do plano de projeção do sistema anular.[4]
Endo e Exo[editar | editar código-fonte]
Os termos Endo e Exo são usualmente utilizados para nomear sistemas bicíclicos. O substituinte endo se orienta distanciando-se da ponte estrutural e, o substituinte exo se orienta aproximando-se da ponte.[5]

Faces Re e Si[editar | editar código-fonte]
Os descritores R e S são os mais utilizados para descrever a quiralidade dos átomos de carbono assimétricos. No caso de carbonos trigonais com hibridização sp2 – que não possuem centros quirais, mas são considerados centros pró-quirais se estão ligados a três diferentes átomos – pode-se distinguir entre as duas faces da molécula empregando-se o sistema de prioridade utilizado nos descritores R/S.[7] A face Re é aquela em que o sistema de prioridade gira no sentido horário e a face Si no sentido anti-horário.

Pró-quiralidade[10][editar | editar código-fonte]
Heterotopicidade[editar | editar código-fonte]
Dois ou mais ligantes podem ser idênticos quando olhados separados (por exemplo, vários átomos de hidrogênio, os grupos metil, átomos de flúor, etc.). E sem dúvida ser efetivamente distintos devido à sua posição na molécula. Esses substituintes são denominados heterotópicos, ou seja, distintos pelo lugar que ocupam.
Um exemplo são os metilenos no 2-bromo-etanol, que são distintos para a posição que ocupam na molécula: um unido ao bromo e o outro unido à hidroxila; diz-se que esses grupos são heterotópicos por constituição.

Mais difícil de reconhecer são os ligantes que diferem por sua orientação no espaço dentro da molécula; estes são denominados ligantes estereoheterotópicos, e sua não equivalência estereoquímica é de suma importância, pois da lugar a diferenças notáveis em sua reatividade química e em seu comportamento espectroscópio.
Para decidir se os ligantes em questão são heterotópicos ou homotópicos se aplicam os critérios de substituição ou de simetria. Quando a substituição, primeiro de um e depois do outro, de dois (ou mais) ligantes dá lugar a produtos isoméricos, então tais ligantes não são homotópicos (equivalentes), mas sim, heterotópicos. Se esta não equivalência é de origem constitucional (como no caso do 2-bromo-etanol), então os ligantes ou grupos heterotópicos por constituição. Em contraste, os ligantes estereoheterotópicos podem ser enantiotópicos ou diastereotópicos dependendo se sua substituição, em separado, dá lugar a produtos enantioméricos ou estereoisoméricos.
Assim, os hidrogênios α no ácido propiônico 1a são enantiotópicos, visto que sua substituição por bromo produz ácidos enantioméricos (R)- ou (S)-α-bromo propiônicos. Por outro lado, os hidrogênios α no ácido 3-bromobutanoíco (2b) são diastereotópicos, pois sua substituição em separado os ácidos diastereoméricos eritro- ou treo-2,3-dibromobutanoíco.
1a. H1 e H2 enantiotópicos:
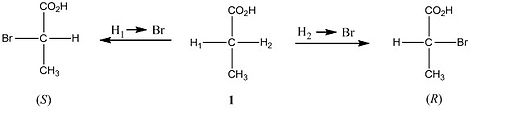
2b. H1 e H2 diastereotópicos:

Finalmente os dois hidrogênios no cloreto de metila (3c) são homotópicos, pois sua substituição conduz ao mesmo bromo diclorometano (esta molécula não possui estereoisômeros).
3c. H1 e H2 homotópicos:

As moléculas 1-3 também são úteis para demonstrar o critério de simetria. Assim, os ligantes que são trocados por rotação por um eixo de simetria (Cn) são indistinguíveis e, portanto, homotópicos. H 1 e H2 em 3 pode mudar-se mediante a um giro de 180˚ em torno do eixo de simetria C2. Da mesma maneira, os três hidrogênios do cloreto de metila são homotópicos, pois são intercambiáveis por meio da operação C3.

Os ligantes enantiotópicos não são intercambiáveis por rotação em torno de um eixo de simetria, mas sim, por reflexão em um plano de simetria (σ). A figura abaixo mostra tal plano em 1, que interconverte H1 e H2.

Em contraste, os ligantes diastereotópicos não se intercambiam mediante a alguma operação de simetria.

Centros Pró-quirais[6][editar | editar código-fonte]
Centros pró-quirais tem dois ligantes idênticos, tais como dois hidrogênios, e são aquirais. Em muitas situações, no entanto, estes ligantes idênticos são topologicamente heterotópicos. Se qualquer um dos grupos idênticos é substituído por um ligando diferente, um centro estereogênico é criado. As duas posições são chamados enantiotópicas. A posição, que se atribuída uma prioridade mais elevada, dá uma configuração R é chamado pro-R. A posição, que se atribuída uma prioridade mais elevada, proporciona uma configuração S é chamado pro-S. Propano-1,3-diol é um exemplo de uma molécula pró-quiral. O C (1) e C (3) As posições são pró-quirais, mas a C (2) não é, por causa dos seus dois ligantes hidroximetil são idênticos.
O grupamento carbonila substituídos assimetricamente são centros pró-quirais, uma vez que a adição de um quarto ligante gera um centro estereogênico. Estes são designados por determinar a ordem de prioridade de Cahn-Ingold-Prelog. O grupo carbonila é dito que tem uma face re e uma face si.
Reagentes aquirais não fazem distinção entre as duas faces, mas reagentes quirais distinguem e há formação de quantidades desiguais de produtos enantioméricos. Outros centros trigonais, incluindo ligações duplas carbono-carbono, apresentam duas faces pró-quirais. Por exemplo, E- e Z - ácido-butenodióíco (ácido maleico e fumárico) geraram diferentes estereoisômeros quando submetido a syn-di-hidroxilação. Se o reagente utilizado é quiral, o isômero irá gerar quantidades diferentes de R, R e produtos S, S. As formas S, R e R,S geradas a partir do isômero Z são formas meso e vão ser aquirais, mesmo se elas são formadas utilizando um reagente quiral.
O conceito de centros heterotópicos pode ser estendido para grupos diastereotópicos. Se um dos dois ligantes equivalentes numa molécula é substituído por um grupo de teste, os ligantes são diastereotópicos quando as moléculas resultantes são diasteroisômeros. Da mesma forma, se uma transformação em faces opostas de um centro trigonal gera dois diastereoisômeros diferentes, as faces são diasterotópicas. Há uma diferença importante entre centros enantiotópicos e centros diastereotópicos. Dois ligantes idênticos em centros enantiotópicos estão em ambientes quimicamente equivalentes. Eles respondem de forma idêntica às sondas, incluindo reagentes químicos, que são aquirais. Eles respondem diferentemente às sondas quirais, incluindo reagentes quirais. Centros diastereotópicos são topologicamente não equivalentes. Isto é, os seus ambientes na molécula são diferentes e que respondem de forma diferente a aquiral, bem como para as sondas e reagentes quirais. Como uma consequência disto, prótons diastereotópicos, por exemplo, possui diferentes desvios químicos e são distinguíveis em espectros de RMN. Prótons enantiotópicos não mostram sinais de RMN separadas. Dois protões diastereotópicos dão origem a um padrão mais complexo de RMN. Devido à sua diferença de desvio químico, que mostra um acoplamento geminado. Um exemplo deste efeito pode ser observado nos espectros de RMN de próton de 1-fenil-2-butanol.
A C(1) grupo CH2 aparece como um multipleto perto de 2,8 ppm com acoplamento adicional para a C (2) de próton. O C (1) átomos de hidrogênio são diastereotópicos. Os C (3) hidrogênios são também diastereotópicos, mas a sua não-identidade não é óbvio no multipleto a cerca de 1,6 ppm. Como as reações biológicas envolvem enzimas quirais, grupos enantiotópicos e faces tipicamente mostram reatividade diferente. Por exemplo, os dois hidrogênios do metileno em etanol são enantiotópicos. As enzimas que oxidam o etanol, chamados álcool desidrogenases, removem seletivamente o hidrogênio pró-R. Isto pode ser demonstrado utilizando um análogo deuterado de etanol na reação.
Quiralidade[editar | editar código-fonte]
A propriedade de não superponibilidade de um objeto com a sua imagem especular é chamada de quiralidade. Uma molécula é quiral se ela não é superponível em sua imagem especular, por outro lado, se ela é superponível em sua imagem especular ela é chamada de aquiral [3].
Se um átomo de carbono contêm quatro grupos diferentes ligados a ele, este não terá um plano de simetria e deverá ser quiral (centro estereogênico) e a molécula que não apresenta este plano de simetria é dita ser aquiral [11].
A relação entre quiralidade e atividade óptica é absoluta e em cada caso de atividade óptica de um composto puro existem dois e somente dois isômeros, chamados enantiômeros, os quais diferem em sua estrutura somente a lateralidade esquerda e direita de suas orientações. Os enantiômeros possuem propriedades físicas e químicas idênticas exceto em dois importantes aspectos:[3]
- Eles rotacionam a luz do plano polarizada em direções opostas, embora em quantidades iguais. O isômero que rotaciona o plano para a esquerda (sentido anti-horário) é chamado de isômero levo-rotatório e é designado (-) enquanto o que rotaciona o plano para a direita (sentido horário) é chamado de isômero dextro-rotatório e é designado (+). Pelo fato de diferirem nesta propriedade eles são frequentemente chamados de antípodas ópticos.
- Eles reagem a taxas diferentes com outros compostos quirais. Estas taxas podem diferir de maneira irrelevante ou de maneira relevante como no caso em que um enantiômero participa com uma velocidade conveniente da reação e o outro não reage completamente. Por esta razão muitos compostos são biologicamente ativos enquanto os seus enantiômeros não são. Os enântiômeros reagem com mesma taxa com moléculas aquirais.
O ácido láctico (CH3C*HOHCO2H) serve como um dos primeiros exemplos conhecidos de um composto que possui um átomo de carbono quiral (o carbono com asterisco indica onde a quiralidade está localizada). Enquanto o ácido láctico produzido a partir da fermentação do leite estragado é levo-rotatório (-) o ácido láctico produzido a partir do exercício muscular é dextro-rotatório (+). A síntese orgânica do ácido láctico tipicamente resulta em uma mistura racêmica (50:50) de ambos os enantiômeros [(±)-ácido láctico]. As formas levo-rotatório e dextro-rotatório do ácido láctico são ditos serem imagens especulares um do outro [12].

Conforme o número de átomos de carbono com assimetria (quiralidade) aumenta na molécula o número de possibilidades de isômeros ópticos também aumenta. Por exemplo, quando temos um composto que apresenta dois átomos de carbono quiral, quatro possibilidades de configuração absoluta são possíveis (a regra geral para determinar o número máximo de estereoisômeros é 2n, onde n é o número de carbonos quiral). Eles são compostos por dois pares de enantiômeros [13].
A mistura de quantidades iguais dos enantiômeros é chamada de mistura racêmica. Este princípio é muito importante e devemos nos lembrar que uma reação em que temos os materiais de partida aquirais os seus produtos quirais formará uma mistura racêmica dos dois enantiômeros [14].


Quiralidade x bioatividade[editar | editar código-fonte]
A maioria dos químicos está familiarizada com o papel da quiralidade em odorantes, tais como (4S) - (+) - carvona, que tem um odor distinto de alcarávia, em comparação com o (4R) - (-) - carvona, que tem um odor característico de hortelã doce. Estes dois odorantes possuem diferentes odores devido ao papel de quiralidade na bioatividade e embora o papel de quiralidade na percepção do odor seja uma área moderna e pouco estudada, deve se notar que mais de 285 pares de enantiômeros (570 enantiômeros) são conhecidos por apresentar odor ou intensidades diferentes de odor.[15].
Na área dos herbicidas que possuem centro estereogênico quiral temos como um exemplo o enantiômero (R)-(+) do herbicida diclorprop-p (bem como o enantiômero (R)-(+) de todos os herbicidas do ácido fenoxipropionico) que é o enantiômero ativo responsável por eliminar as ervas daninhas, enquanto que o enantiômero (S)-(-) é inativo como herbicida [13].
A questão da quiralidade também é muito importante na comunicação entre os insetos. Esta se dá geralmente através de susbtâncias voláteis exaladas na atmosfera, que são reconhecidas somente por indivíduos da mesma espécie. Estas substâncias são chamadas de feromônios. Diversos feromônios apresentam centros quirais em suas estruturas e frequentemente apenas um dos enantiômeros é o responsável pela comunicação entre os insetos, embora possa ocorrer eventualmente que pares de enantiômeros sejam igualmente ativos ou que misturas de enantiômeros sejam mais ativas que os mesmos individualmente.
As razões deste reconhecimento molecular estão relacionadas às interações supramoleculares entre o xenobiótico e os receptores biológicos. Estas interações têm a sua origem em forças de Van der Waals, interações dipolo-dipolo, interações eletrônicas e pontes de hidrogênio. Dificilmente um par de enantiômeros estabelecerá com um determinado bioreceptor um mesmo número de interações [16].
Quiralidade em moléculas desprovidas de centros quirais ou estereogênicos[editar | editar código-fonte]
Para uma molécula apresentar quiralidade não é necessário que ela apresente um centro quiral ou estereogênico. Alguns tipos de moléculas como alenos, cumulenos, alquilidenocicloalcanos, espiranos, os chamados atropoisômeros, helicenos e ciclofanos são ditos possuir um “eixo quiral” e não necessariamente um centro quiral. Se esticarmos um tetraedro (que corresponde ao carbono sp3) pelos vértices (a e b com a mão esquerda, c e d com a mão direita) para obtermos a figura alongada mostrada para o caso do aleno. A reta ao longo da qual esticamos o tetraedro (a mesma reta que une os dois carbonos sp2 e o carbono sp do aleno) é o que chamamos de eixo de quiralidade. Uma condição necessária para a quiralidade é que a # b e c # d. Assim, mesmo quando a = c e/ ou d = b, a estrutura mantém a quiralidade, por exemplo, em abC=C=Cab.[8]

Para especificar o senso de quiralidade de uma molécula possuindo um eixo quiral uma sequência adicional é necessária: grupos próximos antecedem grupos distantes. Isto significa que os dois substituintes do extremo mais próximo do eixo têm total prioridade sobre os dois substituintes do extremo mais distante. Assim ao observarmos as estruturas abaixo (exceto a bifenila) a partir do extremo da esquerda e depois fazendo o contrário (na frente, o extremo da direita) notamos que a configuração R ou S não depende de quais extremos escolhemos para ser colocado na frente. No caso da bifenila (atropisômero) o eixo de quiralidade também está presente, é importante notar que os substituintes do anel são explorados de centro para fora, independente da regra citada anteriormente. Então, no anel direito da bifenila a sequência é C-OCH3 > C-H [8].


Moléculas com eixos quirais podem alternativamente serem vistos como hélices e a suas configurações podem ser denotadas como P ou M, de maneira similar a dos isômeros conformacionais. Para esta designação somente os ligantes com alta prioridade na frente e atrás do plano são considerados. Se transformarmos a prioridade do ligante 1 que está na frente para a prioridade traseira do ligante 3 temos o sentido horário, a configuração é P, se for no sentido anti-horário temos a configuração M. Das quatro estruturas apresentadas abaixo, três são aR (nomenclatura para eixo quiral) ou M (nomenclatura para hélice); o espirano é aS ou P. (A corresepondência de aR com M e de aS com P é geral) [8].
Estereoquímica de sistemas de anéis fundidos e em ponte[editar | editar código-fonte]
A química desses sistemas tem sido amplamente estudada (Olah, 1990; Liebman e Greeberg, 1976, entre outros). Esses compostos são de interesse particular, por terem alta tensão, muitos elementos de simetria, etc. É importante saber como a estereoquímica de anéis fundidos afetam a forma geral da molécula, bem como sua estabilidade. Assim como é importante saber que no caso de moléculas do tipo bicíclico em ponte os dois átomos de carbono que formam cada ponte será sempre cis um para o outro, não trans, em relação ao outro anel.
Fusão de anéis[editar | editar código-fonte]
A fórmula geral para anéis fundidos é dada na figura abaixo. O menor e mais tensionado (66,5 kcal/mol) dos casos desse tipo é o biciclo[1.1.0]butano, onde m=n=3.


A estrutura desse biciclo foi determinada por Cox, Wiberg, et al. (1969). A energia de dissociação da ligação C-C do eteno é 84 kcal/mol. Assim, se a energia de deformação do sistema excede esse valor e pode ser aliviado pela quebra de uma ligação simples, a molécula pode existir como um di-radical. Porém, com o biciclo[1.1.0.]butano isso não acontece: além do fato de que a tensão não é suficientemente grande para quebrar uma ligação simples, ou daria como resultado um ciclopropil ou um di-radical ciclobutil. Dos mais conhecidos tipos de sistemas de anéis fundidos temos os isômeros cis e trans de hidrindano, há muito tempo já estudados. O isômero trans (racêmico) tem calor de combustão menor do que o cis (meso), com uma diferença de apenas 1,065 kcal/mol. Supostamente, essa diferença é devido à tensão de fusão do anel no isômero trans ser maior que no cis.
A entropia favorece o isômero cis no hidrindano, mas a diferença é um pouco menor (2,04 cal/mol K-1, com ∆G°= 0,50 kcal/mol, a 25 °C em favor do isômero trans.

Utilizando agora um exemplo de decalina (este nome por terem dez átomos de carbono), também um biciclo, podemos notar a diferença na estereoquímica na forma global da molécula e na quantidade de energia ao comparar a forma cis com a trans.

Mudando a estereoquímica do carbono em ponte a partir de uma "cunha" para formar um "tracejado" faz uma grande diferença na forma global da molécula. Comparando as duas formas, notamos que em trans-decalina, todos os carbonos estão na posição equatorial, enquanto que em cis-decalina, um carbono está em equatorial e o outro em axial. Por estes detalhes, podemos fazer um julgamento sobre a estabilidade relativa destas duas moléculas, onde a trans-decalina é mais estável do que cis-decalina, uma vez que todos os carbonos estão em equatorial. Na cis-decalina observamos duas interações tipo gauche (cada um no valor de cerca de 0,9 kcal/mol), que são responsáveis por esse aumento de energia. Apenas nesta forma cis o anel pode “virar” continuando com as mesmas energias, algo que não pode acontecer na forma trans, uma vez que esta ficaria mais tensionada, perdendo sua “flexibilidade”.

Anéis em ponte[editar | editar código-fonte]
Como foi dito no início desse tópico, é importante saber como forma da molécula é alterada pela estereoquímica. Para anéis em pontes, moléculas do tipo bicíclico, os dois átomos de carbono que formam cada ponte será sempre "cis" um para o outro, não trans, em relação ao outro anel. Isso por causa da falta de flexibilidade na molécula. Por isso, para moléculas bicíclicas desse tipo, a “ponte” deve estar na forma cis em relação ao outro anel. A figura abaixo mostra, à esquerda, o biciclo na forma cis e, à direita, a forma improvável do biciclo trans em ponte.[17]

Nomenclatura[editar | editar código-fonte]
Os biciclos em ponte são nomeados de acordo com um sistema único próprio. Isso se dá com base no comprimento das suas pontes, e, em seguida, o número total de átomos de carbono no biciclo. Abaixo temos o passo-a-passo, juntamente com um esquema detalhado.
1. Identifique o grupo funcional de maior prioridade; este será o sufixo. Conte o número total de carbonos na molécula.
2. Identificar os dois anéis do biciclo; os carbonos “cabeça de ponte” são o ponto de encontro desses dois anéis.
3. Numerando: comece numerando uma “cabeça de ponte” e siga o caminho mais longo até a segunda “cabeça”. Continue numerando pelo caminho mais longo até que todos os átomos de carbonos estejam numerados.
4. Destaque esses caminhos encontrados e conte o número de carbonos encontrados em cada caminho.
5. Então, juntamos os resultados, colocando o termo “biciclo” no início.

Estudo de reações dependentes de efeito estereoeletrônicos[editar | editar código-fonte]
Introdução[editar | editar código-fonte]
A química orgânica fez um importante avanço no entendimento da reatividade química quando ela percebeu a importância da estabilização eletrônica causada pela deslocalização do par de elétrons (ligante e não ligante) nas moléculas orgânicas. Este conceito conduziu ao desenvolvimento da teoria de ressonância para moléculas conjugadas e tem fornecido uma maneira racional para entender a reatividade química (Ingold, 1969). O desenvolvimento da teoria eletrônica da química orgânica combinou a teoria original de Robinson com os desenvolvimentos da teoria conformacional de Barton, que conduziram a teoria estereoletrônica da química orgânica (Deslongchamps, 1983).
Atualmente, evidencias experimentais mostram que esse tipo de interação eletrônica ocorre quando os pares de elétrons estão devidamente orientados no espaço. Muitos resultados indicam que a reatividade da maioria dos tipos de moléculas orgânicas dependem da relativa estereoquímica dos pares de elétrons, ligantes ou não ligantes. É através da consideração do conceito de efeitos estereoeletrônicos que se torna possível adquirir o conhecimento da estereoquímica do estado de transição da maioria das reações orgânicas. Os efeitos estereoletrônicos, que são os efeitos que surgem quando um arranjo espacial de elétrons, orbitais ou ligações é mais estável que outro, contribuem para a orientação do produto a serem formados em uma determinada reação (kirby, 1996).
Em uma molécula, os efeitos estereoeletrônicos conduzem geralmente a uma conformação de mais baixa energia possível que é aquela onde o arranjo espacial da molécula tem a menor repulsão possível dos pares de elétrons ligantes e não ligantes. Isso faz com que tenhamos uma diferenciação entre vários estados de transição que leva a uma maior seletividade de uma reação orgânica em relação aos possíveis produtos que podem ser formados (Deslongchamps, 1983).
De uma maneira geral, os químicos tentam fazer sínteses (reações) orgânicas que formem predominantemente um único produto ou um produto principal em maior proporção, pois uma mistura de produtos pode acarretar na utilização de difíceis métodos de separação desses a fim de purifica-los. Chamam-se reações seletivas, aquelas que formam um produto exclusivamente, ou um produto preferencial em maior proporção. Reação quimiosseletiva é aquela que ocorre preferencialmente ou exclusivamente a um grupo funcional dentre vários outros em uma molécula. A reação que dá preferencialmente um dos vários estereoisômeros possíveis é referida como sendo uma reação moderadamente ou altamente estéreo-seletiva. Quando esses estereoisomeros possíveis de se formarem são diastereoisomeros, temos uma reação diastereoseletiva e a ocorrência de diastereo-seletividade. Quando os estereoisômeros são enantiômeros, temos uma reação enantio-seletiva, ou enantioseletividade.
Aspectos estereoquímicos da reação de adição nucleofílica[editar | editar código-fonte]
Exceto pelo formaldeído, as faces do grupo carbonila em aldeídos são proquirais. Nas cetonas, a proquiralidade acontece quando os dois substituintes ligados ao carbono carbonílico são diferentes. Se essas condições forem satisfeitas e não houver quiralidade presente nos substituintes R¹ e R², o grupo carbonila é enantiotópico, ou seja, numa reação de adição de um nucleófilo aquiral, uma mistura equimolar de enantiômeros se forma desde que a espécie nucleofílica seja diferente dos substituintes já ligados ao carbono carbonílico (ver esquema abaixo).[18]

Quando a adição é cineticamente controlada (não ocorre a reação de retroadição nucleofílica), a formação da mistura racêmica de enantiômeros é resultado da natureza enantiomérica de seus estados de transição. Estruturas enantioméricas possuem energias iguais em meio aquiral, e estados de transição de mesma energia produzem reações de igual velocidade. Se o controle da reação é termodinâmico (sob condições de equilíbrio), a mistura racêmica se forma como decorrência da relação enantiomérica dos produtos, que possuem a mesma energia em meio aquiral. A menos que haja intervenção de uma espécie quiral nesse processo que possa transferir a sua quiralidade ao centro proquiral, os produtos serão formados como mistura racêmica.
Faces proquirais enantiotópicas podem fornecer produtos de adição nos quais um enantiômero predomina sobre o outro. Esse tipo de transformação enantioseletiva é representativa de uma reação assimétrica e ocorre com frequência na natureza.[18]
Da mesma forma, iminas podem apresentar faces enantiotópicas sempre que dois substituintes diferentes estiverem ligados ao carbono da ligação C=N, levando à formação de um par de enantiômeros quando reagem com nucleófilos aquirais.[18]
Entretanto, nas nitrilas não há, sob qualquer hipótese, proquiralidade, pois a reação de adição nucleofílica conduz a um produto no qual o carbono está hibridizado sp².[18]
Por outro lado, o grupo carbonila pode estar inserido em um ambiente quiral, devido à presença de centros assimétricos em outros sítios da molécula. Nesse caso, suas faces são diastereotópicas, ou seja, a reação de adição de um nucleófilo aquiral gera uma mistura de diastereoisômeros, e tanto os estados de transição quanto os produtos são diasteroisoméricos. A não ser por coincidência, os diastereoisômeros são obtidos em quantidades diferentes, tanto em condições cinéticas quanto termodinâmicas (ver esquema abaixo).[18]

O excesso diastereoisomérico (ed = % de produto majoritário - % de produto minoritário) da reação é uma medida do predomínio de um diastereoisômero sobre o outro. Por exemplo, se uma mistura de diastereoisômeros é formada na proporção 90/10, o ed é igual a 80%. Como os diastereoisômeros apresentam propriedades físicas e espectroscópicas diferentes, a medida do ed é comumente feita por ressonância magnética nuclear ou por métodos cromatográficos.[18]
Síntese de acetais[editar | editar código-fonte]
Uma função acetal pode adotar nove conformações diferentes conforme figura abaixo. Confôrmeros A, B e D são imagens espelho dos conformeros A`, B`e D`respectivamente. Os conformeros C, E e F possuem um plano de simetria. Consequentemente a função acetal pode existir em seis diferentes conformações A-F. Evidenciais experimentais mostram a relativa estabilidade dessas várias conformações de acordo com os efeitos estereoeletrônicos e interações estéricas padrão.
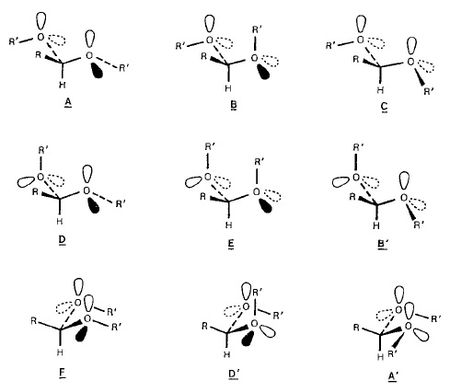
Efeitos estereoeletronicos influenciam a configuração e conformação de aceitais há muito tempo, particularmente em carboidratos onde esses efeitos foram descobertos primeiramente e discutidos em termos de efeitos anomérico e exo-anomérico. O termo efeito anomérico, introduzido por Lemieux, refere-se a tendência de um grupo alcoxi (O – R) de um anel piranose assumir a posição axial em vez da equatorial apesar da não favorável interação estérica, entretanto o termo efeito exo-anomérico diz respeito a orientação preferida da ligação O – R do grupo alcoxi no centro anomérico.
Em relação ao efeito anomérico, há duas considerações diferentes feitas para explicação do mesmo. Alguns autores consideram este efeito eletrônico como desestabilizador devido a repulsão dipolo-dipolo ou interações elétrons par a qual pode ser representada na estrutura abaixo. Outros autores consideram o efeito anomérico como um efeito de estabilização eletrônica o qual ocorre quando um elétron par de um átomo de oxigênio está orientado antiperiplanar em relação a uma ligação polar C – X (X= OR, NR2 ou halogênio). A estabilização do par de elétrons poderá então ter ganhos pela transferência parcial do par de elétron de um heteroátomo para outro átomo eletronegativo. Essa transferência está representada na estrutura abaixo.
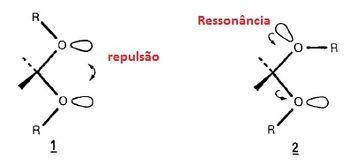
Na prática isso faz pouca diferença o fato de alguns autores acreditarem que efeito anomérico é desestabilizante ou estabilizante pois ambos acabam chegando na mesma conclusão em relação a estabilidade dos conformeros ou isômeros. Em resumo, para uma molécula que pode ter duas conformações diferentes (estruturas 1 e 2), se você considerar que o efeito anomérico é de estabilização por ressonância, isto indica que a estrutura 2 é mais estável que a 1 porque possui efeito de estabilização anomérica. Caso contrário, se considerar que o efeito anomérico é desestabilizante irá concluir que a estrutura 2 é mais estável que a 1 porque a estrutura 1 possui efeito anomérico de desestabilização (repulsão).
É possível e provável que ambos os efeitos estejam ocorrendo na função acetal. Em outras palavras, a estrutura 2 poderá ser mais estável que a estrutura 1 porque a estrutura 2 tem relativa estabilidade maior em relação a 1 por transferência parcial de elétrons e a estrutura 1 tem relativa desestabilidade em relação a estrutura 2 por conta da repulsão eletrônica dos pares não ligantes dos oxigênios. Desse modo,de uma maneira geral, a síntese de um acetal que possa ter conformação final resultante a estrutura 1 ou 2, terá como produto principal a estrutura 2.
Síntese de ésteres[editar | editar código-fonte]
No caso dos ésteres, foram propostos dois tipos de efeito estereoeletrônico. A função e a relativa importância desses dois tipos de efeito estereoeletronicos pode ser entendida pela análise em relação a geometria e a relativa estabilidade das duas formas, Z (cis) e E (trans) da função éster na figura abaixo.

Como já é conhecido, os ésteres são planares, e a forma cis é mais estável que a trans. O efeito eletrônico primário consiste da deslocalização do par de elétrons entre o oxigênio do éter e o grupo carbonil da função éster por ressonância. No caso da forma cis é possível haver uma estabilização adicional em relação a forma trans onde um par de elétrons não ligantes do oxigênio doa por ressonância para o orbital σ* da carbonila. No caso da forma trans essa estabilização não é possível. Outro efeito eletrônico secundário na função éster é o efeito anomérico como no caso dos acetais. A única diferença é que no éster a hibridização do carbono é sp2, trigonal, já nos acetais é tetraédrica sp3
O oxigênio da carbonila em ambas as configurações do estes, Z (cis) ou E(trans) tem um par de elétrons orientado antiperiplanar com a ligação C – OR, e uma interação n – σ* poderá existir porque o par de elétrons do orbital pode overlap com o orbital antiligante σ* da ligação C – OR. Em outras palavras, este efeito eletrônico secundário (efeito anomérico) pode dar uma característica de “tripla ligação” conforme ilustrado na figura abaixo para o grupo carbonil (O=C-OR).

Na forma Z, existe a possibilidade de outro efeito secundário porque nessa forma o oxigênio do éter tem um par de elétrons o qual está orientado antiperiplanar a ligação σ C – O do grupo carbonil, conforme figura abaixo. Este par de elétron pode overlap com o orbital antiligante σ* da ligação.

Desse modo, percebe-se que no éster de conformação Z, em adição ao efeito primário, existem dois efeitos eletrônicos secundários que faz com que o a forma Z seja mais estável que a forma E. Isso faz com que de um modo geral, a síntese de ésteres tenha como produto principal a conformação Z.
Exemplo de Efeito estereoletrônico na competição E2/Sn2[editar | editar código-fonte]
Os compostos (4-terc-butilciclohexil) trimetil-amonio iodeto e terc-butoxi de potássio (KOtBu) podem submeter-se tanto a reações E2 quanto a reação Sn2. No entanto a reatividade e a quimioseletividade variam consideravelmente em função da configuração cis ou trans do substrato derivado de ciclohexano. O isômero cis reage tanto por E2 quanto por Sn2 dando uma mistura de 90:10 em uma reação rápida. Já o isomêro trans reage muito mais lentamente dando somente o produto de substituição. De acordo com a equação da figura abaixo, essas descobertas significam que KE2, cis : KSn2, cis = 90:10 e KE2,trans : KSn2, trans < 1:99. Uma hipótese plausível é que para a respectivas reações de substituição KSn2, cis ~ KSn2, trans. Isto por sua vez, significa que a quimioseletividade oposta de duas reações na figura abaixo surgem quase exclusivamente do fato KE2,cis >> KE2, trans.

Essa graduação dos valores de KE2 se torna facilmente compreendida observando a figura abaixo e percebendo o seguinte: no estado de transição mais estável de uma eliminação E2 a quebra da ligação αC...H e a quebra da ligação βC....H são orientadas paralelo. Isto ocorre porque a hibridização do αC e βC muda de sp3 para sp2 no estado de transição. Como resultado, orbitais atômicos 2pz estão sendo formados como αC e αC e eles aumentam efetivamente a estabilidade do overlap da ligação π. Em outras palavras, ligações coplanares αC...H e βC....H estabilizam o estado de transição de uma reação de eliminação E2 através de uma interação π.

Interações desse tipo são possíveis no estado de transição mais estável de eliminações-syn. Quando o substrato pode assumir ambas as geometrias no estado de transição, a anti-eliminação é sempre preferida. Isto é consequência do baixo impedimento estérico do estado anti-transição, no qual substituintes do αC vs. βC estão quase parecidos. O estado de transição syn mais impedido estericamente tem uma estrutura quase eclipsada. Adicionalmente existem razões para acreditar que o overlap é melhor no estado de transição de uma anti-eliminação.
Atropoisomeria[editar | editar código-fonte]
Introdução[editar | editar código-fonte]
O termo atropoisomerismo provém da palavra grega “atropos”, que significa “ausência de rotação”. O fenômeno é atribuído a um eixo de ligação entre duas arilas que são impedidos de se rotacionarem dentro da molécula devido a um impedimento estérico, o que confere uma barreira energética entre os confôrmeros e permite identificar separadamente cada isômeros conformacional.[19]
A atividade óptica destes isômeros, chamados de atropoisômeros, provém da ligação sigma, que não necessitam da presença de um carbono quiral, onde a estabilidade está relacionada aos substituintes no sistema diaril. Em 1922, os bioquímicos Christie e Kenner conseguiram isolar pela primeira vez os isômeros do ácido 6,6'-dinitro-2,2'-difênico e observaram que não havia interconversão entre os atropoisômeros a temperatura ambiente.[19]

Uma regra proposta é que os atropoisômeros podem ser separados quando possuem tempo de meia vida maior que 1000 segundos e uma barreira energética mínima para as seguintes temperaturas:[20]
∆G° (200°K) = 61.6kJ/mol[20]
∆G° (300°K) = 93.5kJ/mol[20]
∆G° (350°K) = 109kJ/mol[20]
Nomenclatura[editar | editar código-fonte]
A nomenclatura dos compostos é feita da mesma forma dos isômeros ópticos provenientes do carbono quiral, R e S, seguindo a regra de prioridade proposta por Cahn-Ingold-Prelog. Primeiramente é feita a projeção do sistema bifenil na direção do eixo de ligação e posteriormente enumera-se os grupos funcionais com preferência ao mais próximo do observador. Com base na ordem de prioridade, determina-se a nomenclatura R(M) ou S(P) dependo do sentido obtido quando se caminha de maior prioridade para menor prioridade. Para diferenciar compostos ópticos atropoisômeros dos demais, pode ser utiliza o prefixo 'a', formando aS e aR.[19]

Classificação[editar | editar código-fonte]
Os atropoisomeros podem ser separados em duas classes:[20]
1) A primeira classe, chamada de Biaril em Ponte, “Bridged Biaryl”, sistema onde existe, além do eixo de ligação entre os dois anéis aromáticos, a ligação entre um dos ligantes de cada anel:
Exemplos
lignanas biaril em ponte ('Bridged biaryl lignans'):

Biaril com todos os carbonos em ponte ('All-carbon bridged biaryl'):

Lactonas de Biaril ('Biaryl Lactones'):

Biaril com multi ciclos ('Multicyclic Biaryls'):

Ciclopepitídeo de biaril ('Biaryl cyclopeptides'):

2) A segunda classe, chamada de Biaril sem Ponte(“NonBridged Biaryl”), onde só existe o eixo de ligação entre os dois anéis aromáticos:[3]
Exemplos:
Biaril Isocíclico ('Isocyclic Biaryls'):

Heterocíclico Fundido ('Fused Heterocycles'):

Heterobiarils ('Heterobiaryls'):

Biaril Multiplamente Acoplado ('Multiply Coupled Biaryls'):

Tipos de Atropoisomeros[editar | editar código-fonte]
Os atropoisomeros são usualmente encontrados em sistemas sp2-sp2 principalmente na forma de biarilas com ligantes na posição orto. A sintese pode ser realizada através da reação com compostos de Pd(0), o que que permite maior diversidade de grupos funcionais ligantes que em outras sinteses.[19]
Um exemplo de reação é o acoplamento de suzuki, tolerante à presença de vários tipos de grupos funcionais presentes nos substratos, em que os reagentes utilizados são o ácido arilborônicos com o haletos de arila.[19]

Outros atropoisômeros podem ser formados a partir de sistema sp2-sp2, sp2-sp3 e sp3-sp3 sem a necessidade de serem biarilas.[19]
Exemplos:
Sintetizada por Jabin e colaboradores com elevada estereosseletividade: enamidas cíclicas apresentam alta estabilidade mesmo em elevadas temperaturas[19]

Lomas e Dubois utilizaram mecanismo de adição nucleofílica para o 2-metilfenillítio sobre o carbono carbonílico da tercbutil-cetona, poduzindo um sistema sp2-sp3.[19]

Determinação dos Atropoisômeros[editar | editar código-fonte]
A determinação pode ser realizada pelos métodos:
- Cristalografia de raio-X, na qual determina-se o ângulo de torção e a conforção preferencial do sistema;
- Derivatização dos enantiomeros a diasteroisomeros por meio de reação, seguido de separação por comatografia em coluna;[19]
- Ressonância Magnética Nuclear (RMN) para uma mistura de diasteroisomeros;[19]
- Mistura racêmica de atropoisomeros podem também ser analisadas por RMN, onde utiliza-se complexos metálicos assimétricos capazes de complexar com os componentes da mistura analisada, favorecendo a formação de um par de diastereoisômeros.[19]
Aplicações[editar | editar código-fonte]
1) Sintese assimétrica catalítica:
Atropoisomeros enantiomericos puros são utilizados nesse tipo de sintese por forma "complexos organometálicos quirais, através da indução de quiralidade por diferenciação termodinâmica do sítio reativo dos substratos durante a catálise". Os atropoisomeros comerciais mais utilizados são bifenilnafto (BINOL) e bifenilfosfina (BINAP)[2]


2) auxiliar quiral em reações assimétricas:
"Um exemplo é o grupo amida onde o eixo de quiralidade geralmente se forma em torno de uma ligação C-N, favorecendo a remoção do grupo indutor de quiralidade ao final do processo sintético, devido à relativa labilidade química da ligação peptídica".[19]
Produtos Naturais e sintetisados[editar | editar código-fonte]
Os atropoisomeros são encontrados também em produtos naturais que apresentam atividade farmacológica importantes para química medicinal.
Exemplos:
1) A Kadsulignanas, substância utilizada no tratamento de desordem gastroentéricas e artrite reumatóide, é extraida da planta “Kadsura coccinea” e comumente utilizada na China[19]
2) A Vimblastina, é "um anticancerígeno natural que atua como inibidor da polimerização de tubulina em células tumorais"[19]
3) A Vancomicina , antibiótico atropoisomérico de origem natural é obtido como produto de fermentação de cepas da bactéria "Streptomyces orientalis". Até a década de 80 era um recurso recurso para o combate a bactérias resistentes à penicilina e seus derivados.[19]
4) O Gossipol, é um dialdeido polifenólico extraido através de sementes, troncos e raízes do algodão. Na década de 60 foi descoberto suas ações como contraceptivo e posteriormente, acharam que o composto possui "atividades antiviral e antiparasitária in vitro em concentrações da ordem de micro molar, além de pronunciada atividade antitumoral".[19]
5) Glicosideos de bisantraquínonas são extraidos do extrato seco das partes aéreas do "Hypericum perforatum L.". São utilizados no tratamento de depressão leve a moderada.[19]
Atividade óptica[editar | editar código-fonte]
Em 1815, o físico Jean-Baptiste Biot descobriu que certos ocorrência natural substâncias orgânicas, tais como cânfora e óleo de terebintina são capazes de rodar o plano de polarização. Ele observou que alguns compostos rotacionou no sentido horário o plano de polarização e outros anti-horário, enquanto alguns não girararam o plano de polarização. Ele previu que a capacidade de rodar o plano de polarização era atribuída a alguma assimetria nas moléculas. Van't Hoff e Le Bel posteriormente determinaram que a assimetria molecular estava associada com compostos que continham um ou mais carbonos assimétricos [8].
Atividade óptica é a habilidade de uma substância quiral rotacionar o plano de luz polarizada e pode ser medida utilizando um instrumento chamado polarímetro. A luz utilizada para medir a atividade óptica tem duas propriedades: é constituída por um único comprimento de onda e é polarizada no plano. O comprimento de onda utilizado geralmente é 589 nm, o qual corresponde a luz amarela produzida por uma lâmpada de sódio. A amostra é opticamente ativa se ela rotaciona o plano de luz polarizada. A direção e a magnitude são medidas usando um segundo filtro polarizador e a rotação observada é chamada α e é medida em graus.
Cada composto opticamente ativo tem uma rotação específica característica. A rotação específica é o número de graus de rotação causada por uma solução de 1,0 g do composto por mL de solução em um tubo de amostra de 1,0 dm a uma temperatura e comprimento de onda especificada. A rotação específica pode ser calculada a partir da rotação observada usando a seguinte fórmula:
onde [α] é a rotação específica; T é a temperatura em °C; λ é o comprimento de onda; α é a rotação observada comprimento do tubo da amostra em decímetros; e c é a concentração da amostra em gramas por mililitros de solução.; l é o comprimento da cubeta.
Para ser opticamente ativa a amostra deve conter uma substância quiral e um enantiômero deve estar presente em excesso em relação ao outro. Uma substância que não rodar o plano de luz polarizada é dito ser opticamente inativa. Todas as substâncias aquirais são opticamente inativas [8].
Compostos Meso
Os compostos meso são conhecidos por possuírem um ou mais carbono assimétrico, e possuir um plano de simetria, em que sua imagem refletida no espelho possui sobreposição. Baseado nisso, pode-se dizer que mesmo possuindo carbono quiral, essas substâncias não possuem enantiômeros e, consequentemente, ausência de atividade óptica ao incidir luz.[21]
Ambiente quiral
Uma forma de identificar enantiômeros é através da sua interação com ambiente quiral, que se assemelha como uma luva, na qual sua imagem refletida também não se sobrepõe. Cada molécula quiral poderá se acomodar em cada ambiente, o que acontece em sistemas biológicos onde há um sítio que só acomoda um enantiômero, são chamados de estereoespecífico.[22]
Exemplo:
A semente de alcaravia e goma de hortela possuem diferentes sabores e odores porém são estereoisômeros do mesmo composto carvone, uma cetona. O isomero R-(-)-carvone desloca a luz para esquerda, enquanto que S-(+)-carvone desloca para direita, porém ambos podem ser reduzidos por NaBH4 formando o mesmo álcool secundário.[22]

Os enantiômeros possuem propriedades físicas iguais, como ponto de fusão e ebulição, porém devido a receptores quirais em nosso sistema olfativo, podemos identificar cada um deles.[22]
SÍNTESE ASSIMÉTRICA
Para uma mesma substância, é possível existir diferentes enantiômeros que possuem ação diferenciada no organismo. Para aplicações nas área farmacêuticas, alimentícias, produção de agrotóxicos e perfumaria é necessário o uso de um enantiômero puro que algumas vezes é difícil de ser encontrado na natureza. Para essa produção é necessário o uso da síntese assimétrica, que possibilita a criação de novos centros quirais durante as etapas.[23]
Para a síntese faz-se necessário o uso de substratos quirais e pró-quirais onde a natureza é a única fonte, na qual encontramos os carboidratos, terpenos, α-aminoácidos e os alcalóides, além de alguns hidroxiácidos.[23]
Substratos quirais
O uso de substratos quirais para síntese foi bastante utilizado por Hannesian na década de 80 com objetivo de sintetizar produtos naturais. As reações diastereoseletivas são usadas para formação de centros estereogênicos.[23]

No exemplo acima, o substrato quiral (-)-α-pineno é convertido para (+)-pinenodiol através da hidroxilação da ligação pi pela face menos impedida estericamente, consequentemente, menor energia de ativação para sua formação. A partir do (-)-α-pineno novos produtos são formados ao reagir com a hidroxila menos impedida.[23]
Auxiliares quirais
Método utilizado em síntese assimétrica onde possibilita a criação de centros quirais a partir de material aquiral por meio de reações diastereosseletivas.[23]
Catalisador quiral
“Um substrato pró-quiral é diretamente convertido a um produto quiral pelo uso de um reagente aquiral na presença de um catalisador quiral, os quais podem ser divididos em duas classes: sintéticos (por exemplo, organometálicos) e biológicos (microorganismos e enzimas)”[23]
Reações enzimáticas
A produção de enantiômeros na natureza pode ocorrer através de enzimas quirais, mesmo que a substância inicial não seja opticamente ativa, o produto final será ativo e a reação sempre forma seletivamente um único enantiômero.[22]

Nessa reação a molécula é hidratada pela enzima quiral criando um produto com atividade óptica, pois forma seletivamente um único enantiômero.[22]
MÉTODOS DE SEPARAÇÃO
Agente quiral de derivatização
Para misturas racêmicas é possível isolar um enantiômero específico através de um agente de quiral de derivatização, como mostra a figura abaixo:[24]

Esse agente deve possuir as seguintes características:
(i) Ser enantiomericamente puro;
(ii) Ambas as 2 reações devem alcançar 100% de conversão;
(iii) Ambas as condições de reação não podem racemizar o centro esteriogênico;
(vi) Enantiômeros devem possuir um ponto de ataque para reação.
Exemplo de Agente:
1) Acido de Mosher (Mosher's Acid)[24]
Agente de derivatização utilizado para álcools e aminas, em que a reação forma diasteroisomeros com sinais de RMN diferentes entre si.

2) Sais[24]
Pode ser realizada em uma única etapa, sem a necessidade de derivatização do diasteroisomero e de fácil recuperação

Cromatografia com fase quiral
Além da Cromatografia líquida de alta eficiência (CLAE), a Cromatrografia em camada delgada (CCD) também pode ser empregada como uma técnica para a resolução direta de misturas racêmicas, isto é, que permite a separação de uma mistura racêmica em seus enantiômeros puros, utilizando-se, para isso, uma fase estacionária quiral. Tal separação ocorre por meio da formação de diastereoisômeros transientes, ou diastereoisômeros in situ, os quais são identificados por manchas na placa cromatográfica, e se formam a partir de interações intermoleculares entre os enantiômeros presentes na mistura racêmica e os componentes da fase estacionária quiral. Sabendo-se que os diastereoisômeros in situ formados são insolúveis em certo solvente, tem-se que quando as manchas são cortadas da placa e eluídas neste solvente, apenas os enantiômeros puros ficam em solução, o que pode ser analisado, após filtração, pelo uso de um polarímetro.[25]
Abaixo, tem-se a representação da função da fase estacionária quiral, esta que possui sítios ativos específicos para cada enantiômero, o que permite a separação.[24]
Ver também[editar | editar código-fonte]
Bibliografia consultada[editar | editar código-fonte]
- Barbosa, Luiz Claudio de Almeida, Introdução a Química Orgânica, editora UFV.
- Bruckner, R. Organic Mechanisms Reactions, Stereochemistry and Synthesis. Springer, 2010.
- Deslongchamps, P. Stereoelectronic Effects in Organic Chemistry. Pergamon: Oxford, 1983.
- Feltre, Ricardo, Fundamentos da química, volume único, 2°edição, Editora Moderna.
- Ingold, C. K. Structure and Mechanism in Organic Chemistry. 2nd Ed. Cornell University Press. Ithaca, N. Y. 1969.
- Kirby, A. J. Stereoelectronic Effects. Oxford University Press, Oxford, U. K., 1996.
- Robinson, Sir. R. Memoirs of a Minor Prophet. Elsevier, Amsterdan, 1976.
Referências
- ↑ a b c d e f g h i j k l m n Solomons, Thomas W; Fryhle, Craig B. (2012). Química orgânica 10 ed. [S.l.]: LTC
- ↑ a b c d e f g h i Harris, D. C.; Bertolucci, M. D. (1978). Symmetry and Spectroscopy. [S.l.]: Oxford
- ↑ a b c d March,J. Advanced Organic Chemistry. 4. ed. John Willey & Sons, Inc. 1992
- ↑ a b c d e f g Carrol, Felix (2007). Perspectives on Structure and Mechanism in Organic Chemistry. [S.l.]: Springer Science & Business Media. ISBN 978-0-470-27610-5
- ↑ a b c Juaristi, Eusebio; Stefani, Hélio A. (2012). Introdução à Estereoquímica e à Análise Conformacional. [S.l.]: Bookman Editora
- ↑ a b c d e f g h i j k l Carey, Frank A.; Sundberg, Richard J. (2007). Advanced organic chemistry : PART A. 5th ed. Berlin: Springer. ISBN 978-0-387-44897-8
- ↑ a b c d Smith, Michael B.; March, Jerry (2007). March's advanced organic chemistry: reactions, mechanisms, and structure. [S.l.]: John Wiley & Sons
- ↑ a b c d e f g h i j k l Eliel, Ernest L; Wilen, Samuel H. (1994). Stereochemistry Of Organic Compounds. New York: John Wiley and Sons. p. 597-611. ISBN 0-471-01670-5
- ↑ a b c Carey, Francis A. (2011). Química Orgânica 7 ed. [S.l.]: AMGH. ISBN 987-85-63308-22-1 Verifique
|isbn=(ajuda) - ↑ Juaristi, Eusebio (2012). Introdução à Estereoquímica e à Análise Conformacional. [S.l.: s.n.]
|nome2=sem|sobrenome2=em Authors list (ajuda) - ↑ McMurry,J. Organic Chemistry. 5. ed. Brooks/Cole. 2000
- ↑ Maher, T. J.; Johnson, D. A. Review of Chirality and Its Importance in Pharmacology. Drug Development Research. v. 24, p. 149-156, 1991.
- ↑ a b Lenfigwell, J. C. Chirality & Bioactivity I.:Pharmacology. Lenfigwell Reports. v. 3, 2003
- ↑ Clayden, Greeves, Warren and Wothers. Organic Chemistry. Oxford. 2001
- ↑ Boelens, M. H.; Boelens, H.; Van Gemert, L. J. Sensory Properties of Optical Isomers. Perfumer & Flavorist. v. 6, p. 1-15, 1993
- ↑ Barreiro, L. J.; Ferreira, V. F.; Costa, P. R. R. Substâncias enantiomericamente puras (sep): a questão dos fármacos quirais. Química Nova. v. 20, 1997
- ↑ Bridged bicycle rings. Disponível em: http://www.masterorganicchemistry.com/2014/08/14/bridged-bicyclic-rings-and-how-to-name-them/. Acesso em agosto 2015
- ↑ a b c d e f Substâncias carboniladas e derivados / Paulo Costa, Ronaldo Pilli, Sergio Pinheiro e Mário Vasconcellos. - Porto Alegre: Bookman, 2003. [S.l.: s.n.]
|nome1=sem|sobrenome1=em Authors list (ajuda) - ↑ a b c d e f g h i j k l m n o p q dos Santos, A. R.; Pinheiro,A. C.; Sodero, A. C. R.; da Cunha, A. S.; Padilha, M. C.; de Sousa, P. M.; Fontes, S. P.; ATROPOISOMERISMO: O EFEITO DA QUIRALIDADE AXIAL EM SUBSTÂNCIAS BIOATIVAS; Quim. Nova, Vol. 30, No. 1, 125-135, 2007
- ↑ a b c d e Bringmann, G. et al. Angew. Chem. Int. Ed. 2005, 44, 5384
- ↑ Paula Y. Bruice; Organic Chemistry; fourth edition
- ↑ a b c d e Chirality; http://butane.chem.uiuc.edu/cyerkes/Chem104ACSpring2009/Lecture_Notes_104/lect21c.html; Acessado em Agosto de 2015
- ↑ a b c d e f Sergio Pinheiro; Vítor F. Ferreira; ABORDAGENS EM SÍNTESE ASSIMÉTRICA; QUÍMICA NOVA; Volume 21; p. 312-318; 1998
- ↑ a b c d {{citar web | url=http://www.massey.ac.nz/~gjrowlan/stereo2/lecture2.pdf; | título= Título ainda não informado (favor adicionar) | publicado=www.massey.ac.nz }} Acessado em Agosto de 2015
- ↑ Bhushan, R.; Arora, Meenakshi (11 de abril de 2003). «Direct enantiomeric resolution of (±)-atenolol, (±)-metoprolol, and (±)-propranolol by impregnated TLC usingL-aspartic acid as chiral selector». Biomedical Chromatography. 17 (4): 226–230. ISSN 0269-3879. doi:10.1002/bmc.216


![{\displaystyle [\alpha \,]{_{D}20^{\circ }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edf85a4b81ab2b57da9acecbf95bb4fdc7ac75ab)



![{\displaystyle [\alpha ]_{\lambda }^{T}={\frac {\alpha }{l\times \rho }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ead9c29d557c3062adcb985a4e942a39e67e49a4)